乙肝相关性肝癌患者中Foxp3启动子区甲基化及其表达的研究*
陕西省人民医院 (西安710068) 党 珊 陈 谱 张冰斐 张 健 周 健 史丽萍
近年来研究认为肿瘤的发生、发展存在免疫微环境的紊乱,调节性T细胞(Treg)由于具有免疫抑制功能,在肿瘤免疫方面具有重要意义。转录因子Foxp3被认为是Treg细胞发育和功能维持的主要调节基因,能增强Treg细胞的免疫抑制功能,下调机体抗肿瘤免疫应答。进一步研究证实,在T细胞活化过程中,位于Foxp3基因第一外显子的一个CpG岛控制着Foxp3的表达。CpG岛的甲基化状态与外周血中Treg细 胞 表 达 Foxp3 有 关[1-2]。 乙 型 肝 炎 病 毒(HBV)感染是原发性肝癌(HCC)的首要病因,约占病因的50%[3]。大量研究表明HBV及其编码蛋白对宿主基因,尤其是肿瘤相关调控转录基因的影响,在HBV致癌过程中发挥重要作用,但机制仍不十分清楚。本实验从肿瘤免疫及表观遗传学角度入手,研究转录因子Foxp3启动子区的甲基化在乙肝相关性肝癌患者中的水平,探讨Foxp3在乙肝相关性肝癌发病中的意义,为乙肝相关性肝癌的治疗提供新的思路。
对象与方法
1 研究对象 选自2010年1月到2012年1月于第四军医大学西京医院肝胆外科住院的HCC手术患者的癌组织34例。肝癌组织标本参照美国肝病学会(2000)消化系统肿瘤分类进行临床和病理学诊断,入选患者诊断及临床病理资料均明确。伴有人类自身免疫缺陷病毒感染以及酒精性、自身免疫性肝病,丙肝患者均被除外,且每位患者在留取组织标本前均未接受放化疗及免疫治疗。本研究获得西京医院伦理委员会通过,并经患者知情同意。
2 主要仪器及试剂 酚氯仿异戊醇购自Wolsen公司,Bisulfite清洗柱购自Promega公司,焦磷酸试剂盒购自Qiagen公司,琼脂糖微珠购自GE Healthcare公司,RNA提取试剂盒TRIzol Reagant为Invitrogen公司产品,逆转录试剂盒购自Gibco公司,荧光定量PCR试剂盒购自Roche公司,引物由上海Invitrogen公司合成。RT-PCR仪购自BIO-RAD公司,焦磷酸测序仪购自Qiagen公司。
3 肝癌细胞中Foxp3mRNA检测 采用TRIzol一步法提取细胞总RNA,逆转录后得到cDNA后行real time RT-PCR,Foxp3引物正义:5’-ttctgtcagtccacttcacca-3’,反义5’-cacccaaagcctcagacct-3’;内参照18S引物正义:5’-cgccgctagaggtgaaattc-3’,反 义 5’-ctttcgctctggtccgtctt-3’。
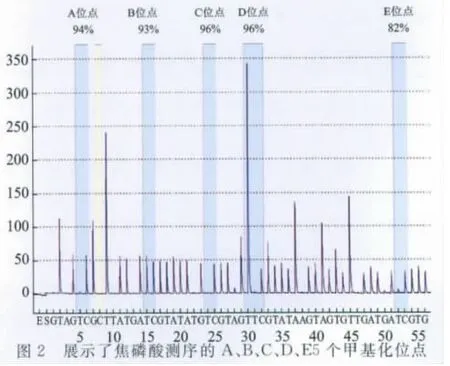
4 焦磷酸测序 经过Bisulfite处理的DNA通过焦磷酸测序的方法检测Foxp3启动子区的甲基化水平。准备8联管及琼脂糖微珠固定体系,在24孔板中加入25μl 0.3μM的测序引物,在真空泵中捕获微珠,清洗,释放微珠捕获的DNA,80℃孵育3min,室温冷却。根据提示往试剂仓中加入相应的碱基、酶和底物,上机检测。
5 统计学方法 数据采用SPSS16.0软件进行统计学分析。实验数据采用均数±标准差描述,组间比较在满足正态性和方差齐性要求时采用t检验;不满足正态性和方差齐性要求时采用秩和检验,P<0.05为差异有统计学意义。
结 果
1 Foxp3mRNA在HBV阳性及阴性肝癌组织中的表达 Foxp3mRNA在29例HBV阳性肝癌组织中为10.318±13.672,高于在5例HBV阴性肝癌组织中的表达3.510±2.414,差异有统计学意义(P<0.05)。
2 HBV阳性和阴性肝癌组织中Foxp3甲基化水平 见图1。Foxp3的甲基化水平在HBV阳性肝癌组织与HBV阴性肝癌组织中无明显差异,A-E5个位点均不具有统计学意义(P>0.05)。图2显示焦磷酸测序的5个甲基化位点。
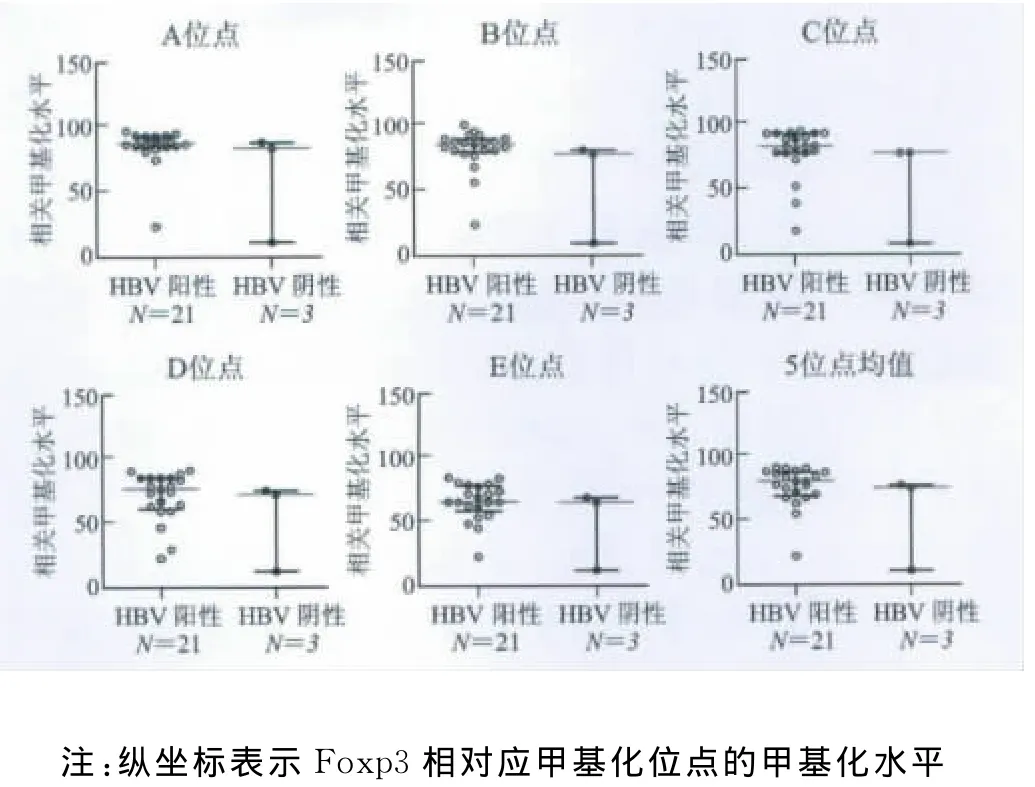
图1 Foxp3 5个常见甲基化位点的甲基化水平在HBV阳性和阴性肝癌组织中的比较
讨 论
研究认为,肝癌组织中Treg细胞数量较癌旁组织、正常肝组织明显增多,且与HCC的TNM分期、预后有关[4-5]。此外Treg细胞在维持对自身和外来抗原的免疫耐受中起重要作用,并可能参与HBV感染慢性化的过程,也就是说一方面可以抑制过度免疫病理损伤,另一方面也可能有利于病毒的持续感染[6]。这群细胞免疫调节功能的发挥与转录因子Foxp3的持续表达密切相关,Foxp3被看作是最重要且最具特异性的Treg细胞的标志。
本研究中HBV阳性肝癌组织中Foxp3mRNA的表达水平高于对照组,有统计学意义,提示HBV感染可上调Foxp3mRNA表达,据以往报道及该结果推测肝组织中Foxp3水平的增高可能是机体调节过度免疫反应的一种机制,HBV感染增加了进展为肝癌的风险[7]。该结果有助于加深我们对乙型肝炎免疫发病机制的认识,对阐明HBV逃逸机体免疫反应、引起持续性感染的机制具有重要意义。
最新研究表明Foxp3长期、稳定存在离不开以DNA甲基化为代表的表观遗传学调控,而关于乙肝相关性肝癌中Foxp3甲基化的水平,目前国内外文献尚未见报道。本实验结果显示HBV阳性与阴性肝癌组织中Foxp3的甲基化水平不具有统计学差异,这说明乙肝相关性肝癌中引起Foxp3升高的调控机制可能与甲基化无关,或者调控方式是多方面的,甲基化可能不起主要作用。
综上所述,本研究发现HCC患者中HBV感染使Foxp3mRNA表达升高,Foxp3mRNA表达升高可能不是或不完全是通过甲基化修饰来调控的。进一步可在细胞水平敲除HBx蛋白观察Foxp3甲基化水平的变化来证实二者的关系,此外,乙肝相关性肝癌的免疫发病机制是复杂的,寻找有效调控Foxp3mRNA表达的手段对乙肝相关性肝癌的治疗有重要意义。
[1] Janson PC,Winerdal ME,Marits P,et al.FOXP3promoter demethylation reveals the committed Treg population in humans[J].PLoS ONE,2008,3(2):1612.
[2] Huehn J,Polansky JK,Hamann A.Epigenetic control of FOXP3expression:the key to a stable regulatory T-cell lineage[J].Nat Rev Immunol,2009,9(2):83-89.
[3] Hashem B,El-Serag.Epidemiology of Viral Hepatitis and Hepatocellular Carcinoma[J].Gastroenterology,2012,142(6):1264-1273.
[4] Kobayashi N,Hiraoka N,Yamagami W,et al.Foxp3+regula-tory T cells affect the development and progression of hepatocarcinogenesis[J].Clin Cancer Res,2007,13(3):902-911.
[5] 肖时湘,韩 涛,王媛媛,等.调节性T细胞在慢性肝病中的变化[J].陕西医学杂志,2010,39(7):831-833.
[6] Belkaid Y,Rouse BT.Natural regulatory T cells in infectious disease[J].Nat Immunol,2005,6(4):353-360.
[7] Aalaei-Andabili SH,Alavian SM.Regulatory T cells are the most important determinant factor of hepatitis B infection prognosis:a systematic review and meta-analysis[J].Vaccine,2012,30(38):5595-5602.

