酸枣仁汤对GABAB1R介导快动眼睡眠剥夺老年大鼠下丘脑室旁核cAMP-PKA-CREB信号通路的影响
游秋云 王平 张舜波 黄攀攀 章程鹏
·基础研究·
酸枣仁汤对GABAB1R介导快动眼睡眠剥夺老年大鼠下丘脑室旁核cAMP-PKA-CREB信号通路的影响
游秋云 王平 张舜波 黄攀攀 章程鹏
目的观察酸枣仁汤对快动眼睡眠被剥夺老年大鼠下丘脑室旁核(PVN)cAMP-PKA-CREB信号通路的影响。方法将自然衰老24月龄Wistar大鼠随机分成空白对照组(等容生理盐水),老年REM睡眠剥夺组(等容生理盐水),阳性对照组(舒乐安定0.18 mg/(kg·d),酸枣仁汤低、高剂量组(12.96、25.92 g/(kg·d)。各组灌胃给药2周后,除空白对照组外其余各组用自制改良多平台法剥夺大鼠睡眠48 h制作老年大鼠REM睡眠剥夺模型。采用免疫组化方法检测大鼠PVN内GABAB1R阳性反应物的变化;采用酶联免疫法和免疫组织化学法检测PVN部位环腺苷酸(cAMP)和磷酸化cAMP反应元件结合蛋白(CREB)水平变化,检测PVN匀浆液中磷酸二酯酶(PDE)活性的变化。结果与空白对照组比较,老年REM睡眠剥夺组大鼠PVN部位的GABAB1 R阳性反应物数目明显增多(P<0.01),cAMP和p-CREB水平均明显降低,PDE活性明显增高(P<0.01);与老年REM睡眠剥夺组比较,酸枣仁汤低、高剂量组大鼠PVN部位的GABAB1 R阳性反应物数目明显减少(P<0.01),cAMP和p-CREB水平均明显提高,PDE活性明显降低(P<0.01)。结论实验结果表明,酸枣仁汤可能通过增强GABAB1 R表达来激活cAMP-PKA-CREB信号通路而发挥安神健脑作用。
老年失眠酸枣仁汤大鼠模型机制
酸枣仁汤出自 《金匮要略》,由酸枣仁、茯苓、知母、川芎、甘草等五味药组成,诸药相伍共奏养血安神,清热除烦之功。临床主治由肝血不足,阴虚内热引起的虚烦不眠证。现代研究表明,该方具有镇静催眠、抗焦虑、抗应激、改善睡眠时相结构等作用[1-2]。课题前期研究通过促眠实验以及Morris水迷宫检测学习记忆实验,证实了酸枣仁汤的镇静催眠及改善学习记忆能力作用[3],并与脑内氨基酸类神经递质的调节密切相关[4]。为进一步探索酸枣仁汤改善睡眠质量及脑保护的作用机制,本课题拟检测氨基酸类神经递质γ-氨基丁酸(GABA)的B型受体GABAB1R介导下丘脑室旁核(PVN)腺苷酸环化酶-环腺苷酸-蛋白激酶A-cAMP反应元件结合蛋白(AC-cAMP-PKA-CREB)学习记忆信号转导通路中的GABAB1R、cAMP和CREB等的表达和变化,探讨酸枣仁汤对老年失眠的作用机制。
1 材料与方法
1.1 实验动物自然老年健康24月龄W istar大鼠,雌雄各半,140只,体重500~600 g,由湖北省实验动物研究中心提前订购提供,许可证号SCXK(鄂)2008-0005。
1.2 药物与试剂酸枣仁汤由酸枣仁30 g、知母12 g、茯苓12 g、川芎12 g、甘草6 g组成。全部药材购自湖北中医药大学附属医院药房,常规方法 (以上方药加5倍于药材的温水,浸泡30 m in后微火煎煮15 min、文火煎20 min,滤出药渣,分别将药液浓缩成每毫升含生药0.648、1.296 g/L药液)煎煮后经水提制成浓度为64.8%、129.6%,分装灭菌后4℃保存备用。分别按12.96、25.92 g/(kg·d)剂量(按体表面积系数换算,分别为人体临床等效剂量的2倍和4倍)给药。舒乐安定片,山西亨瑞达制药有限公司生产,批号111203。戊巴比妥钠,北京化学试剂公司;多聚甲醛,北京化学试剂公司;3-3二氨基联苯胺 (DAB)显色试剂盒,北京中山生物技术有限公司;30%H2O2,北京化学试剂公司;0.01M PBS,2000 m L/袋(北京中杉金桥生物技术有限公司);甲醇 (北京化学试剂公司);正常山羊血清 (工作液,北京中杉金桥生物技术有限公司);5%牛血清白蛋白(BSA,北京中杉金桥生物技术有限公司);GABA_B1抗体(lioworld公司);GABABR1抗体(lioworld公司);兔ABC Kit(北京中杉金桥生物技术有限公司);GENMED染色液C、H-E STAINING Kit(GENMED公司,美国);多克隆PCREB Ser133抗体购于CellSignaling Biotechnology。酶联免疫法(EIA)检测cAMP试剂盒购于Cayman Chemical。cAMP和孔雀石绿购于Sigma。SP免疫组化试剂盒 (含羊抗兔二抗)和DAB显色剂 (北京中山生物技术公司)。
1.3 仪器与设备 睡眠剥夺箱 (自制),为长72 cm、宽48 cm、高30 cm的鼠箱,内置6个直径为8 cm,高8 cm的平台,平台间隔16 cm,平台与鼠箱箱体壁间隔8 cm,在平台周边注满水,水面距平台面约1.0 cm,大鼠在平台上可自行饮食饮水,并可在不同平台上自由活动,于箱体上放平行的不锈钢丝笼罩,上面放水和食物;环境对照箱 (自制),与睡眠剥夺箱相似,但在距其底部8.0 cm处不放置平台,而是放置一面细密铁丝网,大鼠在网上可自由活动,其他条件均与睡眠剥夺组相同,以形成与睡眠剥夺组相似的环境;恒温冷冻切片机(Leica,德国);显微镜(Nikon,日本)。
1.4 动物分组及给药 将自然老年24月龄W istar大鼠50只(雌雄各半),随机分成5组,每组10只:空白对照组、老年REM睡眠剥夺组、舒乐安定组 (阳性对照组)、酸枣仁汤低、高剂量组。酸枣仁汤由酸枣仁30 g、知母12 g、茯苓12 g、川芎12 g、甘草6 g组成。舒乐安定组大鼠按0.18 mg/(kg·d)给药,酸枣仁汤低、高剂量组分别按12.96、25.92 g/(kg·d)给药,给药容量均为2 m L/100 g。1次/d,连续2周。空白对照组、老年REM睡眠剥夺组均灌服等容积生理盐水。
1.5 老年REM睡眠剥夺大鼠模型的制备及给药对模型组大鼠采用改良多平台水环境法[5],放置于自制的睡眠剥夺箱进行REM睡眠剥夺48 h。空白对照组则放置于环境对照箱中。
1.6 大鼠脑内PVN部位GABAB1R阳性反应物谷氨酸受体NMDANR1[6]检测将大鼠用多聚甲醛灌注,取出大脑,置于4%的多聚甲醛中后固定10 h,然后将脑组织置于30%的蔗糖中4℃保存。组织用冷冻片机切片,放在4℃预冷的丙酮中后固定,采用ABC法染色。拍摄图像在显微镜物镜40倍和数码相机4倍,光学放大下进行照像。每组随机测试6张切片,每一部位随机测试2个视野;分别测量阳性细胞数目。
1.7 大鼠脑内PVN部位cAMP-PKA-CREB信号通路[7]检测方法
1.7.1 酶联免疫分析法(EIA法)检测cAMP给药结束后,断头处死动物,冰上取出下丘脑组织,称重后于质量分数为5%的TCA缓冲液中匀浆。匀浆液4℃下1 500 g离心10 min,收集上清储存在-70℃冰箱待测。加样:分别设空白孔、标准孔、待测样品孔。空白孔加样品稀释液100μL,余孔分别加标准品或待测样品100μL,轻轻晃动混匀,酶标板加上盖或覆膜,37℃反应120 min。弃去液体,甩干,不洗。每孔加检测溶液A工作液100μL(使用前1 h内配制),酶标板加上覆膜37℃反应60 min。温育60 min,弃去孔内液体,甩干,洗板3次,每次浸泡2 min,大约400μL/每孔,甩干。每孔加检测溶液B工作液(同检测A工作液)100μL,酶标板加上覆膜37℃反应60 min。温育60 min后,弃去孔内液体,甩干,洗板5次,每次浸泡2 min,350μL/每孔,甩干。依序每孔加底物溶液90μL,酶标板加上覆膜37℃避光显色。依序每孔加终止溶液50μL,终止反应。用酶联仪在450 nm波长依序测量各孔的光密度(OD值)。
1.7.2 免疫组织化学法检测CREB给药结束后进行麻醉后,灌流固定,取脑切片,切制含PVN部位的间脑连续冠状切片 (厚度4μm)。切片常规脱蜡至水。92℃枸橼酸盐缓冲液(pH 6.0)中抗原热修复10 min,室温冷却30 m in。质量分数为3%双氧水室温作用10 min以消除内源性过氧化物酶活性,非特异性位点用羊血清室温封闭15 m in。加一抗P-CREB抗体稀释液4℃过夜。滴加羊抗兔二抗37℃孵育15 min,滴加SP复合物37℃孵育15 min。DAB显色,双蒸水终止反应。常规脱水透明,中性树胶封片。观察高倍镜下胞内有棕色颗粒者为表达CREB的阳性细胞。计数每组各5只动物PVN部位CREB阳性细胞数目。
1.7.3 酶活性检测方法检测磷酸二酯酶(PDE)活性标准品的稀释与加样:在酶标包被板上设标准品孔10孔,在第一、第二孔中分别加标准品100μL,然后在第一、第二孔中加标准品稀释液50μL,混匀;然后从第一孔、第二孔中各取100μL分别加到第三孔和第四孔,再在第三、第四孔分别加标准品稀释液50μL,混匀;然后在第三孔和第四孔中先各取50μL弃掉,再各取50μL分别加到第五、第六孔中,再在第五、第六孔中分别加标准品稀释液50μL,混匀;混匀后从第5、6孔中各取50μL分别加到第7、8孔中,再在第7、8孔中分别加标准品稀释液50 μL,混匀后从第7、8孔中分别取50μL加到第9、10孔中,再在第9、10孔分别加标准品稀释液50μL,混匀后各出50μL弃掉(稀释后各孔加样量都为50μL,浓度分别为300 nmol/L、200 nmol/L、100 nmol/L、50 nmol/L、25 nmol/L)。分别设空白孔 (空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。在酶标包被板上待测样品孔中先加样品稀释液40 μL,然后再加待测样品10μL。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀。用封板膜封板后置37℃温育30 min,稀释后备用。弃去液体,甩干,每孔加满洗涤液,静置30 s后弃去,重复5次,拍干。除空白孔外,每孔加入酶标试剂50μL。温育操作同3。洗涤操作同5。每孔先加入显色剂A50μL,再加入显色剂B50μL,37℃避光显色15 min。每孔加终止液50μL,终止反应。以空白空调零,450 nm波长测量各孔的吸光度 (OD值)。
2 结果
2.1 酸枣仁汤对老年REM睡眠剥夺大鼠脑内PVN部位GABAB1R阳性反应物的影响与空白对照组比较,老年REM睡眠剥夺组大鼠大脑PVN部位的GABAB1R阳性反应物数量明显增多(P<0.01);与老年REM睡眠剥夺组比较,酸枣仁汤低、高剂量组大鼠大脑PVN部位的GABAB1R阳性反应物数量明显减少(P<0.01)。见表1。
表1 各组大鼠脑内PVN部位GABAB1R阳性反应物的影响比较 (±s)
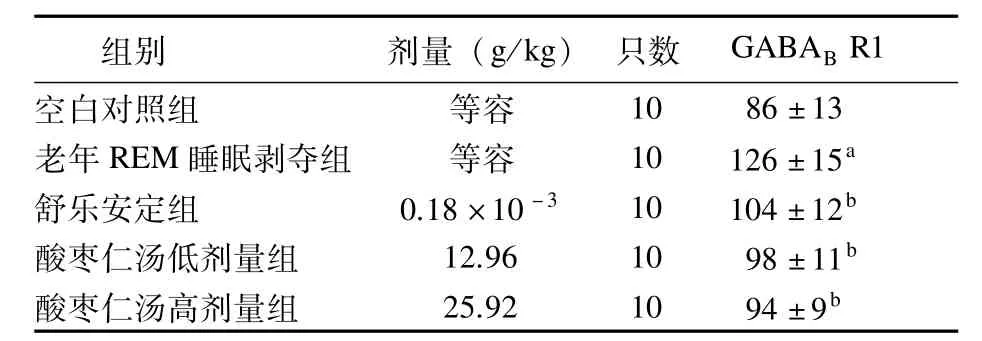
表1 各组大鼠脑内PVN部位GABAB1R阳性反应物的影响比较 (±s)
注:与空白对照组比较,aP<0.01;与老年REM睡眠剥夺组比较,bP<0.01
组别 剂量(g/kg)只数 GABABR1空白对照组 等容10 86±13老年REM睡眠剥夺组 等容 10 126±15a舒乐安定组 0.18×10-3 10 104±12b酸枣仁汤低剂量组 12.96 10 98±11b酸枣仁汤高剂量组 25.92 10 94±9b
2.2 各组大鼠脑内PVN部位cAMP-PKACREB信号通路指标比较与空白对照组比较,老年REM睡眠剥夺组大鼠大脑PVN部位cAMP和p-CREB水平均明显降低,PDE活性明显增高(P<0.01);与老年REM睡眠剥夺组比较,酸枣仁汤低、高剂量组大鼠大脑PVN部位cAMP和p-CREB水平均明显提高,PDE活性明显降低(P<0.01)。见表2。
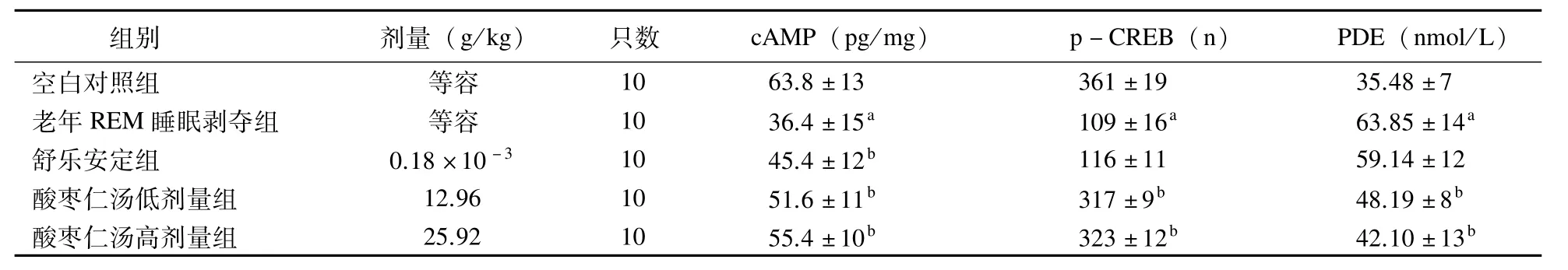
表2 各组大鼠脑内PVN部位cAMP-PKA-CREB信号通路中的
3 讨论
前期实验采用D-半乳糖复制亚急性衰老大鼠模型,虽然自由基水平接近自然衰老大鼠,但是由于该衰老模型是由化学损伤造成的,难以真实反映衰老的生理生化改变,因此本课题改进造模方法而选用自然老年24月龄W istar大鼠,采用国际上公认的多平台水环境法剥夺睡眠48 h,建立老年大鼠睡眠剥夺模型。下丘脑室旁核 (PVN)是人体神经内分泌及自主神经系统的重要整合中枢核团,它参与各种应激反应的调节。γ-氨基丁酸是中枢神经系统抑制性神经递质,其对学习记忆的影响主要是通过其受体来介导完成。GABA受体主要有GABAA、GABAB两种类型受体,其中GABA B受体是G -蛋白偶联受体[8]。GABA B受体根据解剖定位及生理功能的差异可分为突触前受体和突触后受[9]。突触前GABA B受体又分为异身受体和自身受体[10],其异身受体可能降低兴奋性神经递质谷氨酸 (Glu)释放,介导突触前抑制[11],而其自身受体则可降低抑制性神经递质GABA的释放,介导突触前去抑制,解除GABA产生的突触前抑制所造成的Mg2+对谷氨酸受体NMDA受体离子通道的阻抑作用,有利于去极化[12]。突触后的GABA B受体可以通过G蛋白而激活K+通道,也可通过第二信使 (如花生四烯酸AA)途径而激活K+通道引起K+大量内流产生突触后膜超极化[13]。GABAB1R是GABABR受体的主要部分。研究表明,在PVN内有表达GABAB1R的神经元[14],本实验通过观察老年失眠大鼠的GABAB1R变化,探讨其对学习记忆能力的改变具有重要的意义。另外,前期实验研究结果表明,睡眠剥夺可造成记忆力减退,酸枣仁汤可发挥脑保护作用而改善学习记忆能力[7]。可见CREB作为cAMP反应元件结合蛋白对于认知功能至关重要。实验结果显示,GABABR作为G蛋白偶联受体(GPCRS),酸枣仁汤能增加其在大脑下丘脑部位的表达,可明显提高大脑下丘脑PVN部位cAMP和p-CREB水平,降低PDE活性明显降低,能激活cAMP-PKA-CREB信号通路发挥安神健脑作用。提示酸枣仁汤可能通过增强GABAB1 R表达来介导并激活cAMP-PKACREB信号通路而发挥安神健脑作用。该研究为酸枣仁汤的临床应用提供了理论支持,有望为老年失眠的防治开辟新的思路。
[1] 李玉娟,刘雯,杨静玉,等.酸枣仁汤的镇静催眠作用[J].沈阳药科大学学报,2002,19(2):l15-l16.
[2] 金阳,李飞,李廷利.酸枣仁汤对失眠大鼠睡眠时相的影响[J].时珍国医国药,2008,19(6):1355-1356.
[3] 游秋云,王平,吴丽丽,等.酸枣仁汤对老年失眠证候模型大鼠学习记忆及脑内自由基、NOS的影响[J].中华行为医学与脑科学杂志,2010,19(10):885-887.
[4] 游秋云,王平,孔明望,等.酸枣仁汤对老年失眠证候模型大鼠脑组织谷氨酸、γ-氨基丁酸及γ-氨基丁酸A受体表达的影响[J].中国实验方剂学杂志,2010,16(14):119-123.
[5] 崔开宇,王平,游秋云.益智仁挥发油对大鼠快动眼睡眠剥夺恢复后脑组织氨基酸类神经递质含量及其受体表达的影响[J].中国实验方剂学杂志,2013,19(4):223-227.
[6] 刘燕,刘晓兰,宋月晗,等.四逆散对疲劳大鼠学习记忆及脑内GABA_B1表达的影响[J].现代生物医学进展,2011,11(1):5-7.
[7] 王玉珠,王永胜,楚世峰,等.人参皂苷Rgl促智信号转导途径研究[J].中国药理学通报,2008,24(6):740-743.
[8]Bormann J.The“ABC”of GABA receptors[J].Trends Pharmacol Sci,2000,21:16-19.
[9]LingridgeGL,RandallAD.The synaptic activition of NMDA and Ca2+signaling in neurons[J].Ciba Eound Syrup,1992,164:162-171.
[10]Nelson MT,ConmayMA,KnotHJ.Cloride channel blockers inhibitmyogenic tone in rat cerebral artcries[J].JPhysiol,1997,502:259-264.
[11]BonannoG,FassioA,Schm id G,el al.Pharmacologi-cally dlstinstGABAa recap to rs that mediate inhibition of GABA and glutamate release in human neocortex[J].Br JPharmacol,1997,120(1):60-64.
[12]CollingridgeGL,RandallAD.Thesynaptieactivition of NMDA and Ca2+signalling in neurons[J].Ciba Found Symp,1992,164:162-171.
[13]M isgeld U,Bijak M,Jarolimek W.A 1physiological role for GABAB receptors and the effects of baclofen in the mammalian central nervous system[J].Prog Neurobi0I,1995,46:423-446.
[14]Li D,PanH.Role ofγ-Am inobutyric Acid(GABA)A and GABAB receptors in paraventricular nucleus in control of sympathetic vasomotor tone in hypertension[J].JPharmacolExp Ther,2007,320:615-626.
Effects of Suanzaoren Decoction on cAM P-PKA-CREB Signaling Pathway in Hypothalamic Paraven tricular Nuclear(PVN)Mediated by GABAB1R in Agedrat with REM Sleep Deprivation
You Qiuyun,Wang Ping*,Zhang Shunbo,Huang Panpan,Zhang Chengpeng.*Hubei University of Chinese Medicine,Wuhan 430065,China
WangPing,Key Laboratory of Dementia on Xinnao-Yizhi,the National Chinese Medicine Administrative Bureau.E-mail:pwang54@aliyun.com
ObjectiveObserve the effect of Suanzao-Rentang on cAMP-PKA-CREB signaling pathway in hypothalam ic paraventricular nuclear(PVN)ofaged ratwhose rapid eyemovement sleep has been deprived.MethodsNatural age24 month-old Wistar rats arerandom ly divided into control group(isovolumetric saline),REM sleep deprivation elderly group(isovolumetric saline),positive control group(estazolam 0.18 mg/(kg·d),Suanzao-Rentang low and high dose group(12.96,25.92 g/(kg·d).Each group isgiven intragastric administration for two weeks.A fter that,except for the control group,each group ismade REM sleep deprivation 48hours production model of old rats with homemade improved multi-platform.Then,we use Immunohistochem istry for detecting changes of GABAB1R positive reactant in the rat PVN,enzyme-linked immunosorbent assay and immunohistochem istry for detecting changes of cyclic adenosinemonophosphate(cAMP)in part of PVN and cAMP response element binding protein(CREB)levels,aswell as activity of homogenate phosphodiesterase(PDE)in PVN.ResultsCompared with the control group,the amount of positive reaction GABAB1 R in PVN sitessignificantly increases(P<0.01),cAMP and p-CREB levels significantly reduce,PDE activity significantly increases(P<0.01)in the REM sleep deprivation oldrats;compared with the older group in which the rates’REM sleep hasbeen deprived,the positive reaction amountof GABAB1 R in PVN significantly reduces(P<0.01),cAMPbutp-CREB levels significantly increases,PDE activity significantly reduces(P<0.01)in Suanzao-Rentang low and high-dose group of rats.ConclusionThe results show that Suanzao-Rentang possibly play a role in brain nerves by enhancing GABAB1 R expression whichactivates cAMP-PKA-CREB signaling pathway.
elderly insomnia;SZRT;model rats;mechanism
国家自然科学基金(编号:81072849)
430065武汉,湖北中医药大学药学院(游秋云);国家中医药管理局老年性痴呆醒脑益智重点研究室(王平、张舜波、黄攀攀、章程鹏)
王平,E-mail:pwang54@aliyun.com

