非梗阻性无精子症患者TSG23基因的单核苷酸变异分析*
江智茂 龚英皓 李俞池 林首任 陈剑波 桂耀庭
北京大学深圳医院男性生殖与遗传重点实验室(深圳 518036)
·论 著·
非梗阻性无精子症患者TSG23基因的单核苷酸变异分析*
江智茂 龚英皓 李俞池 林首任 陈剑波 桂耀庭**
北京大学深圳医院男性生殖与遗传重点实验室(深圳 518036)
目的分析TSG23基因在非梗阻性无精子症患者中单核苷酸变异。方法采用第二代高通量测序方法对临床收集的776例非梗阻性无精子症患者和709例已正常生育男性的外周血DNA进行TSG23基因外显子捕获测序;采用传统的Sanger测序技术对第二代高通量测序发现的新的突变位点进行验证。结果经过对测序质量控制和外显子测序结果分析筛选,有757例患者和709例的测序结果纳入生物信息学分析,共获得7个突变位点,其中3个为同义突变,4个为错义突变,有4个位点为新发现突变位点;所有位点中非梗阻性无精子症患者特有的突变位点1个,为同义突变,已育正常男性特有的突变位点2个,均为错义突变。结论 现有的检测结果显示,TSG23基因的单核苷酸变异与非梗阻性无精子症的发生无明显的相关性。
无精子症; 基因; 单核苷酸变异
不孕不育症是一类严重危害人类身心健康的疾病。根据世界卫生组织的统计资料,不孕不育症占育龄夫妇的20%左右,其中男性因素导致不孕不育的占50%[1]。随着社会工业化程度的提高和生活节奏的加快,加上环境污染和不良生活习惯等因素,男性精液质量日趋下降,男性不育人数呈逐年上升趋势,男性生殖健康的问题越来越受到全社会的关注[2]。
无精子症是男性不育的重要原因之一,占男性不育的20%~25%左右[3,4]。有30%~40% 的无精子症患者病因不明,称为原发性无精子症[5]。近年来,随着现代分子生物学技术的发展,人们已发现近200个基因与男性不育症的发生密切相关,近400个基因与小鼠精子发生密切相关[6],这些基因的突变或缺失,可能是某些原发性男性不育症发生的重要原因。
本实验室采用基因组芯片技术,发现一个睾丸表达特异性新基因,其蛋白质分子量为23 kd,故命名为睾丸特异性高表达基因23(Testis specific gene 23,TSG23)。该基因仅在出生后15d以后的小鼠睾丸组织和成人睾丸中表达,且呈年龄依赖性升高;与正常睾丸组织比较,TSG23在无精子症患者睾丸组织中的表达显著减少或消失[7]。上述结果提示该基因在精子发生的过程中可能具有重要作用。本研究收集了776例非梗阻性性无精子症患者和709例已正常生育男性的血液标本,采用外显子捕获测序、PCR和Sanger测序方法,检测并验证TSG23基因在非梗阻性无精子症患者的单核苷酸变异,探讨TSG23基因与无精子症发生的相关性。
材料与方法
一、临床样本收集
本课题组从2007年6月至2011年10月共收集1 880例无精子症患者,其中非梗阻性无精子症患者776例,筛选标准:随机检查三次精液中均无精子;无生殖系统阻塞、炎症和损伤;无核型异常和Y染色体微缺失。另将709例正常生育男性(至少育有一孩,且未行IVF、ICSI、IMSI等人类辅助生殖技术)作为对照组进行研究。每例受试者均签署知情同意书,本研究通过北京大学深圳医院医学伦理委员会的审查批准。
二、DNA提取和基因捕获测序
采用QIAamp DNA Blood Mini Kit试剂盒提取外周血基因组DNA,取出5μg基因组DNA送深圳华大基因研究院进行外显子捕获测序。
三、PCR和Sanger测序
以外周血基因组DNA为模板,使用设计合成的两对引物对新发现的单核苷酸变异进行PCR特异性扩增,条件为:98℃预变性5min,然后以98℃ 10s、60℃ 30s、72℃ 45s进行35个循环,最后72℃延伸5min,产物在4℃保存,送上海立菲生物技术有限公司测序。引物序列见表1。

表1TSG23单核苷酸变异验证引物序列
四、统计学分析
采用卡方检验或Fisher精确检验方法对数据进行分析,P<0.05为具有统计学意义。
结 果
一、TSG23基因的单核苷酸变异
经过对测序质量控制和外显子测序结果分析筛选,有757例患者和709例的测序结果纳入生物信息学分析,共获得7个突变位点,其中3个为同义突变,4个为错义突变,在已有数据库中可以找到3个位点,分别为rs141224523、rs3827040和rs146821586,有4个位点为新发现突变位点;所有位点中非梗阻性无精子症患者特有的突变位点1个,为同义突变,正常生育男性特有的突变位点2个,均为错义突变(见表2)。与正常生育男性比较,非梗阻性无精子症患者TSG23基因单核苷酸变异无显著性差异。

表2TSG23在非梗阻性无精子症和正常生育男性中的点突变情况
二、Sanger测序法验证结果
采用传统的Sanger测序技术对第二代高通量测序发现的新的突变位点进行验证。结果显示,在验证的9例结果中,均为杂合突变(见图1),与第二代高通量测序结果一致。
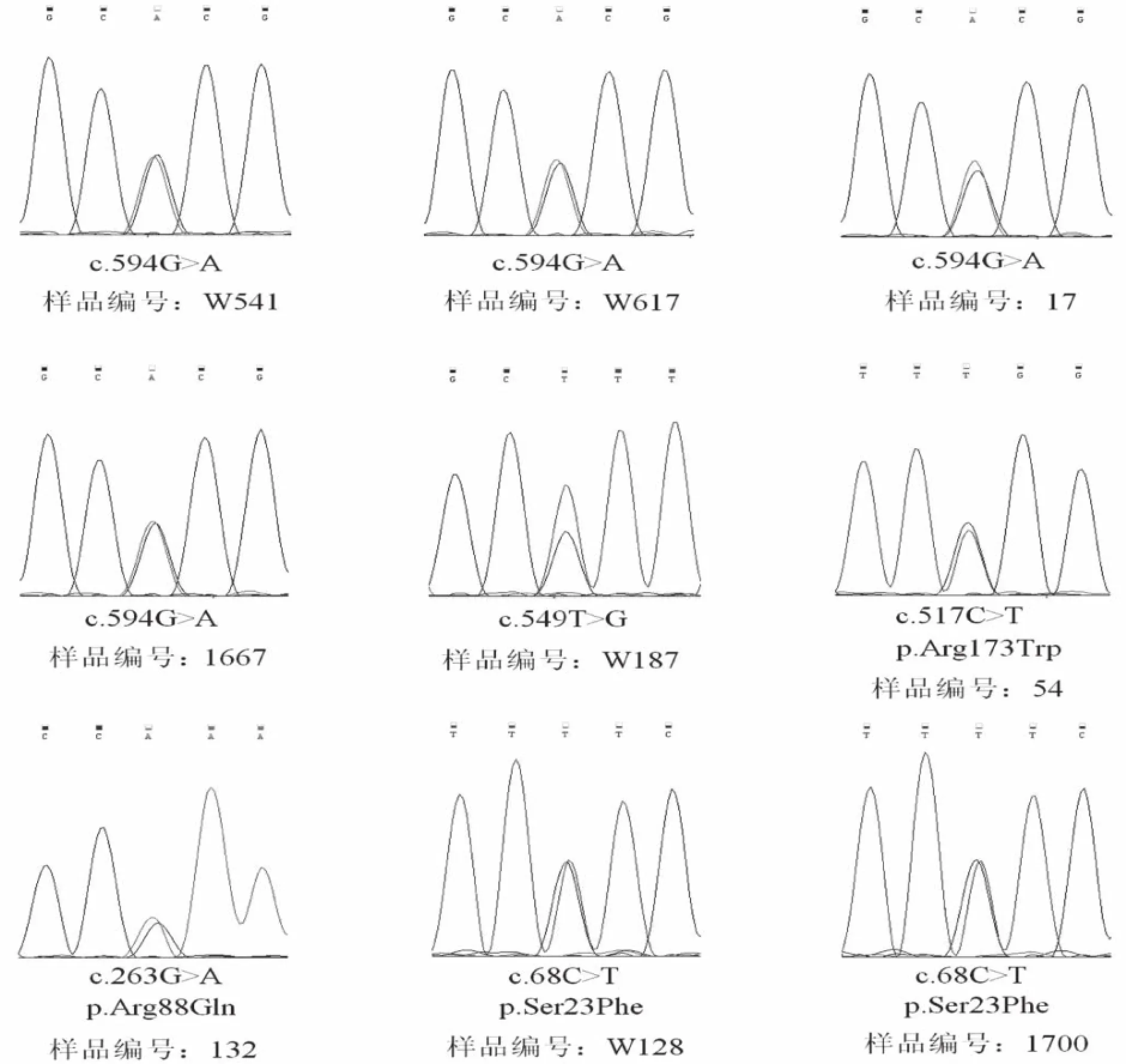
图1TSG23基因单核苷酸变异位点的验证
讨 论
无精子症可分为梗阻性无精子症和非梗阻性无精子症。梗阻性无精子症大约占无精子症患者的40%,主要原因包括先天性发育异常、精索静脉曲张和生殖道感染等[8]。大量的研究表明,遗传因素是导致非梗阻性无精子症发生的主要原因,如染色体核型异常、Y染色体微缺失、基因突变与缺失以及基因的单核苷酸多态性等[9,10]。
近年来,人们一直在寻找与精子发生和生精障碍相关的基因突变、缺失或单核苷酸多态性[11]。Iris等[12]采用PCR产物直接测序比较217例非梗阻男性不育症患者和162例正常生育男性PRDM9基因的SNP差异,发现18327C/A位点在两组人群中存在显著性差异,提示PRDM9可能是原发性不育的易感基因。Wang等[13]采用PCR-RFLP比较252名非梗阻男性不育和246个证明可育男性的FASLG基因的SNP位点,发现844C/T位点在两组人群中存在显著性差异。Zhang等[14]采用DHPLC比较347名非梗阻男性不育和201个证明可育男性的GRTH基因的SNP位点,发现IVS6+55G/T位点在两组人群中存在显著性差异。Teng等[15]对中国台湾地区男性人群非梗阻性无精子症及严重少精子症患者DAZL基因全长编码序列进行了筛查,发现了位于第3外显子第386位核苷酸A→G SNP,该SNP引起了其编码蛋白第54位氨基酸由苏氨酸转变为丙氨酸(T54A)。进一步分析表明T54A等位基因G与生精障碍有显著关联。Hu等采用全基因组关联分析方法,比较1 000例非梗阻性无精子症患者与1700例正常生育男性全基因组SNP的差异,并在2 000例患者和4 000例正常生育男性中进行验证,确定1p13.3,1p36.32和12p12.1,3个染色体区域在非阻塞性无精子症和正常生育男性中存在显著性变异[16]。
人TSG23(GenBank 登录号:NM_080608)定位在20q13.12,全长有752bp,在10至693 bp之间有一阅读框,含有684bp的完整ORF,编码227个氨基酸。TSG23基因包括2个外显子、1个内含子及上游的表达调控序列,总长度为2137bp。SNP数据库资料显示,TSG23基因有15个可能的SNP或突变位点。我们的实验结果表明,人TSG23基因在正常生育男性和非梗阻性无精子症患者中均存在同义突变或错义突变。我们现有的分析结果表明,TSG23基因的单核苷酸变异与非梗阻性无精子症的发生无明显的相关性。
1 Visser L, Repping S. Unravelling the genetics of spermatogenic failure.Reproduction2010; 139(2): 303-307
2 Fisch H. Declining worldwide sperm counts: disproving a myth.Urol Clin North Am2008; 35(2):137-46
3 Jarvi K, Lo K, Fischer A, et al. CUA Guideline: The workup of azoospermic males.Can Urol Assoc J2010; 4(3): 163-167
4 Wu B, Lu NX, Xia YK, et al.A frequent Y chromosome b2/b3 subdeletion shows strongly association with male infertility in Han-Chinese population.Hum Reprod2007; 22(4): 1107-1113
5 Cavallini G. Male idiopathic oligoasthenoteratozoospermia.Asian J Androl2006; 8 (2): 143-157
6 Matzuk MM, Lamb DJ. The biology of infertility: research advances and clinical challenges.Nat Med2008; 14(11): 1197-1213
7 Zhou Y, Qin D, Tang A,et al.Developmental expression pattern of a novel gene, TSG23/Tsg23, suggests a role in spermatogenesis.Mol Hum Reprod2009 15(4):223-230
8 Marmar JL. Techniques for microsurgical reconstruction of obstructive azoospermia.Indian J Urol2011; 27(1): 86-91
9 Martin RH. Cytogenetic determinants of male fertility.Hum Reprod Update2008; 14(4): 379-90
10 McLachlan RI, O'Bryan MK. Clinical Review#: State of the art for genetic testing of infertile men.J Clin Endocrinol Metab2010; 95(3): 1013-1024
11 Carrell DT, Aston KI. The search for SNPs, CNVs, and epigenetic variants associated with the complex disease of male infertility.Syst Biol Reprod Med2011; 57(1-2): 17-26
12 Irie S, Tsujimura A, Miyagawa Y,et al. Single Nucleotide Polymorphisms in PRDM9 (MEISETZ) in Patients with Nonobstructive Azoospermia.J Androl2009; 30(4): 426-431
13 Wang W, Lu N, Xia Y,et al. FAS and FASLG polymorphisms and susceptibility to idiopathic azoospermia or severe oligozoospermia.Reprod Biomed Online2009; 18(1): 141-147
14 Zhang SZ, Yang Y,et al. Single nucleotide polymorphisms of the gonadotrophin-regulated testicular helicase (GRTH) gene may be associated with the human spermatogenesis impairment.Hum Reprod2006; 21(3): 755-759
15 Teng YN, Lin YM, Lin YH,et al.Association of a single Nucleotide polymorphism of the deleted in azoospermialike gene with susceptibility to spermatogenic failure.J Clin Endocrinol Metab2002; 87(11): 5258-5264
16 Hu Z, Xia Y, Guo X,et al. A genome-wide association study in Chinese men identif es three risk loci for nonobstructive azoospermia.Nat Genet2012; 44(2): 183-186
(2014-08-14收稿)
Single nucleotide variation of TSG23 gene in patients with nonobstructive azoospermia*
Jiang Zhimao, Gong Yinghao, Li Yuchi, Lin Shouren, Chen Jianbo, Gui Yaoting**Key Laboratory of Male Reproductive Medicine and Genetics, Peking University Shenzhen Hospital, Shenzhen 518036, China
Gui Yaoting, E-mail: guiyaoting2007@aliyun.com; Te1: 0755-83923333-3320
ObjectiveTo analyze the single nucleotide variation (SNV) ofTSG23gene in patients with non obstructive azoospermia.MethodsAll the exons ofTSG23gene in 776 patients diagnosed with non-obstructive azoospermia and 709 proven fertile men were sequenced. The novel mutations were validated by PCR and Sanger sequencing analysis.ResultsAfter the quality control for sequencing results, the data from 757 patients and 709 proven fertile men were analyzed by bioinformatics methods. Seven mutations were identif ed, including 3 synonymous mutations and 4 missense mutations, and 4 of them were novel mutations. One synonymous mutation was specif c in non-obstructive azoospermia patients, and two missense mutations were specific in proven fertile men.ConclusionAccording to the analysis of SNV data on TSG23gene, All the data indicates SNV of gene TSG23 is not associated with ocurrence of nonobstructive azoospermia.
azoospermia; genes; single nucleotide variation
10.3969/j.issn.1008-0848.2014.10.001
Q 492.4
资助: 深圳市科技计划项目(201202001,201302053); 国家重大科学研究计划(2011CB944303)
**
, E-mail: guiyaoting2007@aliyun.com; Te1: 0755-83923333-3320;

