白细胞介素12B基因多态性与丙型肝炎病毒感染相关性的Meta分析
王 凤,孙朝晖
南方医科大学附属广州军区广州总医院,广东广州 510010
白细胞介素12B基因多态性与丙型肝炎病毒感染相关性的Meta分析
王 凤,孙朝晖
南方医科大学附属广州军区广州总医院,广东广州 510010
目的探讨白细胞介素12B(interleukin 12B,IL-12B)基因3'UTR A>C多态性与丙型肝炎病毒(hepatitis C virus,HCV)感染的相关性。方法计算机检索PubMed、Cochrane Library、CBM、万方、知网、维普等数据库,收集1988年11月- 2014年4月关于IL-12B基因3'UTR A>C多态性与HCV感染相关性的病例对照研究。由两名评价者独立评价纳入研究的质量并提取资料,并用Stata12.0软件进行Meta分析。结果6项病例对照研究符合纳入标准,包括1 396例患者和1 254例对照者。Meta分析结果显示,人群中携带3'UTR C等位基因者发生HCV感染的风险是非携带者的1.12倍(OR=1.12,95% CI:0.90 ~ 1.39),差异无统计学意义(Z=0.10,P>0.05)。基于种族的亚组分析显示,亚裔人群中携带3'UTR C等位基因者发生HCV感染的风险是非携带者的1.04倍(OR=1.04,95% CI:0.67 ~ 1.61),差异无统计学意义(Z=0.18,P>0.05);非亚裔人群中亦未发现相关性(Z=1.56,P>0.05)。结论基于目前研究结果显示,IL-12B基因3'UTR A>C多态性与HCV感染风险无明显相关性。
白细胞介素12B;丙型肝炎病毒;基因多态性;Meta分析
资料和方法
1 纳入与排除标准 纳入标准:1)公开发表的关于IL-12B基因多态性与HCV感染相关的病例对照研究;2)可获得相关基因频率分布的数据,对于多个重复报道的研究,纳入其中最近发表的或者提供大样本量的研究;3)对照组基因分布服从Hardy-Weinberg平衡(H-W平衡)。排除标准:1)未设立对照组的研究;2)动物实验研究;3)病例报告、综述等非病例对照研究。
2 检索策略 计算机检索PubMed、Cochrane Library、万方、知网、维普等数据库,检索时间为1988年11月- 2014年4月。检索词包括白细胞介素12,多态性,丙型肝炎病毒,IL-12,polymorphism,HCV。语种为中、英文,无年龄限制。
3 数据提取 由2名评价者根据纳入标准,独立对文献进行筛选,意见不一致时通过第三方讨论解决分歧。主要数据信息包括:第一作者、发表时间、国家、种族、研究设计、病例组和对照组例数、基因检测方法、等位基因或基因型频率、对照组H-W平衡情况等。
4 纳入文献质量评价 采用Newcastle-Ottawa Scale (NOS)标准评价纳入研究的方法学质量[5]。NOS评分对3部分进行评价:1)研究对象的选择;2)研究对象的可比性;3)危险因素的暴露情况。评分采用9分制,1 ~ 4分为低质量,5 ~ 9分为高质量。
5 统计学方法 采用Stata12.0统计软件进行Meta分析。合并效应量选用比值比(OR)以及95% CI。对纳入研究进行异质性检验,各研究结果间无异质性采用固定效应模型,否则采用随机效应模型,P<0.1或I2>50%提示各研究间存在异质性。同时,根据种族进行亚组分析。敏感性分析为依次排除单个文献后重新进行Meta分析,估计综合效应大小。采用Begg漏斗图分析纳入文献是否存在发表偏倚(P<0.05为存在发表偏倚)。
结果
1 文献检索结果 根据检索词共获得9篇相关文献,其中1篇无健康对照组[6],1篇为重复发表文献[7],1篇研究目的不符[8],最终纳入6篇文献,包括1 396例患者和1 254例对照者,所有纳入研究的对照组基因型频率均符合H-W平衡。纳入文献的基本特征及质量评分见表1、表2。
2 Meta分析结果 人群中携带3'UTR C等位基因者发生HCV感染的风险是非携带者的1.12倍(OR=1.12,95% CI:0.90 ~ 1.39),差异无统计学意义(Z=0.10,P>0.05)。基于种族的亚组分析显示,亚裔人群中携带3'UTR C等位基因者发生HCV感染的风险是非携带者的1.04倍(OR=1.04,95%CI:0.67 ~ 1.61),差异无统计学意义(Z=0.18,P>0.05);非亚裔人群中亦未发现相关性(OR=1.17,95%CI:0.96 ~ 1.42;Z=1.56,P>0.05)。相应基因型分析与等位基因分析结果一致。见表3,图1,图2。
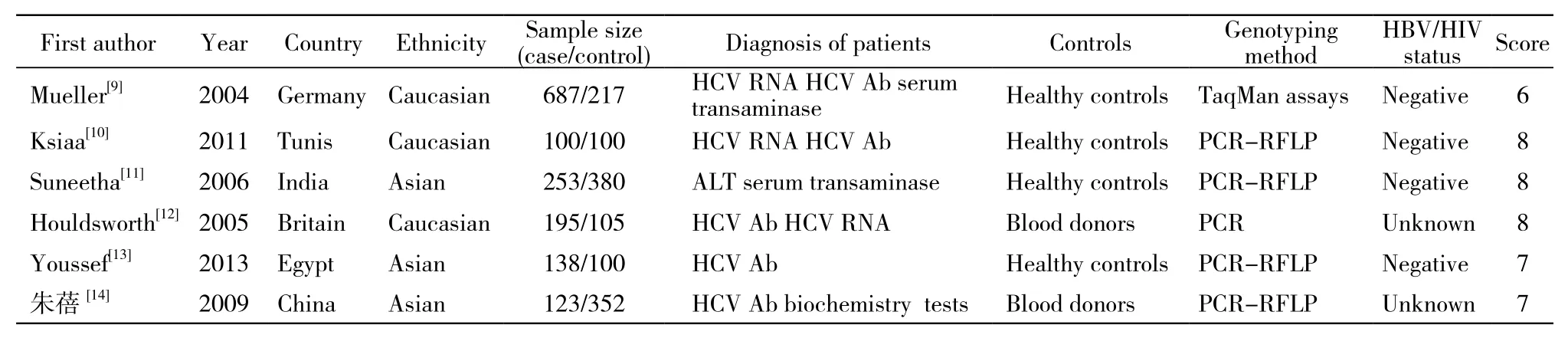
表1 Meta分析纳入研究的基线特征Tab. 1 Main characteristics of the studies that were included in the meta-analysis
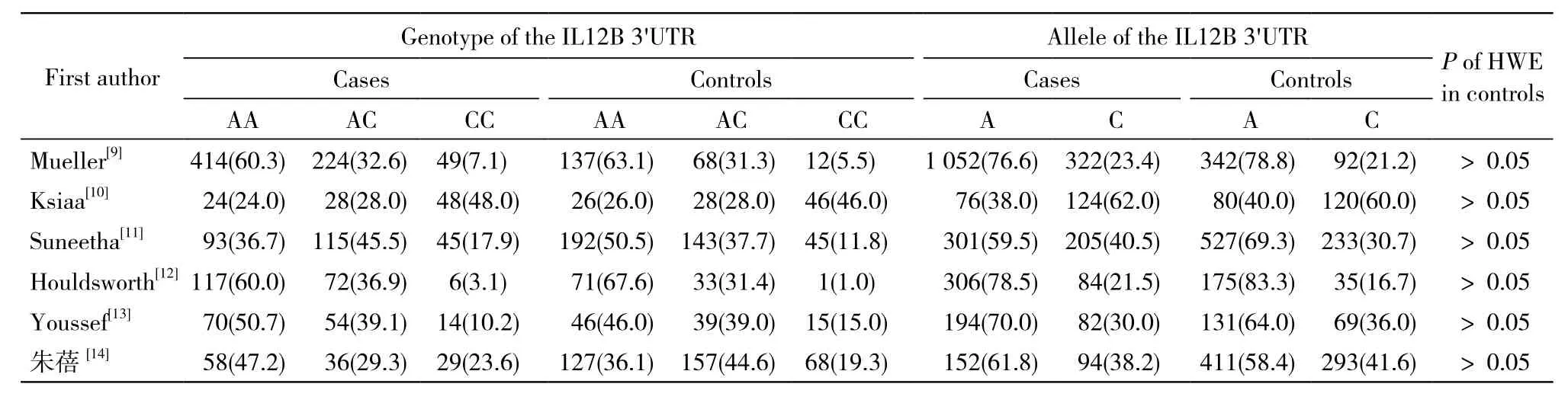
表2 IL12B 3'UTR多态性基因型和等位基因在HCV感染患者及正常对照者中的分布Tab. 2 Genotype and allele distribution of the IL12B 3'UTR polymorphism among HCV patients and controls that were included in the meta-analysis (n, %)
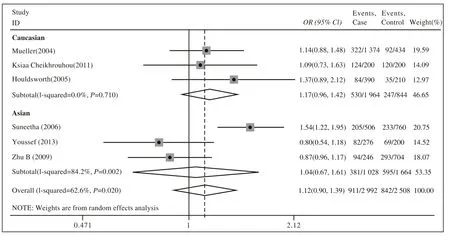
图 1 IL-12 B基因 3'UTR (C vs A)等位基因与HCV感染Meta分析森林图Fig.1 Forest fi gure of relationship between IL-12B 3'UTR C vs A polymorphism and HCV infection
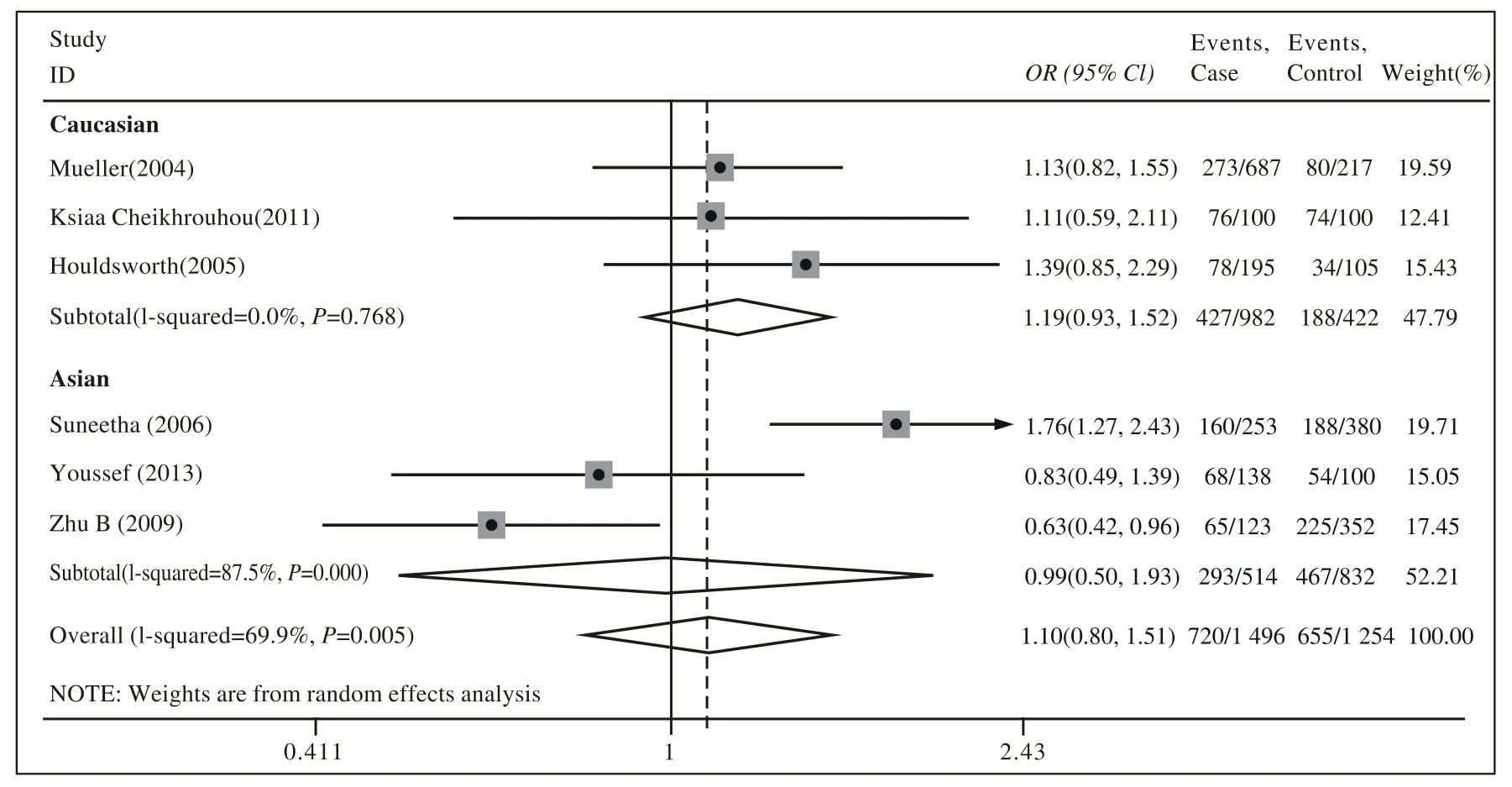
图 2 IL-12B基因3'UTR (AC + CC vs AA)基因型与HCV感染 Meta分析森林图Fig.2 Forest fi gure of relationship between IL-12B 3'UTR AC + CC vs AA genotypes and HCV infection
3 敏感性分析 依次单独剔除1篇文献后,各合并效应量均无明显改变。但在C vs A和CC + AC vs AA模型分析中,当剔除Suneetha等[11]文献时,研究间异质性消失(P=0.27);其他遗传模型未见变化。
4 发表偏倚评价 漏斗图分析结果显示,IL-12B基因3'UTR A>C多态性与HCV感染相关性Meta研究所纳入文献分布整体比较集中,左右基本对称,未见发表偏倚(P>0.05)。见图3。
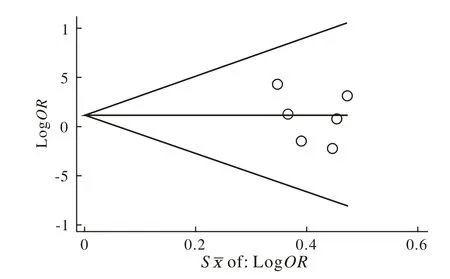
图 3 IL-12B基因3'UTR与HCV感染 Meta分析Begg漏斗图Fig.3 Begg's funnel plot of relationship between IL-12B 3'UTR genotypes and HCV infection
讨论
有效的细胞免疫应答是病毒感染的关键,如细胞因子基因多态性,可以通过免疫反应决定疾病进展的结果[15]。IL-12是促进和维持抗病毒免疫应答的关键性细胞因子[16]。许多慢性感染,包括HCV,都与IL-12的分泌相关[17]。此前有多项研究报道,IL-12B基因3'UTR多态性与IL-12的分泌有关[18-20]。但其与HCV感染的相关性的研究结果尚存在争议,故本文就此采用循证医学Meta分析的方法分析IL-12B基因3'UTR多态性与HCV感染的相关性。
本文研究共纳入6项病例对照研究,包括1 396例患者和1 254例对照者。其中4项研究认为IL-12B基因3'UTR A>C多态性与HCV感染相关,其他研究则认为两者无相关性[11-13]。Meta分析结果显示,IL-12B基因3'UTR A>C多态性与HCV感染不相关,基于种族的亚组分析也没有发现两者关联。
异质性是影响本研究结果可靠性的主要因素,CvsA和CC + ACvsAA遗传模型经异质性检验存在异质性。敏感性分析显示,C vs A模型分析中,当剔除Suneetha等[11]文献时,研究间异质性消失(P=0.27);在CC+AC vs AA模型分析中,剔除Suneetha等[11]文献后,研究间异质性亦消失(P=0.11)。说明此文献可能是这两种遗传模型的异质性所在。该研究认为:IL-12B基因多态性与HCV感染无明显相关性,但同亚组的Youssef等[13]、朱蓓[14]文献研究结果却表明:IL-12B基因型的分布差异影响HCV感染的结果,这可能导致了异质性的产生。针对种族的亚组分析中,白种人亚组各个文献同质,亚洲人种亚组仍存在异质性,说明针对不同人种的研究可能会导致异质性。
本文研究存在一定的局限性:1)虽然已纳入符合标准的可查到的相关文献,但是仍然可能有符合纳入标准而未被纳入的研究;2)经Begg漏斗图检测,未提示存在发表偏倚,但可能存在潜在的发表偏倚;3)可能存在潜在的干扰因素,如种族、年龄、性别、地域分布等。
尽管存在上述局限性,本研究仍可较客观地反应IL-12B基因3'UTR A>C多态性与HCV感染的相关性。因此,基于目前研究结果,可得到以下初步结论:IL-12B基因3'UTR A>C多态性与HCV感染无相关性。由于文献数量及样本量的局限,本研究结论尚需更多前瞻性试验研究进一步加以证实。
1 杨锡琴.丙型肝炎病毒血清学分型方法的建立及初步临床评价[D].北京:中国人民解放军军事医学科学院,2013.
2 Lavanchy D. The global burden of hepatitis C[J]. Liver Int, 2009,29(S1):74-81.
3 Czepiel J, Biesiada G, Mach T. Viral hepatitis C[J]. Pol Arch Med Wewn, 2008, 118(12):734-740.
4 宋舸,袁玫,卢世璧.白细胞介素-12临床应用研究进展[J].中华肿瘤防治杂志,2007,14(1):75-79.
5 曾宪涛,刘慧,陈曦,等.Meta分析系列之四:观察性研究的质量评价工具[J].中国循证心血管医学杂志,2012,4(4):297-299.
6 Yin LM, Zhu WF, Wei L, et al. Association of interleukin-12 p40 gene 3'-untranslated region polymorphism and outcome of HCV infection[J]. World J Gastroenterol, 2004, 10(16): 2330-2333.
7 Hegazy D, Thurairajah P, Metzner M, et al. Interleukin 12B gene polymorphism and apparent resistance to hepatitis C virus infection[J]. Clin Exp Immunol, 2008, 152(3): 538-541.
8 Lee JH, Teuber G, Von Wagner M, et al. Antiviral effect of human recombinant interleukin-12 in patients infected with hepatitis C virus[J]. J Med Virol, 2000, 60(3): 264-268.
9 Mueller T, Mas-Marques A, Sarrazin C, et al. Influence of interleukin 12B (IL12B) polymorphisms on spontaneous and treatment-induced recovery from hepatitis C virus infection[J]. J Hepatol, 2004, 41(4): 652-658.
10 Ksiaa Cheikhrouhou L, Sfar I, Aounallah-Skhiri H, et al. Cytokine and apoptosis gene polymorphisms influence the outcome of hepatitis C virus infection[J]. Hepatobiliary Pancreat Dis Int, 2011, 10(3):280-288.
11 Suneetha PV, Goyal A, Hissar SS, et al. Studies on TAQ1 polymorphism in the 3’untranslated region of IL-12P40 gene in HCV patients infected predominantly with genotype 3[J]. J Med Virol, 2006, 78(8): 1055-1060.
12 Houldsworth A, Metzner M, Rossol S, et al. Polymorphisms in the IL-12B gene and outcome of HCV infection[J]. J Interferon Cytokine Res, 2005, 25(5):271-276.
13 Youssef SS, Abd El Aal AM, Nasr AS, et al. Interleukin-12B gene polymorphism frequencies in Egyptians and sex-related susceptibility to hepatitis C infection[J]. J Interferon Cytokine Res, 2013, 33(8):415-419.
14 朱蓓.中国血液透析人群丙型肝炎病毒感染及与白细胞介素12B基因多态性关系研究[D].南京:南京医科大学,2009.
15 Hill AV. The immunogenetics of human infectious diseases[J]. Annu Rev Immunol, 1998, 16:593-617.
16 Morahan G, Huang D, Wu M, et al. Association of IL12B promoter polymorphism with severity of atopic and non-atopic asthma in children[J]. Lancet, 2002, 360(9331): 455-459.
17 Piazzolla G, Tortorella C, Fiore G, et al. Interleukin-12 p40/p70 ratio and in vivo responsiveness to IFN-alpha treatment in chronic hepatitis C[J]. J Interferon Cytokine Res, 2001, 21(7): 453-461.
18 Morahan G, Huang D, Ymer SI, et al. Linkage disequilibrium of a type 1 diabetes susceptibility locus with a regulatory IL12B allele[J]. Nat Genet, 2001, 27(2): 218-221.
19 Seegers D, Zwiers A, Strober W, et al. A TaqI polymorphism in the 3’UTR of the IL-12 p40 gene correlates with increased IL-12 secretion[J]. Genes Immun, 2002, 3(7): 419-423.
20 Bergholdt R, Ghandil P, Johannesen J, et al. Genetic and functional evaluation of an interleukin-12 polymorphism (IDDM18) in families with type 1 diabetes[J]. J Med Genet, 2004, 41(4):e39.
Correlation between interleukin-12B gene polymorphism and hepatitis C virus: A Metaanalysis
WANG Feng, SUN Chao-hui
General Hospital of Guangzhou Military Command of PLA affiliated to Southern Medical University, Guangzhou 510010, Guangdong Province, China
SUN Chao-hui. Email: zhaohui3@126.com
ObjectiveTo explore the correlation between interleukin 12B (IL-12B) 3'UTR A>C polymorphism and hepatitis C virus infection.MethodsSystematic searches of electronic databases as PubMed, Cochrane Library, CBM and CNKI were performed, and then case-control study about correlation between interleukin 12B (IL-12B) 3'UTR A>C polymorphism and hepatitis C virus infection from November 1988 to April 2014 were collected. Meta-analysis was conducted using Stata 12.0 software.ResultsA total of 6 studies were identif i ed, including 1 396 patients and 1 254 controls. The results of meta-analysis showed that the ratio of patients with 3'UTR C polymorphism had the risk of infecting with the HCV to patients without 3'UTR C polymorphism was 1.12∶1 (OR=1.12, 95% CI: 0.90-1.39), and no signif i cant difference was showed in the correlation between IL-12B 3'UTR A>C polymorphism and HCV infection (Z=1.56, P>0.05). In the subgroup analysis on ethnicity, the ratio of patients in Asia with 3'UTR C polymorphism had the risk of infecting with the HCV to patients without 3'UTR C polymorphism was 1.04∶1 (OR=1.04, 95% CI: 0.67-1.61), while no signif i cant correlation was found (Z=1.56, P>0.05).ConclusionMeta-analysis strongly suggests that the correlation between IL-12B 3'UTR A>C polymorphism and HCV is not signif i cant.
interleukin 12B; hepatitis C virus; gene polymorphism; meta-analysis
R 512.63
A
2095-5227(2014)12-1257-05
10.3969/j.issn.2095-5227.2014.12.022
时间:2014-08-12 08:47
http://www.cnki.net/kcms/detail/11.3275.R.20140812.0847.003.html
据世界卫生组织统计,目前全球约有1.8亿人感染丙型肝炎病毒(hepatitis C virus,HCV),感染率约为3%,其中1.3亿人为慢性HCV携带者[1]。HCV具有高致病性和广泛流行性的特点,不同地区HCV的流行情况不同,欧美等国属于低流行地区,非洲属于高流行区,我国则属于中度流行地区[2]。感染HCV后呈持续性感染,只有少数患者能够自我清除病毒并康复,而康复后依然存在再次感染的风险[3]。白细胞介素12(interleukin-12,IL-12)是一种重要的免疫调节因子,主要由抗原递呈细胞产生,是连接早期非特异免疫反应和继发性抗原特异性免疫反应的桥梁,在抗病毒免疫反应中发挥重要的作用[4]。近年来,国内外多项研究报道了IL-12基因3'非编码区(3'UTR)A>C多态性与HCV感染的相关性,其结果不一致。因此,本研究运用循证医学Meta分析方法,全面收集相关病例对照研究,探讨IL-12B基因3'UTR A>C多态性与HCV感染的关系。
2014-06-11
王凤,女,在读硕士。研究方向:生物信息学。Email: zhifeng121@126.com
孙朝晖,男,主任技师。Email: zhaohui3@126.com

