Lgr5-Wnt/β-catenin信号通路与胃癌干细胞的研究进展
牛 磊,郗洪庆,陈 凛
解放军总医院 普通外科,北京 100853
综 述
Lgr5-Wnt/β-catenin信号通路与胃癌干细胞的研究进展
牛 磊,郗洪庆,陈 凛
解放军总医院 普通外科,北京 100853
随着基础研究领域的不断拓展和深入,胃癌的难治性逐渐被归因于胃癌干细胞的存在和信号通路的异常表达,其中最具代表性的当属Wnt/β-catenin信号通路。Lgr5作为Wnt/β-catenin通路的受体蛋白亦被认为是众多恶性肿瘤干细胞潜在的分子标记物。我们将就Lgr5-Wnt/β-catenin信号通路与胃癌干细胞之间的相互关系,结合目前研究进展进行综述。
胃癌干细胞;Wnt基因; β-连环蛋白; 富含亮氨酸G蛋白偶联受体5
世界范围内,胃癌是第四大常见恶性肿瘤,居全球癌症死亡率的第二位[1]。由于缺乏可靠的肿瘤标记物无法有效筛查或早期诊断高危人群,同时对中晚期病变治疗手段有限,致使胃癌预后较差、复发率及死亡率高[2]。随着临床及基础研究的不断深入,目前多数学者认为治疗受限的一个假定解释是癌干细胞(cancer stem cells,CSC)也称肿瘤干细胞(tumor stem cells,TSC)的存在。因此,为了达到治愈癌症的目的,不仅仅要杀死已增殖成熟的肿瘤细胞,更重要的是通过特异性靶向治疗消灭肿瘤干细胞[3]。Wnt/ β-catenin通路是最经典的一条Wnt信号通路,广泛存在于多细胞生物体内[4]。这条通路主要由各类Wnt信号介导,通过对细胞内β连环蛋白水平的调节控制目的基因的表达,最终影响肿瘤干细胞的生长、分化和凋亡[5-7]。Barker等[8-9]发现在肠道隐窝基底部表达Lgr5,而此处被认为是干细胞聚集的位置,因而提出了Lgr5作为肠道肿瘤干细胞标记物的理论。我们将就Lgr5-Wnt/β-catenin信号通路与胃癌干细胞之间的相互关系,结合目前研究进展进行综述,以期为今后相关研究提供帮助。
1 胃癌干细胞
肿瘤干细胞假说是由Makino[10]于1959年首次提出,认为肿瘤可能由肿瘤干细胞产生。肿瘤干细胞具有自我更新、抗化疗药物及抵抗放射线的特性,所以易导致肿瘤复发、进展和最终死亡。1997年,Bonnet和Dick[11]从急性粒细胞白血病(acute myelocytic leukemia,AML)患者体内分离出带有CD34+CD38-免疫标记的细胞亚群。尽管这些CD34+CD38-表达阳性的细胞数量仅占被检测细胞总数的0.2%,却能在非肥胖型糖尿病/重度联合免疫缺损(NOD/ SCID)小鼠体内存活并大量分裂增殖,最终引发急性粒细胞白血病。此后,肿瘤干细胞的相关研究进展迅速,先后在乳腺癌、胶质母细胞瘤(glioblastoma multiforme)、结肠癌、前列腺癌、胰腺癌及肝癌等实体瘤中发现并分离鉴定了肿瘤干细胞[12-17]。
目前采用两种方法验证癌干细胞:一种是体外肿瘤细胞球集落的形成,即在特殊涂层无细胞附着且无血清的培养液中培养只含有表皮生长因子和碱性成纤维细胞生长因子的候选干细胞[18]。经过规定培养期后,观察癌悬浮肿瘤球细胞的形成情况,明确其自我更新能力,这与CSC具有一致性。另一种是在体内通过免疫缺陷小鼠的皮下或特定器官(如原位)植入候选干细胞,经几周细胞增殖,可观察到小鼠成瘤情况,同样具有自我更新能力[19]。这一方法被认为是证实存在CSC的金标准。同时,大量研究表明,上述两种方法在评估许多实体候选肿瘤干细胞上都提供了类似的结果。另外,根据癌干细胞具有抗化疗药物的特性,可通过药物试验进行癌干细胞的提纯。
2002年,Bjerknes和Cheng[20]首次从小鼠成体胃腺黏膜分离得到胃组织干细胞,生存时间达48周,并扩增出新的腺体。2008年,Takaishi等[21]通过对人胃癌细胞系进行体外克隆形成实验,得到了球形细胞克隆体;并通过移植肿瘤球细胞到免疫缺陷小鼠皮下,成功建立出成瘤模型,且克隆形成实验和成瘤实验具有高度一致性。表明在一些胃癌细胞系中的确存在具有肿瘤干细胞特性的细胞。同时他们又通过荧光激活细胞分选技术和逆转录PCR鉴定了胃癌细胞的一些表面标记物分子,在这些分子中CD44分子与体内成瘤实验高度一致,且CD44阳性的细胞具有很好的克隆形成能力和体内成瘤能力,而阴性细胞却不具备这些能力,这些瘤球细胞占阳性细胞的1% ~ 10%。虽然上述研究提示胃癌CSC的存在,CD44可能是胃癌CSC的标记物,但就目前的研究来看,CD44并不是胃癌CSC特异性检测指标,有必要进一步发现其他标记物来特异性检测胃癌CSC。随着相关研究的不断开展,有学者综述了多种胃癌CSC潜在分子标记物(表1)[22]。近来,Chen等[22]从实体胃癌肿瘤及血液中分离培养出胃癌干细胞,并提出应将CD54+CD44+作为胃癌干细胞标记物。Zhang等[23-24]强烈建议CD24+CD44+作为胃癌干细胞分离提取的标记物。他们通过胃癌细胞系及5例胃癌肿瘤组织细胞培养证实上述观点。但目前,尚无一致认可的一组胃癌干细胞标记物。
2009年,Cao等[25]从人胃癌组织中分离到间充质干细胞样细胞。这种细胞具有正常间充质干细胞形态及增殖和分化潜能,由于位于癌细胞周围,其增殖比正常间充质干细胞快。但不同于胃癌悬浮球细胞的是,在裸鼠体内间充质干细胞样细胞不能形成肿瘤,但这些细胞可以促进血管及细胞外基质的形成,从而促进肿瘤的生长。
2 Wnt/β-catenin信号传导通路与胃癌干细胞
现在普遍认为干细胞的更新、分化能力受各种信号传导通路的严格调控,一旦信号传导通路成分表达失调或突变,这种调控机制就会被破坏,进而促使干细胞无限制生长、繁殖,并产生异常分化,形成肿瘤干细胞。同样,TSC也处在一系列信号传导通路的调控网络中。在诸多信号传导通路中,Wnt信号通路的调控失常是多种类型细胞发生癌变的主要原因之一。
Wnt是根据两种同源基因组合命名的,包括果蝇片段极性基因和鼠原癌基因[26]。人和鼠的基因组织中至少有19个Wnt蛋白家族的成员,在进化上都高度保守。Wnt是一类分泌型糖蛋白,通过自分泌或旁分泌发挥作用,与细胞膜上的受体结合后可激活3条细胞内的信号途径:Wnt/β-catenin信号途径、Wnt/Ca2+途径以及通过Jun氨基端激酶传导的细胞极性通路。在脊椎动物和无脊椎动物中,Wnt蛋白作为配体刺激受体介导的信号转导通路。激活的Wnt信号通路可以调节细胞增殖、存活等生物学行为。Wnt/β-catenin通路是最经典的一种Wnt信号通路,它的核心部件在进化中高度保守。在Wnt信号缺失的情况下,胞质内β-catenin会被磷酸化及降解。Wnt通过卷曲蛇纹石受体和低密度脂蛋白受体相关蛋白5或6辅助受体可激活胞质中的松散蛋白(dishevelled,Dsh/Dvl),Dsh能够将糖原合成酶激酶3β磷酸化,从而阻断β-连环蛋白的降解。随着β-catenin数量的上升,它进入并积累在细胞核内,与特定的转录因子相互作用,激活Wnt/β-catenin信号通路靶基因的转录,引起细胞迁移能力和细胞极性的改变,从而诱导肿瘤发生(图1)[27-28]。
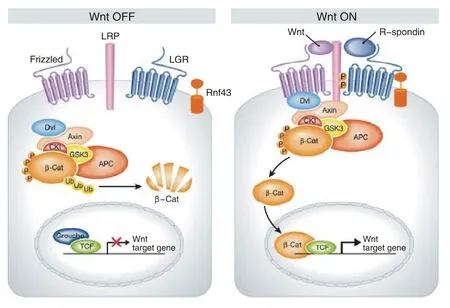
图 1 Wnt /β-catenin 信号传导通路示意图Fig.1 Schematic diagram of Wnt/β -catenin signal transduction pathway
Wnt信号传导途径对细胞维持自我更新、抑制分化、增殖、迁徙、极性和凋亡起到重要的作用。β连环蛋白、腺瘤性结肠息肉病基因、轴素的突变均可导致β-catenin保持稳定和异常累积,进入细胞核内激活Wnt/β-catenin信号通路靶基因。Barker等[9]研究显示,Wnt/β-catenin信号通路与肿瘤细胞对微环境的适应性也密切相关,Wnt信号在小肠隐窝的生物学方面起着很重要的影响。近年研究发现,Wnt信号通路与TSC关系密切,在多种TSC中发现其上调来介导耐药及肿瘤的复发等,如在结肠癌,、前列腺癌、皮肤癌以及慢性髓系白血病等治疗中,并且其作用已被证实[29-32]。

表1 胃癌干细胞潜在分子标记物Tab. 1 Potential biomarker of gastric cancer stem cells
目前,已报道的Wnt/β-catenin信号通路在胃癌干细胞的作用相对较少。2012年,蔡琛[33]从人胃癌细胞系MKN-45分离出胃癌干样细胞,并通过Western blotting检测出CD44表达量明显高于普通贴壁细胞,同时平板克隆亚瘤球形成实验及小鼠成瘤试验均证实了胃癌干样细胞的存在。他们检测到β-catenin蛋白在胃癌干样细胞中的相对表达量明显高于贴壁细胞,使用氯化锂刺激细胞可以活化Wnt/ β-catenin信号通路而增加肿瘤干细胞的自我更新能力。而使用Wnt抑制因子Dickkopf-1(DKK1)阻断Wnt/β-catenin信号通路后,β-catenin目的基因的信使RNA水平及自我更新能力明显降低。他们认为,Wnt信号通路是调节胃癌干细胞自我更新中的重要信号通路,但对非肿瘤干细胞肿瘤细胞没有明显的影响。大量的小分子抑制剂或生物抑制因子已被证实其对Wnt信号通路的抑制作用,但是没有可以有效清除肿瘤干细胞的分子[34]。有必要在下一步的研究中找出多条信号通路中的多个关键分子,使其更有效地阻断调节肿瘤干细胞自我更新中的关键信号通路,从而抑制肿瘤干细胞自我更新,达到清除肿瘤干细胞目的。Mao等[35]认为Wnt1在Wnt/β-catenin通路作用于胃癌干细胞增殖更新中起到了重要作用,同时CD44+Oct4+可作为胃癌干细胞标记物。Kanzawa等[36]则认为Wnt5a在整个过程中起到了关键作用。
3 Lgr5-Wnt/β-catenin信号传导通路
Lgr5,又称GPR49,是具有18个富含亮氨酸重复序列和7个跨膜区域组成的大分子蛋白,是G蛋白偶联受体家族成员之一,也是最新发现的Wnt信号传导的靶基因[8]。1998年Hsu等[37]首先发现了该分子并予以命名。最初发现其与卵泡刺激激素、促黄体生成激素和促甲状腺激素受体密切相关,并且在肌肉、胎盘、脑和脊髓中表达[38]。2004年,Morita等[39]以新生及成年野生型小鼠为研究对象,发现Lgr5在新生及成年小鼠的肾上腺、肝、脾中均高表达,成年小鼠中Lgr5有限、稀少地表达分布在胃肠道。2006年,McClanahan等[40]发现Lgr5在结肠肿瘤中高表达,在39例结肠肿瘤中有25例Lgr5表达上调,占64%;同样在卵巢癌相关研究中亦发现了类似的结果。免疫组化染色显示,这一发现与受体的mRNA表达相关,下调Lgr5的mRNA水平成功诱导结肠肿瘤细胞的凋亡。他们认为,Lgr5在肿瘤发生过程中起着潜在作用。2007年,Barker等[9]报道Lgr5在小肠隐窝柱状细胞中以一种Wnt靶基因的形式进行表达,因为用负显性TCF4抑制Wnt信号通路后它的表达消失,并且也证明了Lgr5+小肠隐窝柱状细胞为小肠干细胞,同时在结肠相关研究中也得到了相同结果。Barker等[8-9]在前人研究的基础上总结认为,Lgr5不仅标识正常肠干细胞,同样也高表达于维持结肠癌的一些稀少的原始肿瘤细胞或持续繁殖细胞,即肿瘤干细胞。2010年,Vermeulen等[41]报道Lgr5在结肠癌干细胞内表达上调,也证明了大肠癌干细胞以Wnt信号的高水平表达为特征。最近的研究结果显示,在肝癌、结直肠癌、卵巢癌、基底细胞癌和食管腺癌中Lgr5表达处于高水平,并参与了肿瘤的发生发展[11,40,42-44]。
近期有学者认为,Lgr5是Wnt兼有的受体蛋白,并通过与配体R-spondin蛋白结合介导增强Wnt信号通路[45-46]。Carmon等[47]研究了其作用机制。在配体R-spondin1和Wnt3a的刺激下,Lgr5与Wnt受体LRP6和Fzd5相互作用并形成超复合物,超复合物随后被内化和降解,Lgr5加速了这一过程;发动蛋白依赖途径和网格蛋白依赖途径介导Lgr5的内化,抑制内吞过程对Lgr5信号没有影响,敲除C末端的Lgr5分子依旧维持了与LRP6相互作用的能力。然而,相比野生型受体,这种Lgr5分子经R-spondin1刺激后显示出了增强信号通路的能力,并降低了内吞率。这一研究直接证明了Lgr5作为Wnt信号复合物在膜水平提高Wnt/ β-catenin信号通路。
Koo等[48]证实E3泛素酶rnf43在Lgr5阳性的小肠隐窝细胞特异性表达,呈现抑制细胞增殖作用,有学者研究发现,Lgr5参与rnf43/znrf3蛋白的降解,在细胞外存在Rspod1蛋白信号时,Rspod1-Lgr5-rnf43/znrf3形成复合物,促进rnf43/znrf3反转降解,解除细胞抑制作用,并在Wnt蛋白信号协同作用下,增强相关通路(图1)[49]。随着研究深入,近期已有学者对上述复合物蛋白结构域进行分析,结果提示lgr5以一种媒介方式参与rnf43/znrf3的降解[50-51]。
Lgr5在胃癌和胃癌干细胞方面的研究相对较少。2010年,Barker等调查了Lgr5在胃中的表达情况和评估了Lgr5+VE细胞的干细胞潜在性,结果表明,在幽门腺根部Lgr5标志着多能成体干细胞,单一Lgr5+VE干细胞在体外生成胃癌细胞器,Wnt信号驱动Lgr5+VE干细胞转化形成胃腺瘤。随后有许多学者在胃癌组织中发现了高表达的Lgr5,并与胃癌的增殖、侵袭、转移相关[52-54]。然而目前胃癌干细胞的分离仍存在一定缺陷,经细胞培养增殖并成球实验后分离出的肿瘤球细胞虽具有干细胞的一些特性,但多为干样细胞,Lgr5在其生长、增殖及分化中的作用仍不明了。目前多认为其对于肿瘤的自我更新方面起推动作用,Lgr5阳性表达的Ⅰ或Ⅱ期患者有发展至进展期的趋势,同时无复发生存率亦降低[55]。说明Lgr5在胃癌形成及病变进展方面起着重要作用。
总之,在现阶段,Lgr5-Wnt/β-catenin信号通路对胃癌及胃癌干细胞恶性生物学行为的影响及其分子调控机制还处于起步阶段,相关假设或假说仍未得到充分有力的证实,大部分研究仍停留在Lgr5-Wnt/β-catenin在普通胃癌组织或细胞中的作用,对于其在胃癌干细胞中的实际机制和应用需要进一步探索研究。
1 Thun MJ, Delancey JO, Center MM, et al. The global burden of cancer: priorities for prevention[J]. Carcinogenesis, 2010, 31(1):100-110.
2 吴晓松,陈凛.胃癌术后复发治疗新进展[J].解放军医学院学报,2013,34(2):189-191.
3 Al-Hajj M, Becker MW, Wicha M, et al. Therapeutic implications of cancer stem cells[J]. Curr Opin Genet Dev, 2004, 14(1):43-47.
4 张德龙,王伟,张力,等.Wnt/β-catenin信号途径促进肌源性干细胞向神经细胞分化[J] .解放军医学院学报,2014,35(4):383-387.
5 Turashvili G, Bouchal J, Burkadze G, et al. Wnt signaling pathway in mammary gland development and carcinogenesis[J]. Pathobiology,2006, 73(5): 213-223.
6 Neth P, Ries C, Karow M, et al. The wnt signal transduction pathway in stem cells and cancer cells: influence on cellular invasion[J]. Stem Cell Rev, 2007, 3(1): 18-29.
7 Nusse R. Wnt signaling[J]. Cold Spring Harb Perspect Biol, 2012,4(5): a011163.
8 De Lau W, Barker N, Low TY, et al. Lgr5 homologues associate with Wnt receptors and mediate R-spondin signalling[J]. Nature,2011, 476(7360):293-297.
9 Barker N, Van Es JH, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5[J]. Nature, 2007,449(7165): 1003-1007.
10 Makino S. The role of tumor stem-cells in regrowth of the tumor following drastic applications[J]. Acta Unio Int Contra Cancrum,1959, 15(Suppl 1):196-198.
11 Bonnet D, Dick JE. Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell[J]. Nat Med, 1997, 3(7): 730-737.
12 Al-Hajj M, Wicha MS, Benito-Hernandez A, et al. Prospective identification of tumorigenic breast cancer cells[J]. Proc Natl Acad Sci U S A, 2003, 100(7): 3983-3988.
13 Als TD, Vila R, Kandul NP, et al. The evolution of alternative parasitic life histories in large blue butterflies[J]. Nature, 2004,432(7015):386-390.
14 Ricci-Vitiani L, Lombardi DG, Pilozzi E, et al. Identification and expansion of human colon-cancer-initiating cells[J]. Nature,2007, 445(7123): 111-115.
15 O'brien CA, Pollett A, Gallinger S, et al. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J]. Nature, 2007, 445(7123): 106-110.
16 Li C, Lee CJ, Simeone DM. Identification of human pancreatic cancer stem cells[J]. Methods Mol Biol, 2009, 568:161-173.
17 Yang ZF, Ho DW, Ng MN, et al. Significance of CD90+ cancer stem cells in human liver cancer[J]. Cancer Cell, 2008, 13(2): 153-166.
18 Vescovi AL, Galli R, Reynolds BA. Brain tumour stem cells[J]. Nat Rev Cancer, 2006, 6(6):425-436.
19 Vargo-Gogola T, Rosen JM. Modelling breast cancer: one size does not fit all[J]. Nat Rev Cancer, 2007, 7(9):659-672.
20 Bjerknes M, Cheng H. Multipotential stem cells in adult mouse gastric epithelium[J]. Am J Physiol Gastrointest Liver Physiol, 2002, 283(3):G767-G777.
21 Takaishi S, Okumura T, Tu SP, et al. Identification of gastric cancer stem cells using the cell surface marker CD44[J]. Stem Cells,2009, 27(5): 1006-1020.
22 Chen T, Yang K, Yu J, et al. Identification and expansion of cancer stem cells in tumor tissues and peripheral blood derived from gastric adenocarcinoma patients[J]. Cell Res, 2012, 22(1):248-258.
23 Zhang CJ, Li CW, He FT, et al. Identification of CD44+CD24+gastric cancer stem cells[J]. J Cancer Res Clin Oncol, 2011, 137(11):1679-1686.
24 Clevers H, Nusse R. Wnt/β-Catenin signaling and disease[J]. Cell, 2012, 149(6): 1192-1205.
25 Cao HL, Xu WR, Qian H, et al. Mesenchymal stem cell-like cells derived from human gastric cancer tissues[J]. Cancer Lett, 2009,274(1): 61-71.
26 Nusse R, Brown A, Papkoff J, et al. A new nomenclature for int-1 and related genes: the Wnt gene family[J]. Cell, 1991, 64(2):231.
27 Logan CY, Nusse R. The Wnt signaling pathway in development and disease[J]. Annu Rev Cell Dev Biol, 2004, 20:781-810.
28 Sareddy GR, Challa S, Panigrahi MA. Wnt/beta-catenin/Tcf Signaling Pathway Activation in Malignant Progression of Rat Gliomas Induced by Transplacental N-Ethyl-N-Nitrosourea Exposure[J]. Neurochem Res, 2009, 34(7): 1278-1288.
29 Karamboulas C, Ailles L. Developmental signaling pathways in cancer stem cells of solid tumors[J]. Biochim Biophys Acta, 2013, 1830(2):2481-2495.
30 Bisson I, Prowse DM. WNT signaling regulates self-renewal and differentiation of prostate cancer cells with stem cell characteristics[J]. Cell Res, 2009, 19(6):683-697.
31 Malanchi I, Peinado H, Kassen D, et al. Cutaneous cancer stem cell maintenance is dependent on beta-catenin signalling[J]. Nature,2008, 452(7187): U12-650.
32 Zhao C, Blum J, Chen AL, et al. Loss of beta-catenin impairs the renewal of normal and CML stem cells in vivo[J]. Cancer Cell,2007, 12(6): 528-541.
33 蔡琛.Wnt/β-catenin信号通路调节胃癌干细胞自我更新[D].长沙:中南大学,2012.
34 Takahashi-Yanaga F, Kahn M. Targeting Wnt signaling: can we safely eradicate cancer stem cells?[J]. Clin Cancer Res, 2010, 16(12):3153-3162.
35 Mao J, Fan S, Ma W, et al. Roles of Wnt/β-catenin signaling in the gastric cancer stem cells proliferation and salinomycin treatment[J]. Cell Death Dis, 2014, 5:e1039.
36 Kanzawa M, Semba S, Hara S, et al. WNT5A is a key regulator of the epithelial-mesenchymal transition and cancer stem cell properties in human gastric carcinoma cells[J]. Pathobiology, 2013, 80(5):235-244.
37 Hsu SY, Liang SG, Hsueh AJ. Characterization of two LGR genes homologous to gonadotropin and thyrotropin receptors with extracellular leucine-rich repeats and a G protein-coupled, seventransmembrane region[J]. Mol Endocrinol, 1998, 12(12):1830-1845.
38 Hsu SY. New insights into the evolution of the relaxin-LGR signaling system[J]. Trends Endocrinol Metab, 2003, 14(7):303-309.
39 Morita H, Mazerbourg S, Bouley DM, et al. Neonatal lethality of LGR5 null mice is associated with ankyloglossia and gastrointestinal distension[J]. Mol Cell Biol, 2004, 24(22): 9736-9743.
40 McClanahan T, Koseoglu S, Smith K, et al. Identification of overexpression of orphan G protein-coupled receptor GPR49 in human colon and ovarian primary tumors[J]. Cancer Biol Ther,2006, 5(4):419-426.
41 Vermeulen L, Melo FD, Van Der Heijden M, et al. Wnt activity defines colon cancer stem cells and is regulated by the microenvironment[J]. Nat Cell Biol, 2010, 12(5): 468-U121.
42 Uchida H, Yamazaki K, Fukuma M, et al. Overexpression of leucine-rich repeat-containing G protein-coupled receptor 5 in colorectal cancer[J]. Cancer Sci, 2010, 101(7):1731-1737.
43 Tanese K, Fukuma M, Yamada T, et al. G-protein-coupled receptor GPR49 is up-regulated in basal cell carcinoma and promotes cell proliferation and tumor formation[J]. Am J Pathol, 2008, 173(3):835-843.
44 Becker L, Huang Q, Mashimo H. Lgr5, an intestinal stem cell marker, is abnormally expressed in Barrett's esophagus and esophageal adenocarcinoma[J]. Dis Esophagus, 2010, 23(2):168-174.
45 Glinka A, Dolde C, Kirsch N, et al. LGR4 and LGR5 are R-spondin receptors mediating Wnt/β-catenin and Wnt/PCP signalling[J]. EMBO Rep, 2011, 12(10):1055-1061.
46 Ruffner H, Sprunger J, Charlat O, et al. R-Spondin potentiates Wnt/ β-catenin signaling through orphan receptors LGR4 and LGR5[J]. PLoS One, 2012, 7(7):e40976.
47 Carmon KS, Gong X, Lin Q, Thomas A, et al. R-spondins function as ligands of the orphan receptors LGR4 and LGR5 to regulate Wnt/ beta-catenin signaling[J]. Proc Natl Acad Sci U S A, 2011, 108(28):11452-11457.
48 Koo BK, Spit M, Jordens I, et al. Tumour suppressor RNF43 is a stem-cell E3 ligase that induces endocytosis of Wnt receptors[J]. Nature, 2012, 488(7413):665-669.
49 Hao HX, Xie Y, Zhang Y, et al. ZNRF3 promotes Wnt receptor turnover in an R-spondin-sensitive manner[J]. Nature, 2012,485(7397):195-200.
50 De Lau W, Peng WC, Gros P, et al. The R-spondin/Lgr5/Rnf43 module: regulator of Wnt signal strength[J]. Genes Dev, 2014, 28(4):305-316.
51 Zebisch M, Xu Y, Krastev C, et al. Structural and molecular basis of ZNRF3/RNF43 transmembrane ubiquitin ligase inhibition by the Wnt agonist R-spondin[J]. Nat Commun, 2013, 4:2787.
52 Xi HQ, Cui JX, Shen WS, et al. Increased expression of Lgr5 is associated with chemotherapy resistance in human gastric cancer[J]. Oncol Rep, 2014, 32(1): 181-188.
53 Xi HQ, Cai AZ, Wu XS, et al. Leucine-rich repeat-containing G-protein-coupled receptor 5 is associated with invasion, metastasis,and could be a potential therapeutic target in human gastric cancer[J]. Br J Cancer, 2014, 110(8):2011-2020.
54 Jang BG, Lee BL, Kim WH. Distribution of LGR5+ cells and associated implications during the early stage of gastric tumorigenesis[J]. PLoS One, 2013, 8(12):e82390.
55 Bu Z, Zheng Z, Zhang L, et al. LGR5 is a promising biomarker for patients with stage I and II gastric cancer[J]. Chin J Cancer Res,2013, 25(1):79-89.
Lgr5-Wnt/β-catenin signal pathway and gastric cancer stem cells
NIU Lei, XI Hong-qing, CHEN Lin
Department of General Surgery, Chinese PLA General Hospital, Beijing 100853, China
CHEN Lin. Email: chenlinbj@sina.com
With the expanded and deepened of basic research fi elds, the refractory of gastric cancer is generally attributed to the existence of gastric cancer stem cells and the abnormal expression of signal pathways, among which Wnt/β-catenin signal pathway is the most representative. As the receptor protein and target gene of Wnt/β-catenin signal, Lgr5 is also considered as the potential biomarker of many malignant tumor stem cells. The relationship between Lgr5-Wnt/β-catenin signal pathway and gastric cancer stem cells is reviewed combining with the current research progress.
gastric cancer stem cells; Wnt gene; β-catenin; leucine -rich - repeat -containing G-protein -coupled receptor 5
R 735.2;Q 291
A
2095-5227(2014)12-1268-05
10.3969/j.issn.2095-5227.2014.12.026
时间:2014-09-05 10:08
http://www.cnki.net/kcms/detail/11.3275.R.20140905.1008.001.html
2014-06-03
国家自然科学基金项目(81272698)
Supported by the National Natural Science Foundation of China(81272698)
牛磊,男,在读博士,医师。研究方向:胃癌。Email: lanyushinl@sina.com
陈凛,教授,主任医师,博士生导师。Email: chenlinbj@sina.com

