上调血红素氧合酶1对糖尿病大鼠心功能的影响及可能机制
刘 璐,曹 剑,李 健,陈天萌,陈德友,高进辽,郭玉松,范 利
解放军总医院 南楼心血管一科,北京 100853
上调血红素氧合酶1对糖尿病大鼠心功能的影响及可能机制
刘 璐,曹 剑,李 健,陈天萌,陈德友,高进辽,郭玉松,范 利
解放军总医院 南楼心血管一科,北京 100853
目的探讨上调血红素氧合酶1(heme oxygenase-1,HO-1)对糖尿病大鼠心脏功能的影响及可能机制。方法将48只Wistar大鼠随机分为对照组(A组,16只),糖尿病大鼠组(B组,16只),应用钴原卟啉CoPP(HO-1诱导剂)上调HO-1的糖尿病大鼠组(C组,16只)。测量各组大鼠尾静脉葡萄糖、胰岛素及脂联素水平,采用Langendorff装置测量各组大鼠心肌和冠脉功能,采用色谱技术测量心肌组织中丙二醛(malondialdehyde,MDA)、丙二酰辅酶A及乙酰辅酶A的含量,液体闪烁计数器测量心肌中超氧化物水平,采用免疫印迹法测定心脏裂解液中信号分子、一氧化氮合酶(诱导型一氧化氮合酶iNOS和内皮型一氧化氮合酶eNOS)活性及HO活性水平。结果糖尿病大鼠组葡萄糖水平显著高于对照组(P<0.01),而胰岛素水平、脂联素水平显著低于对照组(P<0.01,P<0.05),应用CoPP后C组的葡萄糖水平及脂联素水平均升高(P<0.05,P<0.01)。糖尿病大鼠离体心脏Langendorff灌注模型的左心室功能较对照组有所下降,而冠脉阻力(coronary resistance,CR)明显升高。而上调HO-1后,糖尿病大鼠的心脏功能显著升高(P<0.01)且CR明显降低(P<0.01)。上调HO-1后,糖尿病动物体内的HO-1蛋白水平升高并伴有心脏超氧化物O2-和丙二醛水平的显著降低(P<0.05)。另外,糖尿病大鼠体内信号分子明显降低(P<0.05),上调HO-1后显著升高(P<0.05)。结论上调血红素氧合酶1可抑制氧化应激反应,恢复eNOS/iNOS平衡,升高HO-1水平,提高内皮功能和胰岛素敏感性,达到了改善心肌功能和冠脉灌注效果的目的。
血红素氧合酶1;糖尿病;心脏重构;一氧化氮;冠脉循环
血红素氧合酶(heme oxygenase,HO)系统的代谢产物一氧化碳和胆红素具有抗氧化、抗炎症、改善血管内皮功能、抗凋亡、影响细胞增殖、调节血管生成、增强胰岛素敏感性等生理功能[5-6]。脂联素是脂肪组织分泌的细胞因子,在糖尿病、胰岛素抵抗和肥胖的情况下其水平降低,这可能与糖尿病心肌功能在静息及缺血状态下的损害有关[7]。此外,HO-脂联素轴可联合作用,从而降低氧化应激反应和糖尿病心脏损伤[8]。在重型糖尿病中,多种致病机制导致心肌功能的下降[9]。本研究中的糖尿病模型可再现糖尿病性心肌病的临床特征[10]。目前,对该模型微血管异常与心肌功能的关系研究尚少。本实验的目的在于研究体内上调HO-1是否能够提高重型糖尿病性心肌病大鼠心肌及冠脉的功能以及探寻其可能的信号调节通路。
对象和方法
1 实验动物 雄性Wistar大鼠(购自军事医学科学院),2月龄,共48只,体质量180 ~ 220 g。模型制备及分组如下:对照组(A组)、糖尿病大鼠组(B组)以及应用HO-1诱导剂钴原卟啉(cobalt protoporphyrin,CoPP)治疗的糖尿病大鼠组(C组)。其中32只经腹腔注射50 mg/kg链脲佐菌素(streptozotocin,STZ)(美国Sigma公司)以制备糖尿病模型。给予STZ诱导4周后,监测糖尿病大鼠的血糖水平。给予大鼠CoPP(皮下注射0.3 mg/100 g,每周1次,连续3周),或缓冲液(标准柠檬酸钠缓冲液,pH 7.8,用法同前)。
2 心脏和冠脉功能测定 注射CoPP或缓冲液3 d后,给予大鼠腹腔注射硫喷妥钠(50 mg/kg)麻醉。迅速切除心脏,放入冷水灌注,称重。将离体心脏附着在Langendorff装置上,80 cm水柱逆行灌注(37℃),灌注培养基含有含氧的Krebs-Henseleit缓冲液。将球囊插入左心室,球囊和压力换能器相连,在电脑上记录心室内压,调整左心室舒张末压在4 ~ 10 mmHg (1 mmHg=0.133 kPa)。稳定20 min后监测心脏和冠状动脉功能。冠状动脉阻力根据冠状动脉灌注压(coronary perfusion pressure,CPP)表示,CPP由主动脉插管的第二压力传感器监测,数据由BIOPAC100生物系统收集分析。冠脉血流以ml/min表示,冠脉阻力(coronary resistance,CR)的计算公式为CPP除以冠脉血流/每克心肌质量。左心室发展压=左心室内压-舒张末压,心率(heart rate,HR),左心室内压变化最大速率(dP/dtmax),左心室内压变化最小速率(dP/dtmin)均由左心室压力信号检测计算,同时计算LVP×HR得到心率血压乘积以反应心脏耗氧量和能量的生成[5]。
3 血浆葡萄糖、胰岛素和脂联素水平测定 动物禁食至少6 h后经尾静脉取血收集血液样本。血糖水平由葡萄糖监控系统监测(美国Bayer公司),血浆胰岛素含量由大鼠胰岛素酶免疫监测系统测定(美国Cayman公司)。血浆脂联素用ELISA测定法(美国Pierce公司) 测定。
4 丙二醛、丙二酰辅酶A和乙酰辅酶A的测定丙二醛、丙二酰辅酶A和乙酰辅酶A由离子对高效液相色谱测定,并由ChromQuest软件包(美国Thermo Electron公司)进行数据采集分析[11]。
5 Western印迹分析心脏信号分子和HO活性水平冷冻心脏在液氮下研磨并置于匀浆缓冲液。将20 mg心脏组织裂解上清液经12%的SDS-PAGE电泳分离并转移到硝酸纤维素膜上,加入HO-1、HO-2抗体(加拿大Stressgen公司),丝氨酸/苏氨酸蛋白激酶抗体、磷酸化丝氨酸/苏氨酸蛋白激酶抗体、腺苷酸活化蛋白激酶抗体、磷酸化腺苷酸活化蛋白激酶抗体和脂联素抗体(美国Cell Signaling公司),内皮型一氧化氮合酶(eNOS)抗体、诱导型一氧化氮合酶(iNOS)抗体和磷酸化内皮型一氧化氮合酶抗体(美国Santa Cruz公司),行Western印迹分析[3]。HO-1活性通过扫描双光束分光光度计进行评估(Lambda 17 UV/Vis;美国Perkin Elmer Cetus公司),以nmol bilirubin/(mg protein·h)表示。
6 心肌组织超氧化物水平测定 将冷冻心脏放在5 μm小型塑料闪烁瓶中充分混匀,其中含有5μm发光剂用以监测O2-以及相关检测成分,最后放入1 ml经空气平衡后的Krebs缓冲液。使用液体闪烁计数器(LS6000IC;美国Beckman公司)在37℃下测定发光剂的发光次数,并且在去除背景后以“counts/(min·mg)”为单位记录数据[3]。
7 统计学处理 所有数据应用SPSS15.0软件进行处理分析。计量资料用±s表示,计数资料用百分数表示。组间比较采用双因素方差分析。P<0.05为差异有统计学意义。
结果
1 血液学生化指标证实糖尿病模型成功建立 给予50 mg/kg STZ后,72 h空腹血糖检测证实糖尿病组[(463.4±19.1) mg/dl]和对照组[(119±2.6) mg/ dl]差异有统计学意义,糖尿病模型建立成功。
2 上调HO-1对心脏和冠脉功能的影响 从糖尿病动物中分离出的心脏与对照组相比显示,CR增加,心脏功能降低,上调HO-1改善了糖尿病心脏的RPP及所有变力相关值(P<0.05),且其心脏舒张功能和CR值恢复至正常水平(表1)。
3 上调HO-1对HO-1和HO-2的表达和HO活性的影响 与对照组相比,糖尿病组心脏的HO-1蛋白水平和HO活性均有所降低(B组比A组,P<0.05)(表2)。上调HO-1后糖尿病动物的HO-1蛋白水平和HO活性均升高(C组比B组,P<0.01,见图1)。而HO-2蛋白的水平在糖尿病大鼠和上调HO-1前无明显差异(图1)。
4 上调HO-1对胰岛素敏感性和血浆脂联素水平的影响 B组大鼠的血浆葡萄糖水平较A组明显升高(B组vs A组,P<0.01)(表2),而对应的血浆胰岛素水平较A组明显下降(B组vs A组,P<0.01)。上调HO-1后在不改变胰岛素水平的情况下,糖尿病组大鼠的血糖水平明显降低(C组vs B组,P<0.05),从而提高胰岛素的敏感性。糖尿病大鼠的血浆脂联素水平较对照组显著降低(B组vs A组,P<0.05),上调HO-1后其浓度明显增加(C组vs B组,P<0.01)。
5 上调HO-1对丙二醛和O2-的影响 与对照组相比,糖尿病心脏的O2-和MDA水平均明显升高(B组vs A组,P<0.05,P<0.01),上调HO-1后此现象被完全扭转(C组vs B组,P<0.01)(表2)。
6 上调HO-1对丙二酰辅酶A和乙酰辅酶A水平的影响 糖尿病组心脏存在丙二酰辅酶A水平的显著降低(B组vs A组,P<0.05),同时乙酰辅酶A水平显著增加(B组vs A组,P<0.01)(表2)。这两种变化在上调HO-1后均恢复正常。
7 上调HO-1对NOS亚型平衡表达的影响 糖尿病组中分离出的心脏表达的p-eNOS/eNOS的值较对照组偏低(B组vs A组,P<0.05)。如图2所示,上调HO-1可升高p-eNOS的水平,从而提高p-eNOS/eNOS的比值(C组vs B组,P<0.05)。糖尿病动物心脏呈现出iNOS表达的增加,在上调HO-1后显著降低(表3,图2)。
8 上调HO-1对心脏AKT、AMPK与脂联素水平的影响 糖尿病动物的心脏较对照组有显著的pAKT和pAMPK水平下降(B组vs A组,P<0.005),而Akt和AMPK的水平无任何变化(表3,图3)。上调HO-1则完全逆转了这些变化,并升高了糖尿病大鼠心肌组织的脂联素水平(C组vs B组,P<0.05)。

图 1 3组HO-1/HO-2的免疫印迹图Fig.1 Expression of HO-1/HO-2 in 3 groups

图 2 3组eNOS,p-eNOS和iNOS的免疫印迹图Fig.2 Expression of eNOS, p-eNOS and iNOS in 3 groups

图 3 3组心肌pAKt、pAMPK和脂联素免疫印迹图Fig.3 Cardiac expression of pAKt, pAMPK and adiponectin in 3 groups
表1 3组心脏功能参数指标的比较Tab. 1 Cardiac function parameters in 3 groups (±s, n=16)

表1 3组心脏功能参数指标的比较Tab. 1 Cardiac function parameters in 3 groups (±s, n=16)
RPP: rate-pressure product; CR: coronary resistance; HR: heart rate; LVP: left ventricular systolic pressure; LVDP: left ventricular developed pressure calculated as described in Section "Materials and Methods", aP<0.05, vs other groups, bP<0.05, vs controls
A B C dP/dTmax2 876±1342 137±116a2 883±121 dP/dTmin-1 943±67-1 249±73a-1 946±48 RPP25 137±8718 796±117a22 374±94b CR5.47±0.027.21±0.13a5.51±0.12 HR (beats/min)213±3178±3a207±4 LVP (mmHg)120±693±9b105±5a LVDP (mmHg)110±481±5a94±3b
表2 3组心肌组织氧化还原指标的比较Tab. 2 Comparison of cardiac tissue levels of oxidative stress parameters in 3 groups (±s, n=16)
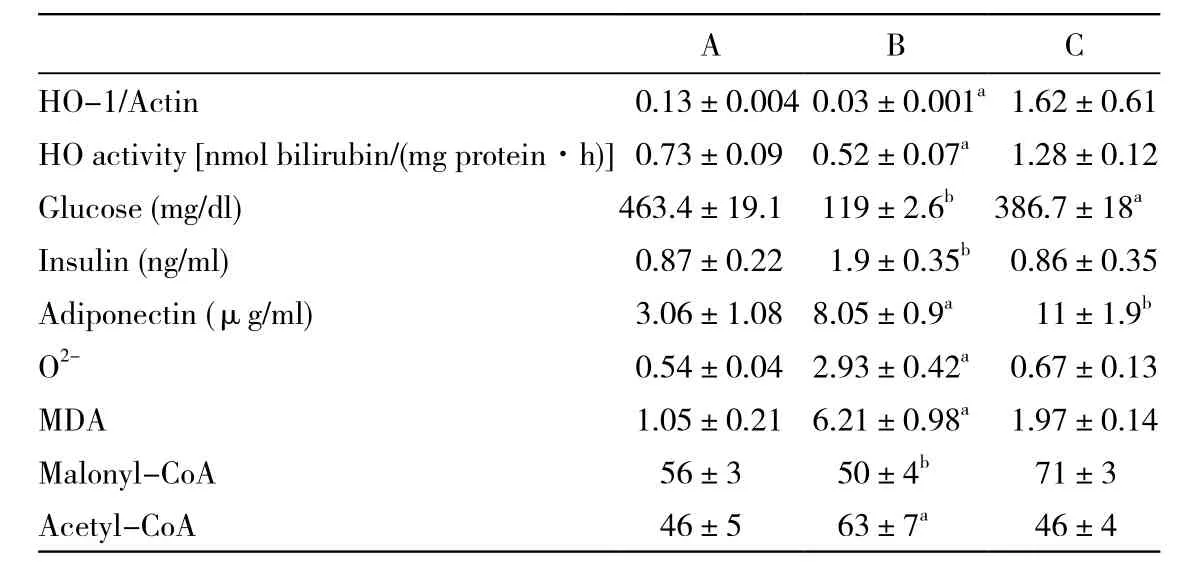
表2 3组心肌组织氧化还原指标的比较Tab. 2 Comparison of cardiac tissue levels of oxidative stress parameters in 3 groups (±s, n=16)
aP<0.05, vs other groups; bP<0.01, vs other groups
A B C HO-1/Actin0.13±0.004 0.03±0.001a1.62±0.61 HO activity [nmol bilirubin/(mg protein·h)]0.73±0.090.52±0.07a1.28±0.12 Glucose (mg/dl)463.4±19.1119±2.6b386.7±18a Insulin (ng/ml)0.87±0.221.9±0.35b0.86±0.35 Adiponectin (μg/ml)3.06±1.088.05±0.9a11±1.9b O2-0.54±0.042.93±0.42a0.67±0.13 MDA1.05±0.216.21±0.98a1.97±0.14 Malonyl-CoA56±350±4b71±3 Acetyl-CoA46±563±7a46±4
表3 3组心肌免疫印迹指标的比较Tab. 3 Comparison of cardiac parameters in 3 groups detected byWestern blot ±s, n=16)

表3 3组心肌免疫印迹指标的比较Tab. 3 Comparison of cardiac parameters in 3 groups detected byWestern blot ±s, n=16)
aP<0.05, vs group A; bP<0.05, vs other groups
A B C p-eNOS/eNOS0.56±0.0010.41±0.002a0.86±0.02b iNOS/Actin0.40±0.051.01±0.02a0.62±0.02ab pAMPK/AMPK0.46±0.110.37±0.061.39±0.23b pAKT/AKT0.89±0.180.23±0.09b0.83±0.07 Adiponectin/Actin2.41±0.620.27±016b2.03±0.98
讨论
研究证明,给予STZ诱导的重型糖尿病大鼠CoPP治疗,可增加HO-1的表达,逆转心肌和冠脉功能不全[12]。此重型糖尿病模型存在的心肌功能降低和冠脉阻力增加在上调HO-1后得以恢复,这可能与氧化应激的降低及血管内皮功能的改善有关[12]。特别指出,上调HO-1逆转了糖尿病心肌iNOS的过表达和eNOS的表达下调现象,恢复了NOS的平衡,从而协同改善心肌血管功能。同时,其作用效果还与胞外超氧化物歧化酶和NO生物利用度增加有关[13]。HO-1的全身体液效应体现为HO-1-脂联素途径的活化,且上调HO-1通过提高胰岛素敏感性、增强葡萄糖摄取和脂肪酸的氧化来提高脂联素的水平,最终改善心肌功能[14]。
研究证实,活性氧化物是糖尿病性心肌病发生和发展的主要原因[9]。本实验显示,上调HO-1可明显改善CR和心肌功能,并降低心肌组织氧化应激标记物(超氧化物和丙二醛)的水平[15]。
糖尿病组心脏中eNOS的进行性降低伴随着iNOS的过表达现象,在上调HO-1后得以恢复[9]。诱导型一氧化氮合酶可比其他亚型产生更多的NO,在氧化应激状态下与超氧化物反应并促进活性氮发挥其细胞毒性作用,从而导致心血管功能紊乱,显著提升了糖尿病组心血管并发症的发生率[16]。实验结果显示,p-eNOS的水平也有所升高,此现象可能与上调HO-1后血浆及心肌组织中的脂联素的水平升高有关。脂联素可通过AMPK-AKT路径调节eNOS和iNOS的平衡,以影响NO的生成[7]。结果证实,脂联素可刺激内皮NO的生成,其水平降低可导致胰岛素抵抗和内皮及心功能障碍[17]。
在正常的心脏中,脂肪酸氧化和葡萄糖代谢同时产生能量。而糖尿病患者心脏由于葡萄糖的摄取和利用减弱,几乎完全依靠脂肪酸氧化供能[18]。我们通过测量心肌丙二酰辅酶A的水平来探讨脂联素和HO-1升高对糖尿病大鼠心肌代谢的影响,丙二酰辅酶A在糖尿病大鼠心脏的葡萄糖利用和防止细胞脂毒性的代谢方面具有重要作用。研究证实,当胰岛素敏感性正常时,肌肉中的葡萄糖含量与丙二酰辅酶A含量呈正比,而胰岛素可用性的下降将降低细胞中丙二酰辅酶A的水平,从而增加脂肪酸的氧化。此现象在上调HO-1后得以恢复[19]。本实验结果显示,上调HO-1后的糖尿病大鼠心脏葡萄糖利用率明显升高,丙二酰辅酶A的水平显著增加。我们推测脂联素的释放及HO-1的诱导生成可能与β-氧化中丙二酰辅酶A降低有着密切联系。
综上所述,本研究证实上调HO-1的表达,可通过增加脂联素的水平和抗氧化应激、改善血管内皮功能等改善重型糖尿病性心肌病大鼠心肌及冠脉的功能,其可能的信号调节通路为pAMPK-p-eNOS。
1 Cao J, Drummond G, Inoue K, et al. Upregulation of heme oxygenase-1 combined with increased adiponectin lowers blood pressure in diabetic spontaneously hypertensive rats through a reduction in endothelial cell dysfunction, apoptosis and oxidative stress[J]. Int J Mol Sci, 2008, 9(12): 2388-2406.
2 Pop-Busui R, Oral E, Raffel D, et al. Impact of rosiglitazone and glyburide on nitrosative stress and myocardial blood flow regulation in type 2 diabetes mellitus[J]. Metabolism, 2009, 58(7): 989-994.
3 Cao J, Sodhi K, Puri N, et al. High fat diet enhances cardiac abnormalities in SHR rats: Protective role of heme oxygenaseadiponectin axis[J]. Diabetol Metab Syndr, 2011, 3(1): 37.
4 Pinnick KE, Nicholson G, Manolopoulos KN, et al. Distinct developmental profile of Lower-Body adipose tissue defines resistance against Obesity-Associated metabolic complications[J/OL]. http://diabetes.diabetesjournals.org/content/early/2014/06/12/db14-0385.long5 Vecoli C, Cao J, Neglia D, et al. Apolipoprotein A-I mimetic peptide L-4F prevents myocardial and coronary dysfunction in diabetic mice[J]. J Cell Biochem, 2011, 112(9): 2616-2626.
6 Kusmic C, L’abbate A, Sambuceti G, et al. Improved myocardial perfusion in chronic diabetic mice by the up-regulation of pLKB1 and AMPK signaling[J]. J Cell Biochem, 2010, 109(5): 1033-1044.
7 Cao J, Puri N, Sodhi K, et al. Apo A1 mimetic rescues the diabetic phenotype of HO-2 knockout mice via an increase in HO-1 adiponectin and LKBI signaling pathway[J/OL]. http://www.hindawi.com/journals/ijhy/2012/628147
8 Antoniades C, Antonopoulos AS, Tousoulis D, et al. Adiponectin:from obesity to cardiovascular disease[J]. Obes Rev, 2009, 10(3):269-279.
9 Bando YK, Murohara T. Diabetes-related heart failure[J]. Circ J,2014, 78(3):576-583.
10 Kim MS, Wang Y, Rodrigues B. Lipoprotein lipase mediated fatty acid delivery and its impact in diabetic cardiomyopathy[J]. Biochim Biophys Acta, 2012, 1821(5): 800-808.
11 Donzelli S, Switzer CH, Thomas DD, et al. The activation of metabolites of nitric oxide synthase by metals is both redox and Oxygen dependent: a new feature of Nitrogen oxide signaling[J]. Antioxid Redox Signal, 2006, 8(7/8): 1363-1371.
12 Potier L, Waeckel L, Vincent MP, et al. Selective kinin receptor agonists as cardioprotective agents in myocardial ischemia and diabetes[J]. J Pharmacol Exp Ther, 2013, 346(1): 23-30.
13 Zhao S, Wu J, Zhang L, et al. Post-conditioning with sevoflurane induces heme oxygenase-1 expression via the PI3K/Akt pathway in lipopolysaccharide-induced acute lung injury[J]. Mol Med Rep,2014, 9(6): 2435-2440.
14 Cao J, Sodhi K, Inoue K, et al. Lentiviral-human heme oxygenase targeting endothelium improved vascular function in angiotensin II animal model of hypertension[J]. Hum Gene Ther, 2011, 22(3):271-282.
15 Allwood MA, Kinobe RT, Ballantyne L, et al. Heme oxygenase-1 overexpression exacerbates heart failure with aging and pressure overload but is protective against isoproterenol-induced cardiomyopathy in mice[J]. Cardiovasc Pathol, 2014, 23(4):231-237.
16 Chen TM, Li J, Liu L, et al. Effects of heme oxygenase-1 upregulation on blood pressure and cardiac function in an animal model of hypertensive myocardial infarction[J]. Int J Mol Sci,2013, 14(2): 2684-2706.
17 Li M, Kim DH, Tsenovoy PL, et al. Treatment of obese diabetic mice with a heme oxygenase inducer reduces visceral and subcutaneous adiposity, increases adiponectin levels, and improves insulin sensitivity and glucose tolerance[J]. Diabetes, 2008, 57(6):1526-1535.
18 Kerner J, Minkler PE, Lesnefsky EJ, et al. Fatty acid chain elongation in palmitate-perfused working rat heart: mitochondrial acetyl-CoA is the source of two-carbon units for chain elongation[J]. J Biol Chem, 2014, 289(14): 10223-10234.
19 Pulinilkunnil T, Kienesberger PC, Nagendran J, et al. Myocardial adipose triglyceride lipase overexpression protects diabetic mice from the development of lipotoxic cardiomyopathy[J]. Diabetes, 2013,62(5): 1464-1477.
Effects and mechanism of up-regulation of heme oxygenase-1 on cardiac function in diabetic rats
LIU Lu, CAO Jian, LI Jian, CHEN Tian-meng, CHEN De-you, GAO Jin-liao, GUO Yu-song, FAN Li
First Department of Cardiovasology in South Building, Chinese PLA General Hospital, Beijing 100853, China
CAO Jian. Email: calvin301@163.com
ObjectiveTo investigate the effects and mechanism of up-regulation of heme oxygenase-1 (HO-1) on cardiac function of diabetic rats.MethodsForty-eight wistar rats were divided into 3 groups: control group (group A, n=16), diabetic group (group B, n=16) and diabetic rats treated with HO-1 inducer cobalt-protoporphyrinⅨ(CoPP) to enhance HO-1 expression group (group C, n=16). Tail vein blood samples of glucose, insulin and adiponectin were measured in each group. Isolated hearts were prepared to measure the cardiac and coronary functions. Levels of malondialdehyde (MDA), malonyl coenzyme A (malonyl-CoA), acetyl coenzyme A (acetyl-COA) and superoxide anion (O2-) in heart tissue were measured. The signaling molecule of cardiac tissue and HO activity level were measured by Western blot.ResultsThe level of glucose in group B was signif i cantly higher than in group A (P<0.01), while the level of insulin (P<0.01) and adiponectin (P<0.05) in group B were lower than in group A. Isolated hearts from diabetic rats in Langendorff conf i guration displayed worse ventricular function and higher coronary resistance (CR) compared with hearts from control hearts, all the indexes had dramatically increased with the up-regulation of HO-1 on diabetic animals (P<0.01), while the level of CR had decreased (P<0.01). HO-1 inducer CoPP enhanced HO-1 protein levels and reduced oxidative stress in diabetic animals, which indicated by the decrease in heart O2-and MDA levels (P<0.05). HO-1 up-regulation increased signaling molecule level and reversed the eNOS/iNOS expression imbalance which was observed in the untreated diabetic heart (P<0.05). Moreover, after the improvement of HO-1 expression, a rise in malonyl-COA as well as a decrease in acetyl-COA was observed in diabetic hearts (P<0.05).ConclusionUp-regulation of heme oxygenase-1 can improve both cardiac function and coronary fl ow by blunting oxidative stress, restoring eNOS/iNOS expression balance via pAMPK-p-eNOS pathway, thereby favoring improvement in both endothelial function and insulin sensitivity.
heme oxygenase-1; diabetes mellitus; cardiac remodeling; nitric oxide; coronary circulation
R 68
A
2095-5227(2014)12-1237-05
10.3969/j.issn.2095-5227.2014.12.017
时间:2014-08-25 09:14
http://www.cnki.net/kcms/detail/11.3275.R.20140825.0914.001.html
糖尿病是一种全球性流行病,它可增加罹患冠心病的可能性,使心力衰竭的发生率和心血管事件的死亡率陡增[1]。而糖尿病对于心肌功能和冠脉宏/微观系统的影响机制已成为当前研究的重点[2]。其中,活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)的影响已被多项实验证实[3]。一氧化氮(NO)信号通路介导了糖尿病的心肌和血管损伤,而一氧化氮合酶(nitric oxide synthase,NOS)亚型的表达也在糖尿病的状态下发生了改变[4]。
2014-06-30
北京市自然科学基金项目(7122175)
Supported by the Beijing Natural Science Foundation of China (7122175)
刘璐,女,在读硕士。研究方向:血红素氧合酶与心血管疾病。Email: kellyliulu@126.com
曹剑,男,博士,主任医师。Email: calvin301@163.com

