黄芪对铜绿假单胞菌毒力因子调控表达及菌体运动的影响*
叶丽华,夏 飞,李 欣,江必武,王 平
(1.华中科技大学同济医学院附属同济医院感染科,武汉 430030;2.武汉生物制品研究所有限责任公司,武汉 430060;3.武汉市第一医院汉西分院消化内科,武汉 430034)
黄芪对铜绿假单胞菌毒力因子调控表达及菌体运动的影响*
叶丽华1,夏 飞2,李 欣3,江必武3,王 平3
(1.华中科技大学同济医学院附属同济医院感染科,武汉 430030;2.武汉生物制品研究所有限责任公司,武汉 430060;3.武汉市第一医院汉西分院消化内科,武汉 430034)
摘要:[目的]观察黄芪对铜绿假单胞菌相关毒力因子表达及菌体运动的影响,探讨黄芪对铜绿假单胞菌的作用机制。[方法]不同浓度黄芪与对数生长期铜绿假单胞菌共培养,弹性蛋白-刚果红降解实验检测细菌分泌的弹性蛋白酶活性,紫外分光光度法测定绿脓菌素分泌量,结晶紫染色法观察生物被膜形成量,在含黄芪琼脂平板中检测菌体集群运动与泳动能力。[结果]黄芪在终浓度25、12.5、6.25 g/L条件下对弹性蛋白酶、绿脓菌素表达有显著抑制,并能抑制生物被膜形成。在低于12.5 g/L时对细菌增殖无显著影响。细菌在12.5 g/L条件下泳动能力与集群运动均受到显著影响。[结论]黄芪对铜绿假单胞菌增殖和毒力因子表达的抑制程度不一致,提示黄芪抑菌可能通过多种途径发挥抑菌功能,并可能在低浓度下便对密度感应系统造成显著抑制。
关键词:弹性蛋白酶;绿脓菌素;生物被膜;菌体运动;黄芪
铜绿假单胞菌(PA)是临床上常见院内获得性感染条件致病菌之一,能产生释放多种毒力因子,如外毒素A、弹性蛋白酶、鼠李糖等[1]。该菌能借助分泌物形成生物被膜(BF)并依靠菌体运动器官完成多种细菌运动如集群运动、涌动等。利用生物膜-浮游态转换导致感染扩散、毒素播散和全身炎症反应综合征,加之抗生素的乱用和滥用,导致多重耐药或泛耐药菌株的出现,部分患者由于无药可用而死于感染。随着“抗生素后时代”的到来,人们开始更多地求助于非抗生素治疗。中药迄今已有两千多年的历史,现代研究发现有多种中药具有抑菌杀菌的功效[2-3],黄芪是临床上常用的一味中药,具有增强机体免疫、保肝、利尿和广泛的抗菌作用。因此本实验选用黄芪粉作用PA,观察其对毒力因子表达与菌体运动的影响,探讨作用机制,为临床细菌感染的治疗提供依据。
1 材料和方法
1.1 菌株与培养液 野生标准株PAO1株为本实验室保存。培养液:LB培养液,含1%胰蛋白胨、0.5%酵母提取物、1%氯化钠。
1.2 试剂与试液 0.2 mol/L盐酸溶液,10 mmol/L磷酸氢二钠(Na2HPO4)溶液,刚果红弹性蛋白(美国Sigma公司),黄芪颗粒(江阴天江药业有限公司,1205182,每袋1.5 g。
1.3 琼脂平板 LB培养基配制成0.3%、0.5%琼脂悬液,高压灭菌后备用。配制500g/3L黄芪粉末悬液,装入玻璃瓶,100℃水浴40 min后离心,5 000 r/min,分别取上清液1.5 mL加入平碟内,各加入融化的0.3%、0.5%琼脂20 mL,混匀固化后备用。平碟内黄芪药液终浓度为12.5 g/L。0.5%琼脂平板使用前倒置于30℃过夜。
1.4 实验器材 紫外分光光度计(HITACHU-2900、Amersham Genequant pro),苏泰生物安全柜,恒温摇床,硅胶管。
1.5 黄芪对PA生长的影响 PAO1菌培养过夜,用LB培养液稀释A600为0.6后加入玻管,3.0mL/管;配制1200g/6L的黄芪悬液,玻管内100℃水浴40 min后,5 000 r/min,取上清用LB培养基稀释为100、50、25和12.5 g/L。取上述不同浓度药液分别加入含有菌液的玻璃管中,1.0 mL/管。加入后使菌悬液中黄芪终浓度为50、25、12.5、6.25、3.12 g/L。阴性对照组加入1 mL LB培养基,同时设立黄芪悬液对照。37℃培养、150 r/min,24 h。测定A600值,实验重复3次。
1.6 绿脓菌素分泌检测 收集上述菌液离心,16 000×g 5 min取上清,加入2.0 mL氯仿,分离下层溶液并加入0.2 mol/L HCL 0.8 mL,取上层液体离心,16 000×g 2min,取上清测定A520值,实验重复3次,取平均值[4]。
1.7 弹性蛋白酶检测[5]收集上述菌液上清,每管取80 μL备用,取60 μL加入到800 μL Na2HPO4溶液中(含1 g/L刚果红弹性蛋白),37℃反应18 h。反应完成后离心,16 000×g 5 min,取上清测A495值,实验重复3次,取平均值。
1.8 BF形成能力检测 准备2 cm长硅胶管高压灭菌后置玻管内,加入A600值0.6菌液3.0 mL,分别加入上述浓度药液1.0 mL,每梯度3管,37℃静置培养。培养到期后取出硅胶管至空白玻璃管内用蒸馏水清洗残留浮游菌3次,用1%结晶紫室温孵育15 min,用蒸馏水清洗3次后加入2 mL 95%乙醇洗涤,测定A540值,实验重复3次,取平均值[5]。
1.9 集群运动与泳动能力检测 根据前期检测结果分别制备含12.5 g/L黄芪药液的0.3%与0.5%琼脂平皿。取培养过夜菌液A6001.5接种,集群运动接种于琼脂层表面,每板1.0 μL,泳动接种于琼脂中层,每板0.6 μL[6-7]。
1.10 数据统计 采用SPSS 18.0统计软件分析,计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 BF检测 BF的A540值显示50 g/L组生物膜形成弱于其余各组,3.12 g/L组生物膜形成与阴性对照组无统计学差异,结果见表1。
2.2 黄芪对PA生长的影响 本次实验中PA的A600值随着黄芪浓度的升高而逐渐增加。其中50 g/L和25 g/L的A600值显著高于其余各组,12.5、6.25、3.12 g/L组与空白对照组间无统计学差异,结果见表2。
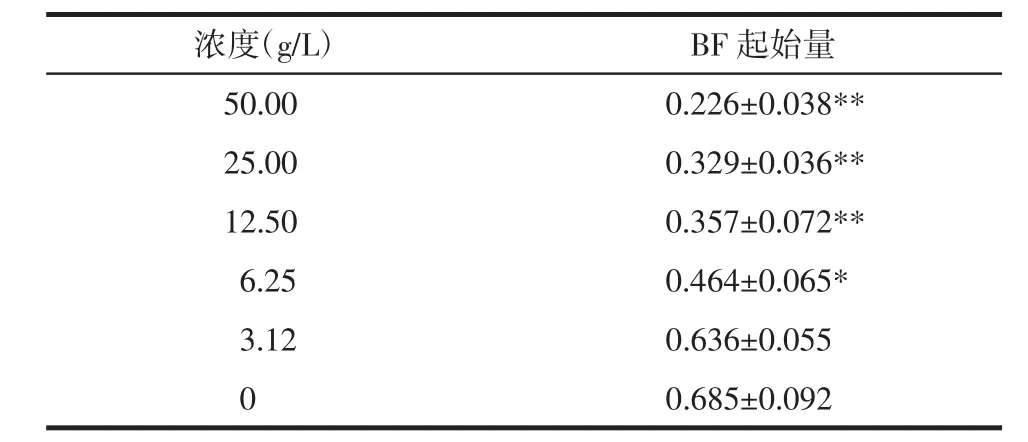
表1 不同浓度黄芪对PA的BF起始量的影响(x±s,n=3)Tab.1 Effects of Astragalus mongholicus on the initiation of PA biofilms(x±s,n=3)
2.3 绿脓菌素与弹性蛋白酶分泌检测 各组绿脓菌素A520值与弹性蛋白酶A495值随着黄芪浓度的增加而逐渐降低,50 g/L组绿脓菌素与弹性蛋白酶分泌量均低于其余各组,结果见表3。
2.4 集群运动与泳动能力检测 选取12.5 g/L黄芪浓度制备琼脂平板。37℃孵育24 h后可见0.3%琼脂平皿中黄芪组泳动能力弱于阴性对照组。0.5%集群运动平皿中阴性对照组泳动面积显著略大于黄芪组,培养24、48、72 h仍呈现此结果,见图1。
3 讨论
近年来中药已成为研究抗菌抑菌药物的来源之一,其优势在于中药某些成分具有天然抗菌抑菌活性,这已在中医学典籍与长期临床医学实践中得到证实[8-10],如具有补气清热解毒、利湿通淋类作用的黄芪、黄连等多种中药具有不同程度的抑菌作用。此外,通过现代科技还可提取有效成分并在其基本结构上加以改造。在细菌抗生素耐药压力与日俱增的背景下,利用中药配以低剂量抗生素协同杀菌抑菌的研究日渐增多。
本实验中笔者选择黄芪体外作用于PA,观察是否能够对PA毒力因子、BF以及细菌运动系统产生影响。实验数据表明PA的吸光度A600随着黄芪浓度增加而升高。实验组与黄芪对照组的吸光度差值有随着黄芪浓度增加而升高的趋势,这表明高浓度黄芪提取液对吸光度造成干扰。同时低浓度黄芪对照组间吸光度值无显著差异显示这种干扰程度在此范围内较为恒定,细菌吸光度数值在低黄芪浓度范围内与正常对照无显著差异。

表2 不同浓度黄芪对PA生长的影响(x±s,n=3)Tab.2 Effects of Astragalus mongholicus at different concentration on growth of PA(x±s,n=3)g/L

表3 绿脓菌素与弹性蛋白酶的检测结果(x±s,n=3)Tab.3 Effects of Astragalus mongholicus on production of pyocyanin and lastase(x±s,n=3)g/L

图1 12.5 g/L黄芪对PA泳动与集群运动的影响Fig.1 Effects of Astragalus mongholicus of 12.5 g/L onswimming and swarming of PA
实验结果显示细菌毒力因子在黄芪作用下不同程度地受到抑制,特别是低于12.5 g/L时,黄芪提取液吸光度无显著变化,细菌浓度也无显著增加,这表明低浓度黄芪提取液对细菌生长无抑制作用。此时毒力因子的抑制机制可能为非生长抑制途径。Schabel等[5]的研究表明弹性蛋白酶受到Las密度感应系统(QS)的严格调控,QS系统激活之前只有非常低水平的表达,弹性蛋白酶缺失意味着QS系统单一或者双缺陷。在笔者前期研究中已将弹性蛋白酶的表达作为判断QS系统突变或缺失的标准并已进行了基因水平的验证,这也提示当QS系统受到抑制时其弹性蛋白酶的表达也会受到抑制。QS系统也参与BF的分化与成熟,特别是BF的微克隆分化需要3OC12-高丝氨酸内酯(3OC12-HSL)分子,lasI基因一旦突变,PA就只能形成扁平、均一不分化的生物膜,而不能形成成熟的三维立体结构。当加入合成的信号分子3OC12-HSL共同培养后,能使突变株恢复形成成熟生物膜的能力[11]。本项实验结果表明不同浓度的实验组黄芪同样能抑制BF的起始,并呈现浓度依赖效应。
基于以上结果,笔者选取12.5 g/L黄芪开展泳动和集群运动实验。有报导表明泳动与集群运动主要依赖细菌鞭毛[12],泳动来自细菌菌毛与鞭毛的协同作用,集群运动主要来自鞭毛运动。本实验结果显示在12.5 g/L黄芪作用下,细菌泳动与集群运动均受到显著抑制。这表明QS系统不仅对毒力因子的表达具有不同程度的调控作用,同时还能影响细菌鞭毛运动,包括BF的形成。
本次实验笔者发现黄芪从多个方面对PA的毒力因子、BF和运动产生广泛抑制,因此这种抑制有可能在低浓度条件下对QS系统产生抑制而在高浓度时对细菌生长产生抑制。这种机制可能来自对QS系统的多个层面的抑制。如从红藻Delisea pulchra发现的溴化呋喃[13]因其结构与AHL分子相似而发挥干扰QS信号交流系统传递的作用,又如从大蒜提取物中发现至少含有3种不同的QS抑制物,其中的一种已被鉴定为环状二硫化合物[14],这种QS抑制物对以LuxR为基础的QS发挥强烈抑制作用。这些天然QS抑制物的作用机制为研究黄芪QS抑制机制提供了基础。
参考文献:
[1] Smith RS,Iglewski BH.P.aeruginosa quorum-sensing systems and virulence[J].Curr Opin Microbiol,2003,6(l):56-60.
[2]薛 坤.15种中药制剂微生物限度检查方法验证[J].天津中医药,2008,25(1):71-74.
[3]张晓燕汪选斌王林海,等.前愈汤剂体外抗菌实验研究[J].天津中医药,2008,25(3):241-242.
[4] Essar DW,Eberiy L,Hadero A,et al.Identification and characterization of genes for a second anthranilate synthase in Pseudomonas aeruginosa:interehangeability of the two anthranilate synthases and evolutionary implications[J].J Baeteriol,1990,172(2):884-900.
[5] Schabel JA,Carty NL,Mcdonald NA,et al.Analysis of quorum sensing-deficient clinical isolates of Pseudomonas aeruginosa[J].J Med Microbiol,2004,53(9):841-853.
[6] Déziel E,Comean Y,Villemur R.Initiation of biofilm formation by Pseudomonas aeruginosa 57RP correlates with emergence of hyperpiliated and highly adherent phenotypic variants deficient in swimming,swarming,and twitching motilities[J].J Baeteriol,2001,183 (4):1195-1204.
[7] Rashid MH,Kornberg A.Inorganic polyphosphate is needed for swimming,swarming,and twitching motilities of Pseudomonas aeruginosa[J].Proc Natl Aead Sci,2000,25(9):4885-4890.
[8]张丽娟,张贵君,李仁伟.金莲花蛋白超声提取工艺优化及其抑菌活性的初步测定[J].天津中医药,2007,24(1):63-65.
[9]熊卫东马庆一.含蒽醌的中草药—一类潜在的天然抑菌防腐剂初探[J].天津中医药,2004,21(2):158-160.
[10]杨春华.幽门螺杆菌感染性胃病中医药治疗研究进展[J].天津中医药大学学报,2008,27(2):110-112.
[11]Davies DG,Parsek MR,Pearson JP,et al.The involvement of cellto-cell signals in the development of a bacterial biofilm[J].Science, 1998,280:295-298.
[12]Ja cinta CC,Maxsim LG,Fan J,et al.Flagella and pili-mediated near-surface single-cell motility mechanisms in P.aeruginosa[J]. Biophysical Journal,2011,100(7):1608-1616.
[13]Manefield M,Rasmussen TB,Henzter M,et al.Halogenated furanones inhibit quorum sensing through accelerated LuxR turnover[J].Microbiology,2002,148(4):1119-1127. [14]PerssonT,HansenTH,RasmussenTB,et al.Rational design and synthesis of new quorum-sensing inhibitors derived fromac-ylated homoserine lactones and natural products from garlic[J].Org Biomol Chem,2005,3(2):253-262.
(本文编辑:高 杉,于春泉)
中图分类号:R285.5
文献标识码:A
文章编号:1672-1519(2014)02-0113-04
收稿日期:(2013-08-10)
*基金项目:湖北省自然科学基金资助项目(2011CDB302),武汉市卫生局临床医学科研项目(WX12A06)。
作者简介:叶丽华(1970-),硕士,主管护师,主要从事感染性疾病研究。
通讯作者:王 平,E-mail:13986271869@139.com。
Effects of Astragalus mongholicus on expression of pseudomonas aeruginosa virulence factors and somatic motility
YE Li-hua1,XIA Fei2,LI Xin3,JIANG Bi-wu3,WANG Ping3
(1.Department of Infectious Diseases,Tongji Hospital Affiliated to Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,China;2.Wuhan Institute of Biological Institute Co.,Ltd.,Wuhan 430060,China;3.Department of Gastroenterology,Hanxi Branch of Wuhan First Hospital,Wuhan 430034,China)
Abstract:[Objective]To investigate the effects of Astragalus mongholicus on virulence factor of pseudomonas aeruginosa(PA)virulence and somatic motility and explore its mechanism.[Methods]The elastase activity was assessed quantitatively by elastin-Congo red degradation;the secretion of pyocyanin was determined with ultraviolet spectrophotometry after co-culture of different concentration of Astragalus mongholicus and PA at heterogonous grow phase;the biofilm formation was detected by crystal violet staining.The assay of somatic swarming was conducted in petri dishes,containing Astragalus mongholicus.[Results]The expression of elastase and pyocyanin were obviously inhibited at the concentration of 25 g/L,12.5 g/L and 6.25 g/L of Astragalus mongholicus and the biofilm formation was also inhibited.No effect on bacterial hyperplasia was found under 12.5 g/L.But the swimming and swarming motility of bacteria were reduced at 12.5 g/L.[Conclusion]Astragalus mongholicus can inhibit the hyperplasia and virulence factor of PA at different levels,indicating that the inhibition is controlled by multiple mechanisms,and the quorum sensing system can regulate these factors at a lower concentration of cultivation.
Key words:elastase;pyocyanin;biofilm;somatic motility;Astragalus mongholicus

