健脾益肺Ⅱ号对熏烟联合脂多糖诱导大鼠炎症因子及金属蛋白酶表达的影响*
林 琳,许银姬,吴 蕾,陈芝喜,于旭华
(1.广州中医药大学第二附属医院,广州 510120;2.广州中医药大学,广州 510405)
·实验研究·
健脾益肺Ⅱ号对熏烟联合脂多糖诱导大鼠炎症因子及金属蛋白酶表达的影响*
林 琳1,许银姬1,吴 蕾1,陈芝喜2,于旭华1
(1.广州中医药大学第二附属医院,广州 510120;2.广州中医药大学,广州 510405)
[目的]通过观察健脾益肺Ⅱ号对熏烟联合脂多糖诱导的大鼠肺组织基质转化生长因子β1(TGF-β1)、金属蛋白酶-9(MMP-9)和组织金属蛋白酶抑制因子-1(TIMP-1)以及肿瘤坏死因子-α(TNF-α)和白介素(IL-8)表达的影响,以探讨健脾益肺Ⅱ号协调气道损伤、修复平衡以及减少气道重构的作用机制,从而阐明该方防治慢性阻塞性肺疾病(COPD)气道损伤的可能作用机制。[方法]将SD大鼠随机分为正常对照组、模型组、健脾益肺Ⅱ号低剂量组、健脾益肺Ⅱ号高剂量组、泼尼松组。以熏烟联合脂多糖(LPS)的方法建立大鼠肺部损伤模型,给予相应药物干预,观察记录大鼠一般状况,至实验结束,采用免疫组化法比较各组大鼠肺组织MMP-9、TIMP-1的表达水平,采用ELISA法检测大鼠肺组织及血清中TGF-β1的水平变化以及肺组织中TNF-α和IL-8水平的变化。[结果]模型组大鼠肺组织MMP-9、TIMP-1以及MMP-9/TIMP-1的相对表达明显高于正常对照组(P<0.05或P<0.01);健脾益肺Ⅱ号高剂量组和泼尼松组大鼠肺组织MMP-9、TIMP-1以及MMP-9/TIMP-1的相对表达明显低于模型组(P<0.05或P<0.01);模型组大鼠肺组织及血液中TNF-α、IL-8、TGF-β1含量均比正常对照组显著升高(P<0.01),各给药组经过药物的干预后,其含量明显降低(P<0.01或P<0.05)。[结论]健脾益肺Ⅱ号方可通过降低模型动物肺组织MMP-9/ TIMP-1相对表达量,下调血清中TGF-β1的水平,降低肺组织中TGF-β、TNF-α和IL-8的释放水平,减少肺组织反复的损伤与修复过程,从而起到减缓气道重构的作用。
健脾益肺Ⅱ号;基质金属蛋白酶;炎症因子;大鼠
慢性阻塞性肺疾病(COPD)是呼吸系统的常见病,与肺部对有害气体或有害颗粒的异常炎症反应有关。近年来研究表明,基质金属蛋白酶(MMP)参与肺组织细胞外基质破坏,在COPD的形成、发展、炎症持续方面起了重要作用,而蛋白酶/抗蛋白酶失衡是其主要发病因素[1]。健脾益肺Ⅱ号是本院的协定处方,前期临床试验表明,健脾益肺Ⅱ号可缓解患者临床症状,改善患者生存质量[2]。本实验通过研究观察健脾益肺Ⅱ号方对熏烟联合脂多糖LPS诱导的大鼠肺组织金属蛋白酶-9(MMP-9)和组织金属蛋白酶抑制因子-1(TIMP-1)以及转化生长因子β1(TGF-β1),肿瘤坏死因子(TNF-α)和白细胞介素-8(IL-8)表达的影响,以探讨健脾益肺Ⅱ号方对于肺组织损伤修复的影响,为健脾益肺Ⅱ号方防治COPD提供理论依据。
1 材料
1.1 实验动物 SPF级8周龄雄性SD大鼠60只,体质量180~220 g,由广东省医学实验动物中心提供,动物许可证号:SCXK(粤)2008-0002。
1.2 药物的配制 健脾益肺Ⅱ号方:由党参、白术、锁阳等组成(均购自康美药业、江中中药饮片有限公司,由广州中医药大学第二临床医学院中药制剂实验室鉴定),用回流提取法,经两次提取药液并收集挥发油,浓缩至相当于药液含生药2.25 g/mL,装入塑料瓶中,4℃保存备用。
1.3 实验药品和试剂 脂多糖(Sigma);泼尼松片(广东华南药业集团有限公司);大前门牌过滤嘴香烟(烟碱含量0.8 mg,焦油量11 mg/支,一氧化碳含量13 mg/支,上海烟草集团);MMP-9和TIMP-1试剂盒(武汉博士德);TGF-β1酶联免疫吸附法(ELISA)检测试剂盒(科润达生物);IL-8、TNF-α放免试剂盒(北京华埠力特生物)。
1.4 实验仪器 自制熏烟染毒箱:长×宽×高:60 cm×50 cm×50 cm;石蜡切片机:日本PIKA型;防脱玻片:博士德生物工程有限公司;L2000A型显微镜,广州光学仪器厂;PE-1420多功能微孔板分析仪。
1.5 COPD模型复制 大鼠适应性饲养3 d后,采用随机数字表法将60只大鼠随机分为4组,即:正常对照组、模型组、健脾益肺Ⅱ号高剂量组、健脾益肺Ⅱ号低剂量组、泼尼松组,每组各12只。采用熏烟加LPS气道滴注法制作大鼠COPD模型。正常对照组,在实验开始的第1天和第14天经大鼠气管内注入生理盐水0.2 mL/只;第2~13天、第15~30天每天用生理盐水10 mL/g灌胃。模型组于第1天和第14天经大鼠气管内注入LPS 0.2 mL(200 μg)的生理盐水溶液,气道注入当天不熏烟,第2~13天、15~30天将大鼠放入自制熏烟染毒箱中熏烟,每次给予8~10支香烟,熏烟30 min,每天2次,2次熏烟间隔时间大于4 h,熏烟完毕将动物放回原饲养笼中正常进食进水,每天上午熏烟前用生理盐水10 mL/kg灌胃。健脾益肺Ⅱ号组、泼尼松组的造模方法同模型组,于每天上午熏香烟前用健脾益肺Ⅱ号高、低剂量煎液、泼尼松10 mL/kg灌胃。给药剂量为22.5 g/kg、11.25 mg/kg、2.5 mg/kg,连续4周。
2 方法
2.1 MMP-9和TIMP-1的检测 每组随机取3只动物做免疫组化检测。均采用免疫组织化学过氧化酶标记的链霉菌抗生物素蛋白-过氧化物酶法(SP)测定,一抗为2∶100 MMP-9和TIMP-1多克隆抗体,二抗为生物素山羊抗兔IgG,阴性对照标本用磷酸盐缓冲液(PBS)代替一抗进行染色。采用Image-Pro Plus5.1软件对MMP-9和TIMP-1表达进行图像分析,阳性反应为胞浆中出现棕褐色颗粒为阳性表达,每张切片随机选取5个完整而不重叠的高倍镜视野(×400),测定每个视野下阳性反应的阳性反应面积和所有细胞总面积,计算阳性面积率,表达强度用阳性面积率表示。
2.2 血清TGF-β1水平的检测 实验动物眼球取血,放在室温静置8 h,待红细胞与血清分离,取上层淡黄色血清,置于-80℃冰箱待测。TGF-β1的具体检测方法根据ELISA试剂盒说明书操作。
2.3 肺组织TGF-β1,IL-8,TNF-α的检测 取400mg肺组织,加入生理盐水2 mL,用组织匀浆器充分研磨,4 000 r/min离心20 min,取上清存放-80℃冰箱备用。采用ELISA法检测TGF-β1的含量,采用放射免疫分析法测量各组动物肺组织匀浆液中TNF-α、IL-8含量的变化,严格按试剂盒说明书要求并由专人进行操作,所有样品1次完成实验。
2.4 统计方法 实验数据采用SPSS18.0统计软件处理,所有数据均采用均数±标准差(±s)表示,组间比较采用方差分析,进一步两两比较,采用LSD检验,若方差不齐,则采用Dunnet t3检验,以P<0.05为有统计学意义。
3 结果
3.1 各组动物的一般状态观察 正常对照组大鼠实验前后无明显气促,饮食正常,体质量增长较快。模型组大鼠随实验进行饮食减少,体质量增长较慢,喘促和呼吸困难逐渐出现,并出现精神萎靡,少活动,咳嗽、口鼻分泌物增多,皮毛无光泽且脱毛。而各用药组大鼠随着药物的应用,以上各种症状程度呈现较轻。
3.2 MMP-9和TIMP-1表达 模型组大鼠肺组织MMP-9、TIMP-1以及MMP-9/TIMP-1的相对表达明显高于正常对照组(P<0.05或P<0.01)。健脾益肺Ⅱ号高剂量组和泼尼松组大鼠肺组织MMP-9、TIMP-1以及MMP-9/TIMP-1的相对表达明显低于模型组(P<0.05或P<0.01),见表1、图1-2。
表1 各组动物肺组织MMP-9、TIMP-1表达阳性面积率比较(±s) %
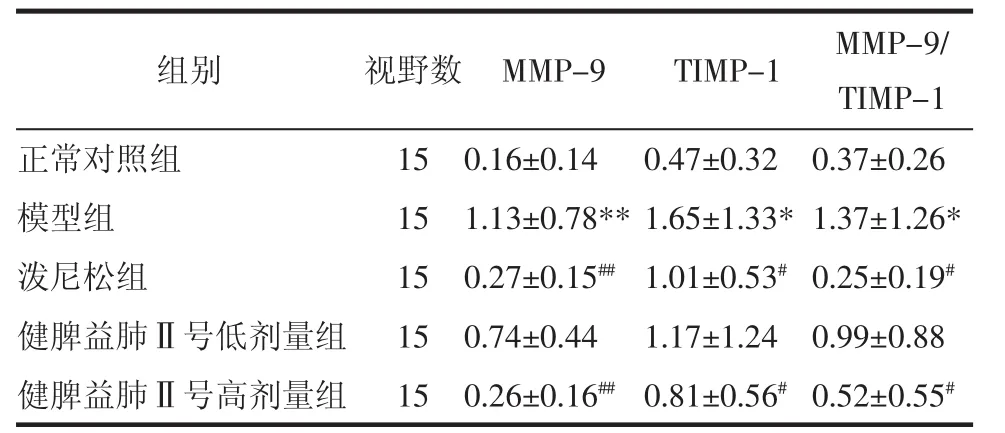
表1 各组动物肺组织MMP-9、TIMP-1表达阳性面积率比较(±s) %
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01。
组别 视野数 MMP-9 TIMP-1 MMP-9/ TIMP-1正常对照组 15 0.16±0.14 0.47±0.32 0.37±0.26模型组 15 1.13±0.78**1.65±1.33*1.37±1.26*泼尼松组 15 0.27±0.15##1.01±0.53#0.25±0.19#健脾益肺Ⅱ号低剂量组 15 0.74±0.44 1.17±1.24 0.99±0.88健脾益肺Ⅱ号高剂量组 15 0.26±0.16##0.81±0.56#0.52±0.55#
3.3 血清和血浆中TGF-β1的水平检测 与正常对照组相比,模型组血清中TGF-β1水平较高(P<0.01);与模型组相比,泼尼松组和健脾益肺Ⅱ号低、高剂量组血清TGF-β1水平均明显降低(P<0.05)。各组肺组织中TGF-β1水平相比较,模型组TGF-β1水平较正常组明显升高(P<0.01),健脾益肺Ⅱ号组以及泼尼松组均可显著降低模型大鼠肺组织中TGF-β1水平(P<0.01)。见表2。

图2 各组大鼠肺组织TIMP-1表达比较(×400)
表2 TGF-β1水平的检测(±s)
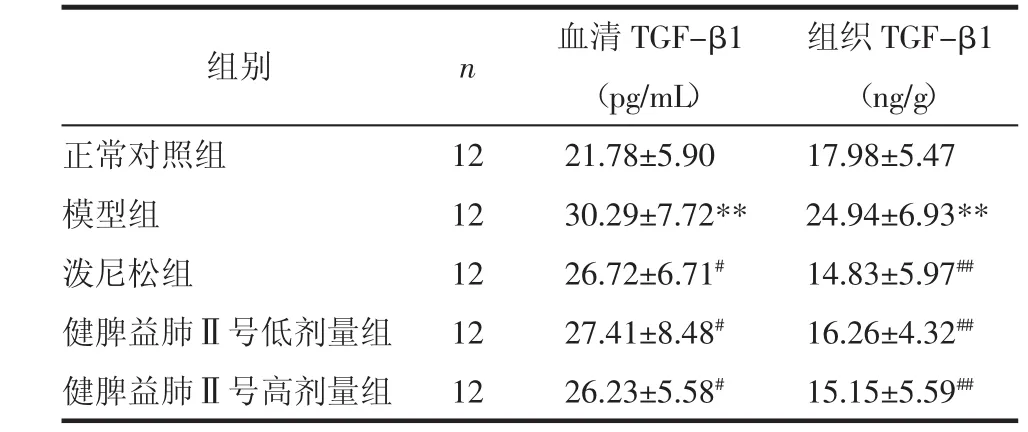
表2 TGF-β1水平的检测(±s)
注:与正常组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
组别 n 血清TGF-β1 组织TGF-β1(pg/mL) (ng/g)正常对照组 12 21.78±5.90 17.98±5.47模型组 12 30.29±7.72** 24.94±6.93**泼尼松组 12 26.72±6.71#14.83±5.97##健脾益肺Ⅱ号低剂量组 12 27.41±8.48#16.26±4.32##健脾益肺Ⅱ号高剂量组 12 26.23±5.58#15.15±5.59##
3.4 模型组大鼠肺组织匀浆液中的TNF-α、IL-8含量均比正常对照组显著升高(P<0.01)。各给药组经过药物的干预后,肺组织中的TNF-α、IL-8的含量明显降低(P<0.01)。见表3。
表3 各组动物肺组织匀浆液中细胞因子水平的比较(±s) ng/g

表3 各组动物肺组织匀浆液中细胞因子水平的比较(±s) ng/g
注:与正常组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
组别 n TNF-α IL-8正常对照组 12 14.02±2.13 1.30±0.19模型组 12 18.18±2.4** 1.74±0.23**泼尼松组 12 12.26±0.99##1.23±0.14#健脾益肺Ⅱ号低剂量组 12 13.21±2.27##1.28±0.11#健脾益肺Ⅱ号高剂量组 12 13.14±0.60##1.19±0.19#
4 讨论
MMP是近年来发现的一组由锌、钙离子依赖性,结构相似的基质降解蛋白酶组成的蛋白酶家族,具有降解细胞外基质(ECM)作用,MMP增多将导致蛋白酶过度水解,细胞外基质形成肺泡腔扩大,使肺组织失去弹力。金属蛋白酶组织抑制剂(TIMP)具有抑制MMP活性的功能。MMP的增多及MMP与TIMP之间的不平衡促进了炎症应答对肺组织的损伤。目前认为MMP-9和TIMP-1的动态平衡是反应气道及肺组织破坏与修复的标志[3-4]。有实验表明,COPD患者血清中MMP-9、TIMP-1浓度与第1秒用力呼气容积占肺活量百分比(FEV1/FVC%)呈明显负相关,而MMP-9/TIMP-1比率与FEV1占预计值百分比及FEV1/FVC%呈明显负相关[5]。
而TGF-β1是由单核细胞分泌的一种细胞因子,多项实验研究表明,TGF-β1与气道损伤修复的关系密切。肺气肿时肺组织中的TGF-β1呈高表达,并且TGF-β1表达增多可能抑制呼吸道平滑肌增殖和迁移功能[6]。Gao等[7]研究表明,TGF-β/smad通路与MMP-9共同参与肺气肿的发生,两者相互作用可导致蛋白的水解和组织的损伤、纤维化的产生。TNF-α和IL-8是COPD大鼠气道分泌的特征性炎症因子[8],TGF-β1可能介导了组织炎症反应[9],同时核转录因子-κB(NF-κB)也对TGF-β1信号通路及MMP9的表达构成影响[10]。
中医认为COPD的病理机制为肺、脾、肾3脏虚损,且兼有伏痰和瘀血。针对伏痰,培土生金法被认为是治疗COPD的重要法则之一[11]。而瘀血,现代研究认为与肺纤维化关系密切[12]。活血化瘀法在临床和动物实验中均已被证明具有减少肺纤维化的作用[13-14]。由于肺纤维化长于COPD并见[15],因此健脾益肺Ⅱ号以健脾益气中药为君臣药,佐以活血化瘀药物,以更好治疗COPD肺纤维化。本实验证明,健脾益肺Ⅱ号高剂量组可减少模型大鼠肺组织MMP-9、TIMP-1的表达,并且可明显降低MMP-9/ TIMP-1的相对表达量,同时健脾益肺Ⅱ号可降低模型动物血清或肺组织中TGF-β1、IL-8和TNF-α的水平,说明健脾益肺Ⅱ号通过以上机制改善ECM的降解和沉积失衡,减少肺纤维化的发生,减轻肺组织及呼吸道的损伤,使COPD的发展趋势得到延缓,从而发挥其健脾益气,化痰活血,固肾平喘之作用,这与临床研究证明该方对COPD稳定期有良好的治疗作用相符合,为健脾益肺Ⅱ号方的临床应用提供了充分的实验依据。
[1] Corbel M,Boichot E,Lagente V.Role of gelatinases MMP-2 and MMP-9 in tissue remodeling following acute lung injury[J].Braz J Med Biol Res,2000,33(7):749-754.
[2]吴 蕾,林 琳,许银姬,等.健脾益肺Ⅱ号治疗慢性阻塞性肺疾病稳定期178例临床研究[J].中医杂志,2011,52 (17):1465-1468.
[3] Tanaka H,Miyazaki N,Oashi K,et al.Sputum matrix metalloproteinase-9:tissue inhibitor of metalloproteinase-1 ratio in acute asthma[J].J Allergy Clin Immunol,2000,105 (5):900-905.
[4]高 想,唐艳芬,蒋凤荣.金荞麦水提物对COPD大鼠肺纤维化的影响[J].中国中医急症,2014(3):410-412.
[5] Wang TJ,Xie ZH,Zhao ZZ.Effects of shuxuening injection on the levels of serum matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in acute exacerbated chronic obstructive pulmonary disease patients[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2012,32(2):191-194.
[6] Chen M,Shi JT,Lv ZQ,et al.Triptolide inhibits TGF-beta1 induced proliferation and migration of rat airway smooth muscle cells by suppressing NF-kappaB but not ERK1/2[J].Immunology,2014,doi:10.1111/imm.12396.
[7] Gao C,Maeno T,Ota F,et al.Sensitivity of heterozygous alpha1,6-fucosyltransferase knock-out mice to cigarette smoke-induced emphysema:implication ofaberrant transforming growth factor-beta signaling and matrix metalloproteinase gene expression[J].J Biol Chem,2012, 287(20):6699-6708.
[8]张 葵,刘良丽,欧江琴,等.加减补肺汤对COPD肺气虚证模型大鼠支气管肺泡灌洗液TNF-α、IL-8的影响[J].天津中医药,2008,25(6):491-493.
[9] Gao J,Zhan B.The effects of Ang-1,IL-8 and TGF-beta1 on the pathogenesis of COPD[J].Mol Med Rep,2012,6(5): 1155-1159.
[10]Tobar N,Villar V,Santibanez J F.ROS-NFkappaB mediates TGF-beta1-induced expression of urokinase-type plasminogen activator,matrix metalloproteinase-9 and cell invasion[J].Mol Cell Biochem,2010,34(1):195-202.
[11]林旋龄,钟亮环,刘小虹.治喘之法,不只在于肺肾亦在于脾[J].天津中医药大学学报,2010,29(4):177-178.
[12]王立娟,贾新华,张心月.肺纤维化从瘀论治探析[J].天津中医药大学学报,2012,31(4):200-202.
[13]孙增涛,封继宏,李小娟,等.益气活血散结法对肺纤维化的干预效果及机制研究[J].天津中医药大学学报,2008, 25(3):209-212.
[14]孙昕,张玉环,李 莉,等.益气养阴活血化痰汤对肺纤维化大鼠干预作用的实验研究[J].天津中医药,2008,25 (3):236-238.
[15]吴小燕,卫小红.慢性阻塞性肺疾病合并肺纤维化的研究现状[J].医学综述,2006,21(10):635-638.
Influence of Jianpi Yifei II decoction on inflammatory cytokines and metalloproteases in lung tissues of rats induced by cigarette smoke and LPS
LIN Lin1,XU Yin-ji1,WU Lei1,CHEN Zhi-xi2,YU Xu-hua1
(1.The second Affliliated Hospital of Guangzhou University of Tradittonal Chinese Medicine,Guangzhou 510120, China;2.Guangzhou University of Chinese Medicine,Guangzhou 510405)
[Objective]To investigate the influence of Jianpi Yifei II on inflammatory cytokines and and metalloproteases in lung tissues of rats induced by cigarette smoke combined LPS and to provide theoretical basis to doctors for clinical application.[Methods]The rat model of lung injury was established by using intratracheal injection of LPS combining cigarette smoke.All rats were randomly divided into normal group,model group,Jianpi Yifei II low does group,Jianpi Yifei high does group and prednisone group.General condition of rats was observed and recorded first,then we detected the expression of MMP-9 and TIMP-1 and contents of TGF-β1,TNF-α and IL-8 in lung tissue homogenate or plasma by special assay kits.[Results]After inducing lung injury by treating rats with LPS and cigarette smoke,the general condition of rats in Jianpi Yifei II group and prednisone group was better than in model group.And the ratio of MMP-9/TIMP-1 was lower in the Jianpi Yifei Group and prednisone group than in model group(P<0.05 or P<0.01).In addition,compared to model group,the levels of TNF-α,IL-8 and TGF-β1 in lung tissues or plasma were significantly decreased in Jianpi Yifei II group and prednisone group(P<0.05 or P<0.01).[Conclusion]Jianpi Yifei II could protect lung tissue from the cigarette smoke and LPS by regulating levels of inflammatory cytokines and MMP-9/TIMP-1 ratio.
Jianpi Yifei II;metalloprotease;inflammatory cytokines;rat
R285.5
:A
:1673-9043(2014)06-0342-05
2014-08-14)
10.11656/j.issn.1673-9043.2014.06.07
国家自然科学基金(81373566);广东省科学技术厅—广东省中医药科学院联合科研专项(2011B03220 0007);广东省科技计划项目(2011B061300074);广东省科技厅(2012B031800192);广东省中医院朝阳人才专项(2014)。
林 琳(1965-),女,教授,博士生导师,研究方向为慢性阻塞性肺疾病、慢性咳嗽及呼吸道感染性疾病的中医、中西医结合研究工作。

