Aβ诱导炎症反应在阿尔茨海默病的研究进展*
张亚新,杜 欢
(天津中医药大学,天津 300193)
Aβ诱导炎症反应在阿尔茨海默病的研究进展*
张亚新,杜 欢
(天津中医药大学,天津 300193)
Aβ;小胶质细胞;血管内皮细胞;阿尔茨海默病
阿尔茨海默病(AD)最早是由一位德国医生AloisAlzheimer描述的,是一种发病隐匿的进行性发展性神经系统退行性疾病,临床表现为进行性认知功能障碍,包括记忆、智力、定向、判断能力、情感障碍和行为失常。病理学特征性改变有脑神经细胞外β样淀粉蛋白(Aβ)聚集形成的老年斑(SP)、神经细胞内tau蛋白的异常磷酸化导致的神经原纤维缠结(NFT)等[1]。目前,AD的发病机制尚不完全明确,主要有以下几种假说:Aβ沉积假说、自由基损害假说、神经炎症机制假说[2]等。现将近年来关于Aβ诱导的AD炎症机制进行综述。
1 小胶质细胞的激活
1.1 小胶质细胞与Aβ的相互作用 小胶质细胞属于脑内单核-巨噬细胞系统,正常情况下处于静息状态。在受到某种刺激后激活,具有吞噬功能并释放炎症因子。研究表明[3],大量的Aβ沉积可以与小胶质细胞膜上的受体结合,激活小胶质细胞,使小胶质细胞分泌大量的炎症因子,诱导炎症反应的发生。也有研究证实[4],Aβ25-35能提高小胶质细胞一氧化氮合酶mRNA的水平,进一步催化一氧化氮(NO)的产生,大量的NO通过多种途径导致神经元凋亡。脑内激活的小胶质细胞虽然不能发挥其吞噬作用,吞噬沉积的Aβ[3],但发现骨髓来源的小胶质细胞能够吞噬由Aβ沉积形成的SP[5-6]。这些研究提示,AD患者脑内的小胶质细胞不能发挥正常的免疫作用,而是加重Aβ诱导的炎症反应。
1.2 炎症因子的释放 AD患者中小胶质细胞过度激活释放大量炎症因子,如:白细胞介素-1(IL-1)、白细胞介素6(IL-6)、白细胞介素8(IL-8)、肿瘤坏死因子-α(TNF-α)、转化生长因子β(TGF-β)等[7]。
IL-1主要是由小胶质细胞活化产生的,包括IL-1α和IL-1β两个亚型。其中IL-1β与AD的关系较为密切,具体作用有:1)促进淀粉样前体蛋白(APP)的表达和Aβ的沉积。2)诱导α-2巨球蛋白酶抑制剂的分泌,抑制APP的酶解功能,加重Aβ沉积。3)激活胶质细胞,增加IL-6、TNF-α、载脂蛋白E(Apo-E)等的表达,诱导一氧化氮合成酶的生成,导致细胞凋亡。其中,Apo-E与Aβ具有较高的亲和力,参与老年斑形成,IL-1β的转换酶还能间接增加IL-1表达水平加速神经元DNA的凋亡[8]。另外,IL-6是一种多功能的细胞因子,其生物活性通过受体IL-6R介导,目前,已有研究证实其参与AD患者脑内炎症病变和SP形成。它在AD中的作用主要为:1)促进APP的表达。2)诱导α-2巨球蛋白的表达。3)诱导神经元的丢失和凋亡[9]。
关于TNF-α,目前,已有文献证实AD患者脑脊液和外周血中TNF-α的表达明显增高,且SP周围存在大量的TNF-α。这些说明了TNF-α与AD存在着密切的关系,主要表现为:1)TNF-α提高谷氨酰胺酶的表达和大量的释放,直接产生神经毒作用[10]。2)诱导花生四烯酸代谢产物的释放、氧自由基等产生,导致细胞损伤[11]。3)激活caspases家族,引起caspase级联反应,造成神经细胞的凋亡[12]。4)诱导小胶质细胞合成集落因子,进一步扩大炎症反应[13]。5)与IL-β一起诱导其他细胞因子产生[14]。
TGF-β一方面,TGF-β能够提高神经元的存活能力,并有营养神经的作用[13,15]。研究发现,TGF-β1能够降低Aβ和其在脑内的整体浓度,即TGF-β1起神经保护作用[16]。另一方面,TGF-β1过表达能够激活小胶质细胞,增加APP的表达,并促进Aβ在血管壁的沉积,诱导细胞凋亡。目前,TGF-β基因多样性的研究结果表明TGF-β基因多样性与AD关系密切。也有研究显示,小胶质细胞还可以诱导生长因子、趋化因子、巨噬细胞炎性蛋白等合成及释放,参与AD神经性炎症反应。
2 血管内皮细胞的参与
2.1 介导Aβ转运 血管内皮细胞上的晚期糖基化终产物受体(RAGE)和低密度脂蛋白受体相关蛋白-1(LRP-1)参与脑内外Aβ的转运。RAGE是一种多功能膜蛋白受体,属于免疫球蛋白超家族[17]。RAGE的V型免役蛋白区与胞外Aβ结合,使Aβ透过血脑屏障在脑中大量积聚,继而激活小胶质细胞[18-19],介导炎症损伤的发生。位于血管内皮细胞外侧的LRP-1属于低密度脂蛋白受体家族,它能够直接与Aβ结合,将其转运出脑。另有研究证明[20]LRP-1亦能够促进Aβ的生成。
2.2 激活炎症通路 研究发现血管内皮细胞分泌的炎症因子通过激活下游信号通路,参与AD神经性炎症反应。如趋化因子受体5(CCR5)在AD脑微血管内皮细胞的表达上调,并且过表达的CCR5和巨噬细胞炎症蛋1α(MIP-1α)相互作用,使T淋巴细胞通过脑微血管内皮细胞单层分子的能力增加,促进脑内炎细胞的浸润,加重炎症反应[21-22]。类似的研究结果,内皮细胞上基质金属蛋白酶-2(MMP-2)、血管细胞黏附因子-1(VCAM-1)及内皮素-1(ET-1)都参与了AD炎症信号通路的激活[23]。
3 血管内皮细胞与小胶质细胞的相互影响
首先,小胶质细胞与血管内皮细胞均能够产生炎症因子,激活炎症信号通路,诱导Aβ沉积[24-25]。其次,Aβ可以激活小胶质细胞释放炎症因子,其中炎症因子TNF-α可以增加血脑屏障(BBB)的通透性,进而影响内皮细胞,造成血管内皮细胞功能紊乱,形成恶性循环。总之,血管内皮细胞、小胶质细胞与Aβ,它们共同构成了AD神经性炎症机制复杂的网络体系,影响AD的发生、发展,见图1。
4 中医药对AD的防治
根据文献记载,AD在中医属于痴呆、善忘、郁证等疾病范围。老年人肾精虚衰,脑髓失养[26];脾气虚弱,升化失司,导致痰邪闭阻;肝气郁滞,失于疏泄,以致脑髓失荣。即是由于精气虚弱或内有气滞血瘀,外有痰邪瘀滞,或火热邪毒干扰神智闭阻清窍等原因引起。现在临床上采用补益精髓活血祛瘀、化痰开窍等方法进行治疗,如补元聪脑汤、精致清开灵等取得了一定的临床效果[27-29]。也有研究证实中药单体的活性成分能够降低脑内Aβ的水平[30-31]。但是,中药复方和单体的治疗效果哪种更好,复方中起防治AD作用的有效单体具体药效机制及作用靶点等问题还有待研究。
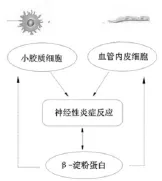
图1
综上,Aβ诱导的炎症反应是AD发生的重要机制。一方面血管内皮细胞参与AD炎症反应,另一方面小胶质细胞的激活进一步加重炎症反应的发生。因此,保护血管内皮细胞,抑制小胶质细胞的激活,维持脑微环境的功能稳态可能是研究AD的新方向,也是防治AD炎症反应的关键环节,尤其是中药在治疗AD中取得的疗效不可忽略,有待进一步深入探讨。
[1] Mohandas E,Rajmohhan V,Raghunath B.Neurobiology of Alzheimer’s disease[J].Journal of Psychiatry,2009,51(1):55-61.
[2] Chen Xi,Walker DG,Schmidt AM,et al.RAGE:a potential target for Aβ-mediated cellular perturbation in Alzheimer’s disease[J].Current Molecular Medicine,2007(7):735-742.
[3] Pan Xiaodong,Zhu Yuan-gu,Lin Nan,et al.Microglial phagocytosis induced by fibrillar beta-amyloid is attenuated by oligomeric beta-amyloid:implications for Alzheimer's disease[J].Molecular Neurodegeeneration,2011(6):45.
[4] Law A,Gauthier S,Quirion S.Say NO to Alzheimer’s disease.the putative links between nitric oxide and dementia of the Alzheimer’s type[J].Brain Res Brain Res Rev, 2001,35(1):73.
[5] Lee Jong Kil,Schuchman Edward H,Jin Hee Kyung,et al.SolubleCCL5 Derived from Bone Marrow-DerivedMesenchymal Stem Cells and Activated by Amyloid beta Ameliorates Alzheimer’s Disease in Mice by Recruiting Bone Marrow-Induced Microglia Immune Responses[J].Stem Cells,2012,30(7):1544-1555.
[6] Lampron Antoine,Pimentel-Coelho Pedro M,Rivest Serge, et al.Migration of Bone Marrow-Derived Cells Into the Central Nervous System in Models of Neurodegeneration[J].Journal of Comparative Neurology,2013,521(17):3863-3876.
[7] Weisman D,Hakimian E,Ho GJ,et al.Interleukins,Inflammation,and Mechanisms of Alzheimer’s Disease[J].Vitam Horm,2006(74):505-530.
[8] Francois Arnaud,Terro Faraj,Janet Thierry,et al.Involvement of interleukin-1 beta in the autophagic process of microglia:relevance to Alzheimer’s disease[J].Journal of Neuroinflammation,2013(10):151.
[9] Androsova LV,Mikhailova NM,Zozulya SA,et al.Inflammatory markers in Alzheimer’s disease and vascular dementia[J].Zhurnal Nevrologii I Psikhiatrii Imeni S S Korsakova, 2014,113(2):49-53.
[10]Takeuhi H,Jin S,Wang J,et al.Tumor necrosis factor-alpha induces neurotoxicity via glutamate release from hemichannels of activated microglia in an autocrine manner[J].J Biol Chem,2006,281(30):21362-21368.
[11]McAlpine Fiona E,Lee Jae-Kyung,Harms Ashley S,et al.Inhibition of soluble TNF signaling in a mouse model of Alzheimer’sdiseasepreventspre-plaque amyloidassociated neuropathology[J].Neurobiology of Disease,2009, 34(1):163-177.
[12]Laws SM,Perneczky R,Wagenpfeil S,et al.TNF polymorphisms in Alzheimer disease and functional implications on CSF beta-amyloid levels[J].Hum Mutat,2005,26(1):29-35.
[13]郭艳芹,李校堃.TGF-β与老年性痴呆[J].中国临床医学杂志,2005,6(4):50-52.
[14]Angelopoulos P,Aqouridaki H,Vaiopoulos H,et al.Cytokines in Alzheimer’s disease and vascular dementia[J].Int J Neurosci, 2008,118(12):1659-1672.
[15]李小松.转化生长因子β在老年性痴呆中的作用和意义[J].现代诊断与治疗,2004,15(2):110-113.
[16]Brionne TC,Tesseur I,Masliah E,et al.Loss of TGF-β1 leads to increased neuronal cell death and microgliosis in mouse brain[J].Neuron 2003,40(6):1133-1145.
[17]杜 欢,郭茂娟,姜希娟,等.RAGE与阿尔茨海默病关系的研究进展[J].现代生物医学进展,2014,14(14):2773-2775.
[18]Deane R,Wu Z,Zlokvic BV.RAGE(yin versus)LRP(yang) balance regulates Alzheimer amliod β-peptide clearance through transport across the blood-brain barrier[J].Stoke, 2004,35(Supp11):2628-2631.
[19]Chen X,Walker DG,Schmidt AM,et al.RAGE:a potential target for Aβ-mediated cellular perturbation in Alzheimer’s disease[J].Curr Mol Med,2007,7(8):735-742.
[20]刘 宏,邢安凤,刘国贞,等.晚期糖基终化物受体和低密度脂蛋白受体在慢性脑血流低灌注大鼠皮层和海马的改变[J].解剖学报,2009,40(2):204-210.
[21]Cam JA,Zerbinatti CV,Knisely JM,et al.The low density lipoprotein receptor-related protein 1B retains betaamyloid precursor protein at the cell surface and reduces amyloid-beta peptide production[J].Biological Chemistry, 2004,279(28):29639-29646.
[22]Man Li,De-Shu Shang,Wei-Dong Zhao,et al.Amyloid Interaction with Receptor for Advanced Glycation End Products Up-Regulates Brain Endothelial CCR5 Expression and Promotes T Cells Crossing the Blood-Brain Barrier[J].The Journal of Immunology,2009,18(2):5778-5788.
[23]Huan Du,Pengtao Li,Jun Wang,et al.The interaction of Amyloid β and the receptor foradvanced glycation endproducts induces Matrix Metalloproteinase-2 expression in brain endothelial cells[J].Cell Mol Neurobiol,2012,32(2): 141-147.
[24]Mun-Bryce S,Lukes A,Wallace J,et al.Stromelysin-1 and gelatinase A are upregulated before TNF-a in LPS-stimulated neuroin ammation[J].Brain Res,2002,33(9):42-49.
[25]Lorenzl S,Albers DS,LeWitt PA,et al.Tissue inhibitors of matrix metalloproteinases are elevated in cerebrospinal?uid of neurodegenerative disease[J].J Neurol Sci,2003,20(7): 71-76.
[26]王永炎.老年性痴呆辨治[J].中国医药学报,1994,9(2):49-51.
[27]陈 璐.补元聪脑汤治疗肾虚痰淤型老年痴呆的临床研究[D].沈阳:辽宁中医药大学,2011.
[28]张俊英.精制清开灵对阿尔茨海默病模型鼠旳治疗作用及机制研究[D].兰州:兰州大学,2013.
[29]杜 欢,高 青.通络救脑注射液对氧糖剥夺大鼠脑微血管内皮细胞胎盘生长因子表达的影响[J].天津中医药大学学报,2014,33(3):142-145.
[30]张 颖,林森相,华 茜,等.三七和栀子有效成分对AD转基因小鼠早期脑内淀粉样蛋白清除作用机制[J].中国药理学通报,2012,28(2):173-179.
[31]张福康,陆再华,杨研华.三七总皂苷对细胞免疫炎症因子作用的研究进展[J].中国药师,2011,14(9):1349-1350.
R592
:A
:1673-9043(2014)06-0378-03
2014-08-17)
10.11656/j.issn.1673-9043.2014.06.17
高等学校博士学科点专项科研基金(201312101 20004);天津市高等学校科技发展基金计划项目(20130213)。
张亚新(1990-),女,硕士研究生,研究方向为中医药防治脑病基础研究。
杜 欢,E-mail:duhuan0420@163.com。

