黄芪黄酮改善同型半胱氨酸诱导内皮功能紊乱的研究
余健 连苗军 何正飞 陈志云
黄芪黄酮改善同型半胱氨酸诱导内皮功能紊乱的研究
余健连苗军何正飞陈志云
【摘要】目的观察黄芪黄酮对同型半胱氨酸(Hcy)介导的内皮功能紊乱的作用,并进一步探讨其具体机制。 方法采用离体血管灌流技术,观察离体血管舒张功能变化;采用离体培养人脐静脉内皮细胞培养技术,测定内皮细胞产生的超氧阴离子和一氧化氮(NO)含量,以及一氧化氮合酶(NOS)和超氧化物歧化酶(SOD)活性。 结果Hcy(10-3mol/L)可显著抑制乙酰胆碱(Ach)介导的内皮依赖性血管舒张功能[舒张幅度为:(66.26±3.71)%],黄芪黄酮(10-2,10-1,1,10g/L)则呈浓度依赖性地改善Hcy(10-3mol/L)所致的内皮依赖性血管舒张功能损伤 [(66.71±7.29)%,(74.67±6.64)%,(81.73±5.92)%,(85.94±5.85)%,均P<0.01],其作用与SOD类似,而NOS抑制剂Nω-硝基左旋精氨酸甲酯盐酸盐(L-NAME)可以阻断黄芪黄酮的作用。进一步细胞实验证实Hcy显著抑制内皮细胞NO产生[(7.53±1.31)vs(16.61±1.52)×10-6mol/g,P<0.01],抑制NOS[(3.28±0.24)vs(8.35±0.37)kU/g,P<0.01]和SOD活性[(8.69±1.54)vs(14.74±1.57)kU/g,P<0.01]、以及诱导超氧阴离子的生成[(179.14±14.82)%vs(100.00±8.95)%,P<0.01];而黄芪黄酮(1g/L)和SOD均可逆转Hcy对内皮的损伤作用(均P<0.01)。 结论本研究证实黄芪黄酮通过其抗氧化作用改善同型半胱氨酸损伤的NOS-NO途径,从而具备血管内皮的保护功能。
【关键词 】黄芪黄酮同型半胱氨酸内皮功能
同型半胱氨酸(Hcy)是人类心血管疾病的独立危险因子。当机体内Hcy代谢所需的限速酶基因缺失和(或)辅因子缺乏常导致高Hcy血症的出现[1]。既往研究发现,人类和动物血管接触高浓度的Hcy后,可引起血管内皮功能损伤,主要表现为一氧化氮(NO)介导的内皮依赖性的血管舒张功能减弱[2]。研究显示,Hcy能激活促氧化酶(如还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶等),产生活性氧;后者既可以抑制NO的产生,又可以消耗已产生的NO[3]。新近研究发现,黄芪能够降低脂质过氧化,促进抗氧化酶合成,具有抑制氧自由基的作用[4]。黄芪黄酮(TFA)是最主要的黄芪活性成分,具有清除自由基、调节免疫、抗病毒、抑制血管内皮单层通透性增加等方面的药理作用[5]。本文旨在研究TFA对Hcy诱导的内皮功能损伤的保护作用,现报道如下。
1 材料和方法
1.1材料和试剂浙江大学医学院附属第一医院药剂科负责购买中药黄芪原料,并提取TFA,经鉴定TFA含量为85%,并配置成10g/L溶液备用。苯肾上腺素(PE)、乙酰胆碱(Ach)、Hcy、硝普化钠(SNP)、Nω-硝基左旋精氨酸甲酯盐酸盐(L-NAME),超氧化物歧化酶(SOD)均为美国Sigma公司产品。蛋白浓度测定试剂盒、NO检测试剂盒、NO合酶(NOS)活性检测试剂盒、SOD活性检测试剂盒及超氧化物阴离子检测试剂盒均购自南京建成生物工程研究所。
1.2方法
1.2.1血管环的制备由浙江省中医学院动物所提供雄性SD大鼠,体重230~260g。大鼠均由钝器击晕,迅速分离出胸主动脉,置于95%O2与5%CO2预饱和的4℃K-H液(NaCl 118 mM;KCl 4.7mM;MgSO4·7H2O 1.2mM;KH2PO41.2mM;CaCl22.5mM;NaHCO325mM;葡萄糖11mM)中。剔除血管周围结缔组织,剪成3~4mm的血管环。将血管环悬挂于预置10ml K-H液的浴槽内,持续充以95%O2和5%CO2的混合气体于37℃恒温,血管环加静息张力2g(由MedLab生物信号采集系统记录),平衡60min。用6×10-2mol/L的KCl重复刺激3次,以诱发血管的最大收缩幅度。待血管环稳定后,用10-6mol/L PE收缩血管环达峰值,加入10-5mol/L Ach检测血管内皮完整性。若加Ach后使PE预收缩的血管舒张在80%以上,认为内皮完整,用于进一步实验。
1.2.2人脐静脉内皮细胞培养参照文献[6]记录分离及培养人脐静脉内皮细胞。3~4代传代细胞用于实验研究。
1.2.3离体血管灌流实验各血管环以PE(10-6mol/L)刺激引起的最大收缩幅度为标准,标记为舒张幅度100%,而后分别记录血管环对Ach或SNP的舒张反应,所得数据用百分比表示。血管环实验分为Hcy组、TFA组、SOD组、SOD+TFA组、L-NAME组、L-NAME+ TFA组及对照组(每组8只)。对照组仅以K-H液预孵。Hcy组血管环先用K-H液内孵育30min,再用Hcy(0、10-5、10-4、10-3、10-2mol/L)孵育60min,而后用10-6mol/L PE收缩血管环,分别记录血管环对Ach(10-8~10-5mol/ L)或SNP(10-8~10-5mol/L)的舒张反应。其余各组则分别先予TFA(10-2、10-1、1、10g/L)、SOD(1、2kU/L),SOD(1kU/L)+TFA(1g/L),L-NAME(10-4mol/L),L-NAME(10-4mol/L)+TFA(1g/L)预孵30min,再加入Hcy(10-3mol/ L)继续孵育60min,后用10-6mol/L PE收缩血管环,记录血管环对Ach(10-8~10-5mol/L)的舒张反应。
1.2.4离体培养内皮细胞实验细胞实验分为Hcy组、TFA组、SOD组、SOD+TFA组及对照组(每组6只)。对照组仅以培养基液预孵。Hcy组内皮细胞先予培养液预孵30min,而后用Hcy(10-3mol/L)孵育60min;其余各组内皮细胞先予TFA(1g/L)、SOD(1.5kU/L)及SOD(1.5kU/L)+TFA(1g/L)预孵30min,而后予Hcy(10-3mol/ L)孵育60min。经上述处理后,分别收集上清液及细胞。分别依据试剂盒说明测定NO含量、NOS和SOD活性及过氧化物阴离子。
1.3统计学处理采用SPSS 13.0统计软件,计量资料以表示,用Homogeneity-of-variance作方差齐性检验,组间比较采用方差分析及t检验。
2 结果
2.1离体血管实验结果见表1~3。
由表1~3可见,Hcy(10-5、10-4、10-3、10-2mol/L)可显著抑制Ach(1.0×10-5mol/L)介导的内皮依赖性血管舒张幅度(均P<0.01)。经TFA(10-1、1、10g/L)孵育后,可浓度依赖性地改善Hcy(10-3mol/L)所致的内皮依赖性血管舒张幅度(均P<0.01)。采用SOD(1、2kU/ L)预孵后,也能使Hcy(10-3mol/L)损伤内皮依赖性血管舒张幅度有所恢复(均P<0.01)。进而,用SOD(1kU/L)与TFA(1g/L)共同预孵血管后,发现其改善血管舒张幅度效果较其单独预孵更为明显(P<0.01)。此外,由于L-NAME(10-4mol/L)的存在,TFA(1g/L)对Hcy所致的内皮依赖性血管舒张幅度无改善作用(均P>0.05)。
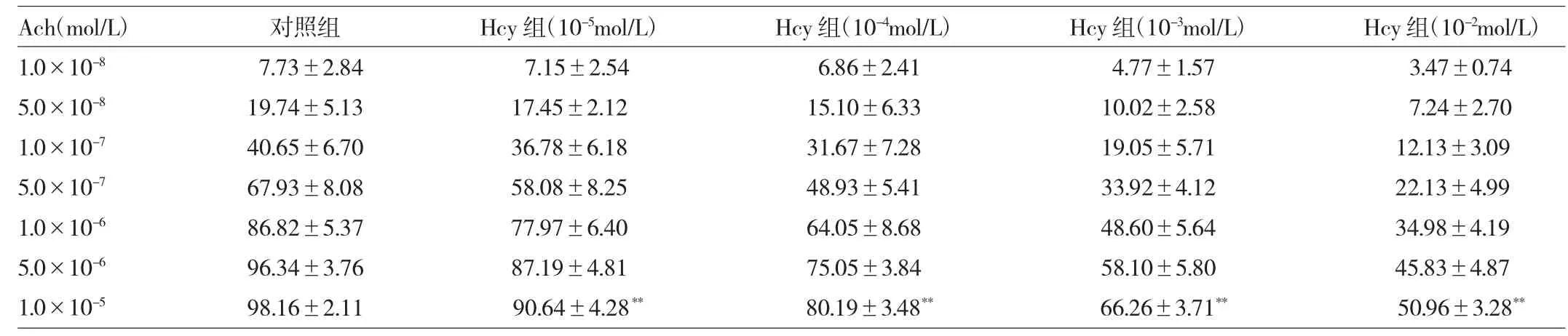
表1 Hcy对Ach介导的内皮依赖性血管舒张幅度的影响(%)
2.2离体培养内皮细胞实验结果见表4。
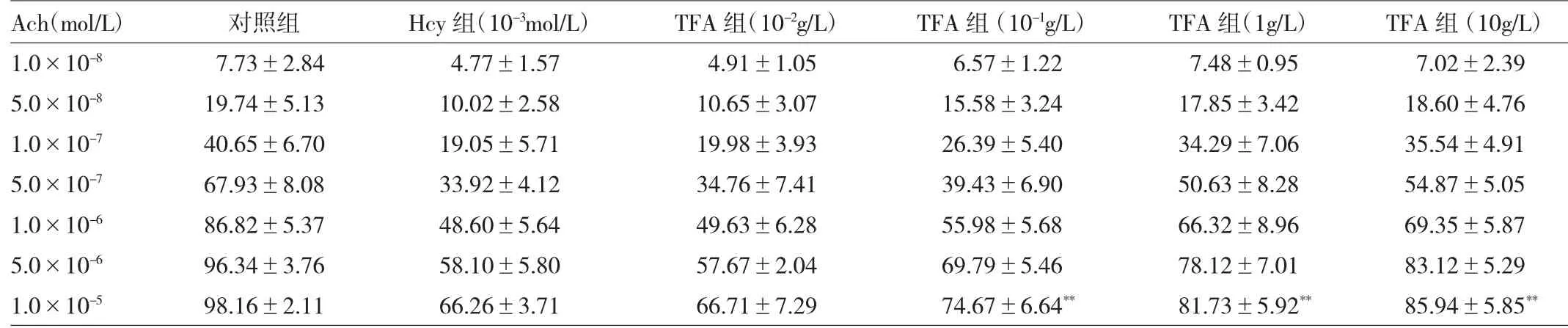
表2 TFA对Hcy诱导的内皮依赖性血管舒张幅度的影响(%)
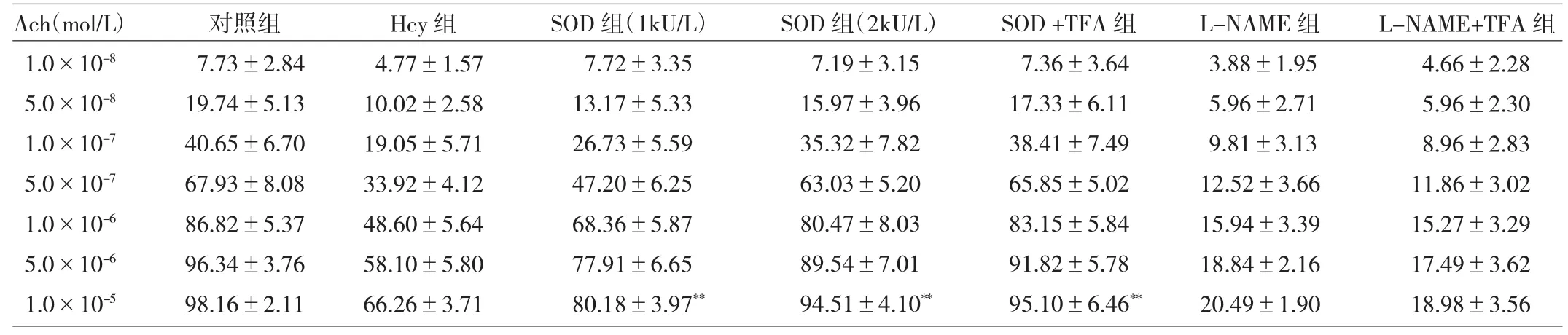
表3 TFA、SOD以及L-NAME对Hcy诱导的内皮依赖性血管舒张幅度的影响(%)

表4 离体培养内皮细胞实验结果
由表4可见,Hcy组较对照组能显著抑制预孵的内皮细胞NO产生、降低NOS和SOD活性并诱导超氧阴离子的生成(均P<0.01)。TFA组则可以使超氧阴离子减少,使NOS及SOD活性恢复,从而使NO生成增加(均P<0.01),SOD组也可以观察到类似的效应。而TFA+SOD组对Hcy诱导的内皮细胞功能损伤的保护作用较TFA或SOD组更为显著(均P<0.01)。
3 讨论
本研究显示TFA可以改善Hcy诱导的内皮损伤。其机制可能与通过抗氧化作用改善NOS-NO途径有关。高Hcy血症是冠状动脉粥样硬化的独立危险因素。约40%的心脑血管及外周血管病变患者体内Hcy水平升高。越来越多的证据表明Hcy可以破坏血管内皮功能,进而使血管舒缩功能损伤,其具体机制为Hcy通过自身氧化作用产生各种氧自由基,这些产物对血管内皮细胞形态和功能产生破坏性影响;同时,Hcy可以使NOS受抑制,内皮依赖性血管舒张因子产生减少,生物活性下降,使内皮依赖性血管舒张作用受损[7]。
众所周知,Ach通过激活内皮细胞内钙离子依赖的NOS催化合成NO,而SNP则是外源性NO的前体物分解生成NO。NO弥散至内膜下的血管平滑肌,激活鸟苷环化酶,使平滑肌细胞内环磷酸鸟苷的浓度增加,从而导致血管平滑肌舒张。因此,内皮功能紊乱主要表现为内皮源性NO产生减少及活性降低。我们的实验证实Hcy可诱导Ach介导的血管舒张功能降低;而对SNP介导的血管舒张功能无影响。同时,Hcy还能抑制内皮细胞NOS活性及NO的合成,因此认为,Hcy对血管的作用靶点在内皮细胞而非平滑肌细胞,并且NOS-NO途径可能参与了Hcy的血管损伤作用。
此外,由于巯基的存在,Hcy在金属离子的介导下可发生自身氧化,产生羟自由基、过氧化氢等氧自由基,引起蛋白质损伤,酶、受体功能障碍,以及诱导产生应激蛋白,清除氧自由基的酶活性降低。本研究也发现Hcy能显著增加培养的内皮细胞内超氧阴离子含量,并抑制SOD活性。既往研究认为,超氧自由基清除因子——SOD是有效的血管保护剂,它对损伤的主动脉、肺动脉、骨骼肌动脉等均有保护作用[8],本研究中采用抗氧化物酶SOD也显著逆转了Hcy诱导的血管功能损伤。
近年来,具有抗氧化作用的植物类药物引起了众多的关注。传统中药黄芪因具有抗氧化活性,迄今已被广泛应用于防止各种病理状态下氧自由基介导损伤。体外研究证实,黄芪通过二甲基亚砜系统能抑制活性氧族产生,清除率超过90%;而且黄芪抗氧化活性还能显著改善胰腺β细胞功能;有效地抑制牛的肝、肾匀浆自发性或H2O2诱发的脂质过氧化作用[9]。药理研究证实中药黄芪是一复合物,其成分主要含有TFA、皂甙及多糖等。多种研究证实TFA具有很强的抗氧化作用:它可以直接超氧阴离子、羟自由基、脂质过氧化物等活性氧自由基;抑制细胞膜、DNA等的氧化损伤;防止心肌缺血再灌注后自由基形成[10]。我们的研究显示,TFA可以改善Hcy诱导的内皮依赖性舒张功能紊乱,该作用可以被NOS抑制剂——L-NAME所阻断。同时,体外培养内皮细胞研究发现TFA也能使经Hcy预孵的内皮细胞合成NO含量增加及NOS酶活性增高。进而,我们通过TFA处理Hcy孵育的内皮细胞,还能使SOD活性增加,而氧自由基合成减少,后者效果类似于SOD的作用。
总之,本研究证实TFA通过其抗氧化作用改善Hcy损伤的NOS-NO途径,从而具备血管内皮的保护功能。这一结果为高Hcy血症患者病变血管的治疗提供了全新的方案。
4 参考文献
[1]Jakubowski H,Perla-Kajan J,Finnell R H,et al.Genetic or nutritional disorders in homocysteine or folate metabolism increase proteinN-homocysteinylationinmice[J].FASEBJ,2009,23(6):1721-1727.
[2]Cheng Z,Yang X,Wang H.Hyperhomocysteinemia and endothelialdysfunction[J].Curr Hypertens Rev,2009,5(12):158-165.
[3]Steed M M,Tyagi S C.Mechanisms of cardiovascular remodeling in hyperhomocysteinemia[J].Antioxid Redox Signal,2011,15(7): 1927-1943.
[4]邱立红,袁俏梅,韩阳.黄芪对同型半胱氨酸诱导的大鼠胸主动脉张力损伤的保护作用[J].浙江医学,2006,28(7):545-547.
[5]梁连生,余静.黄芪中黄酮化合物的药理作用[J].中西医结合心脑血管病杂志,2005,3(12):1085-1087.
[6]Ikemoto K,Matsumoto T,Ohtsuki M,et al.2,4-diamino-6-hydroxypyrimidine(DAHP)suppresses cytokine-induced VCAM-1 expression on the cellsurface of human umbilical vein endothelial cells in a BH(4)-independent manner[J].Biochim Biophys Acta, 2008,1780(7-8):960-965.
[7]Cheng Z,Jiang X,Kruger W D,et al.Hyperhomocysteinemia impairs endothelium-derived hyperpolarizing factor-mediated vasorelaxation in transgenic cystathionine beta synthase-deficient mice[J].Blood,2011,118(7):1998-2006.
[8]FukaiT,Ushio-FukaiM.Superoxide dismutases:role in redox signaling,vascular function,and diseases[J].Antioxid Redox Signal, 2011,15(6):1583-1606.
[9]丁瑞恒,廖蕴华.黄芪的抗氧化研究[J].中医杂志,2010,51(suppl1): 234-236.
[10]杨映雪,陈建业,王亚平.黄芪总黄酮的抗氧化作用[J].川北医学院学报,2007,22(6):606-608.
(本文编辑:马雯娜)
《浙江医学》对作者署名的一般要求
同时具备以下3项条件者方可署名为作者:(1)参与选题和设计或资料的分析与解释者;(2)起草或修改论文中关键性理论或其他主要内容者;(3)能对编辑部的修改意见进行核修,在学术界进行答辩,并最终同意该文发表者。仅参与研究项目资金的获得或收集资料者不能列为作者,仅对科研小组进行一般管理者也不宜列为作者。对文章中的各主要结论,均必须至少有1位作者负责。作者中如有外籍作者,应征得其同意,并在投稿时向编辑部提供相应证明材料。集体署名的文稿,在题名下列出署名单位,于文末列出整理者姓名,并须明确该文的主要负责人,在论文首页脚注通信作者姓名、单位、邮政编码及E-mail地址。通信作者一般只列1位,由投稿者确定。如需注明协作组成员,则于文末参考文献前列出协作组成员的单位及姓名。作者的具体排序应在投稿前即确定,在编排过程中不应再改动,确需改动时必须出示单位证明。
本刊编辑部
收稿日期:(2013-03-22)
作者单位:310003杭州,浙江大学医学院附属第一医院心内科(余健、连苗军,余健系富阳市人民医院进修医师);富阳市人民医院心内科(何正飞、陈志云)
Astragalus flavonoids attenuates endothelial dysfunction induced by homocysteine
YU Jian,LIAN Miaojun,HE Zhengfei,et al.Department of Cardiology,the First Affiliated Hospital of Zhejiang University School of Medicine,Hangzhou 310006,China
【 Abstract】 ObjectiveTo investigate the effect of Astragalus flavonoids on endothelial dysfunction induced by homocysteine(Hcy)and the underlying mechanism.MethodsThe vasorelaxation response of aortic ring of rats was determined by isometric tension recordings.The levels of reactive oxygen species and nitric oxide and the activities of nitric oxide synthase and superoxide dismutase in human umbilical vein endothelial cells were measured.ResultsHcy significantly inhibited acetylcholine-induced endothelium-dependent relaxation.In a concentration-dependent manner,the treatment with Astragalus flavonoids showed the same effect as the superoxide dismutase on improving the endothelial function,which was blocked by Nω-nitro-L-arginine methyl ester hydrochloride.Moreover,in cultured human umbilical vein endothelial cells,homocysteine markedly reduced the levels of reactive oxygen species and nitric oxide,and inhibited the activities of nitric oxide synthase and superoxide dismutase,both of which were reversed completely by Astragalus flavonoids.ConclusionThese data support the view that Astragalus flavonoids can improve the endothelial dysfunction induced by injured nitric oxide-nitric oxide synthase pathway due to oxidative stress in hyperhomocysteinemia.
【Key words】Astragalus flavonoidsHomocysteineEndothelial function

