脑部照射对大鼠情绪和记忆的影响
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
脑部照射对大鼠情绪和记忆的影响
范兴文 贯士阔 吴开良
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:放射治疗是脑肿瘤的主要治疗方法之一,但会导致一定的神经毒性。为避免临床混杂因素的干扰,本研究采用大鼠放射性脑损伤模型探讨脑部照射对情绪和记忆的影响及其规律。方法:6~8周SD大鼠,用直线加速器进行脑部照射22 Gy制作放射性脑损伤模型。分别在脑部照射1、10个月后,用旷场实验和高架十字迷宫评价大鼠的活动度及焦虑情绪;用被动回避实验检测大鼠的情绪记忆;用新位置识别检测大鼠的空间记忆。结果:脑部照射1个月后,大鼠在旷场中的移动距离和进入中央区域的次数减少,在高架十字迷宫中的总探索次数和探索开放臂的探索比例降低,在被动回避实验中进入暗室的潜伏时间变短,在新位置识别实验中探索新位置的探索比例降低。脑部照射10个月后,大鼠在旷场和高架十字迷宫中的表现与对照组相比差异均无统计学意义(P>0.05),但在被动回避实验中进入暗室的潜伏时间,及在新位置识别实验中探索新位置的比例较对照组均降低。结论:脑部照射可导致大鼠活动度降低、恐惧记忆,并可导致空间记忆受损;脑部照射导致的情绪障碍可以恢复,但记忆损伤将长期存在。
放射性脑损伤;情绪;记忆
随着治疗技术的进展,肿瘤患者的存活期不断延长,肿瘤治疗导致的不良反应受到越来越广泛的关注。放射治疗是原发性和转移性脑肿瘤的主要治疗方法之一。有研究报道,接受全脑照射并存活超过半年的患者出现认知功能障碍的概率高达50%~90%[1]。此外,接受过脑部照射的患者还经常会出现情绪异常,如焦虑、抑郁[2]。脑部照射导致的神经功能异常严重影响患者的生活质量,研究其发病规律及机制有助于探索出有效的防治措施。但临床资料常包含大量的混杂因素,如化疗药物和疾病本身对情绪记忆的作用[3]。有资料显示,大鼠全脑照射22 Gy在1个月后会出现空间记忆损伤,可以较好的模拟临床照射剂量后的认知功能改变[4]。因此,本研究采用此照射剂量建立放射性脑损伤模型,并用4种行为学方法评价大鼠脑部照射后不同时间点的情绪和记忆能力,研究脑部照射对情绪和记忆的影响及其规律。
1 材料和方法
1.1 大鼠脑部照射
从复旦大学动物实验中心购置6~8周SD(Sprague Dawley,斯泼累格·多雷)大鼠,实验方案得到复旦大学动物伦理委员会批准。共入组40只大鼠,每组10只大鼠。氯胺酮(75 mg/kg)/甲苯噻嗪(15 mg/kg)腹腔注射复合麻醉后,将大鼠放入特制的固定盒中,使用6 M直线加速器(Primus Linear Accelerator,德国)进行脑部照射。剂量率为250 Mu/min,源皮距为100 cm,照射剂量为22 Gy(单次照射)。头皮覆盖1.0 cm厚的组织补偿胶体(Bolx),使剂量分布更均匀。使用特制挡铅保护眼睛、耳朵、颈部、身体,仅头部暴露在射线下。对照组同样接受麻醉处理,放入固定盒,但不接受脑部照射。
1.2 旷场实验
将大鼠放入旷场实验箱(40 cm×40 cm× 35 cm)正中央,关闭旷场实验箱门,以减少外界对其影响。允许大鼠在旷场实验箱内自由运动5 min,用视频追踪软件(Video-tracking Interface,美国)记录大鼠在旷场内的运动情况。将中央1/2区域定义为中央区域,用专业软件(Activity Monitor,美国)分析大鼠在旷场内的移动距离及进入中央区域的次数。每只大鼠间用酒精清洗,消除气味对其影响。
1.3 高架十字迷宫
将大鼠放入高架十字迷宫的中央区域,头朝向开放臂。允许大鼠在高架十字迷宫内自由运动5 min,用视频追踪软件(Video-tracking Interface,美国)记录大鼠在高架十字迷宫内的运动情况。用专业软件(Video Maze,美国)分析大鼠对开放臂和闭合臂的探索行为。探索行为定义为:大鼠身体在一侧臂或中央,鼻尖碰到另一侧臂边缘。探索开放臂的探索比例=探索开放臂次数/(探索开放臂+闭合臂次数)。每只大鼠间用酒精清洗,消除气味对其影响。
1.4 被动回避
被动回避实验使用MED-PC Ⅳ软件(美国)进行控制,分为训练阶段和测试阶段[5]。在训练阶段,将大鼠放入明室,30 s后将明暗室间的门打开。大鼠进入暗室后关门,5 s后给予足底电击。电击电流为0.8 mA,持续5 s。电击后拿出大鼠,放回笼中休息。24 h后,开始测试阶段。将大鼠放入明室,30 s后开门,记录大鼠进入暗室的时间。每只大鼠间用酒精清洗,消除气味对其影响。
1.5 新位置识别
新位置识别分为3个阶段:适应阶段、熟悉阶段、测试阶段[6]。在适应阶段,将大鼠放入特制的黑色开顶箱子(70 cm×70 cm×40 cm)正中央,允许其自由运动5 min,连续进行3 d,以消除大鼠在测试箱内的紧张焦虑情绪。在熟悉阶段,将两个物体(4 cm×5 cm×7 cm)放入测试箱内,大鼠放入测试箱内正中央,允许其对物体自由探索3 min。熟悉阶段之后,将大鼠放回饲养笼内,间隔5 min后,将大鼠放入测试盒正中央,开始测试阶段。开始测试阶段前,将其中1个物体移到新位置。用摄像机记录大鼠对新旧位置的探索行为。大鼠鼻尖触碰到物体定义为1次探索。对新位置的探索比例=探索新位置的次数/(探索新位置+旧位置的次数)。
1.6 统计学处理
用GraphPad Prism 5(美国)软件进行数据 处 理 , 各 组 数 据 以x±s 表 示 。 组 间 的 差 异采用非配对t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 脑部照射对大鼠情绪的影响
在对照射组大鼠脑部照射1个月之后,在旷场中的移动距离较对照组显著缩短(P=0.015 1,图1A),进入中央区域的次数显著减少(P=0.000 3,图1C);在高架十字迷宫中,照射组大鼠探索开放臂和闭合臂的总次数较对照组大鼠显著减少(P=0.005 9,图2A),探索开放臂与总探索次数间的探索比例亦显著减少(P=0.011 1,图2C)。
在对照射组大鼠脑部照射10个月之后,在旷场中的移动距离与对照组差异无统计学意义(P=0.940 7,图1B),进入中央区域的次数亦无显著区别(P=0.787 2,图1D);在高架十字迷宫中,照射组大鼠探索开放臂和闭合臂的总探索次数与对照组大鼠差异无统计学意义(P=0.133 2,图2B),探索开放臂与总探索次数间的探索比例差异亦无统计学意义(P=0.623 0,图2D)。
2.2 脑部照射对大鼠记忆的影响
在对照射组大鼠脑部照射1个月之后,在被动回避实验的测试阶段,大鼠进入暗室的潜伏时间较对照组显著缩短(P=0.031 1,图3A);在新位置识别实验的测试阶段,照射组大鼠探索新位置与总探索次数间的探索比例较对照组亦显著降低(P<0.000 1,图4A)。
在对照射组大鼠脑部照射10个月之后,在被动回避实验的测试阶段,大鼠进入暗室的潜伏时间较对照组显著变短(P=0.037 1,图3B);在新位置识别实验的测试阶段,照射组大鼠探索新位置与总探索次数间的探索比例较对照组亦显著降低(P=0.002 8,图4B)。
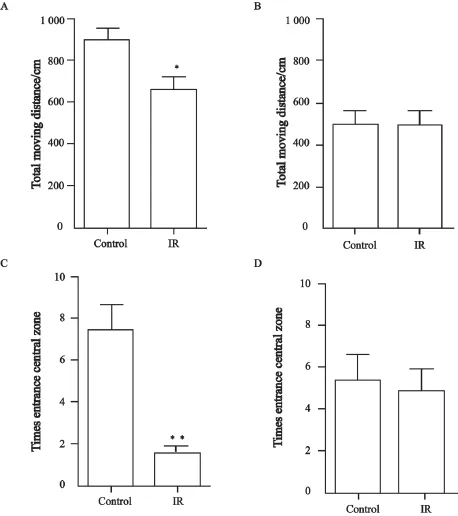
图 1 旷场实验检测脑部照射对大鼠情绪的影响Fig. 1 Brain irradiation affects the mood of rats detected by open- fi eld test

图 2 高架十字迷宫检测脑部照射对大鼠情绪的影响Fig. 2 Brain irradiation affects the mood of rats detected by elevated plus maze
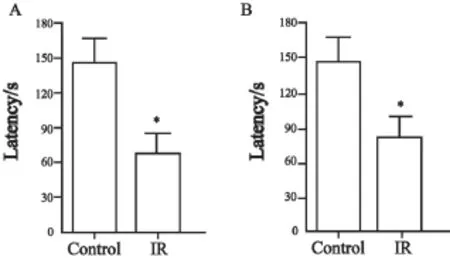
图 3 被动回避实验检测脑部照射对大鼠情绪记忆的影响Fig. 3 Brain irradiation affects the mood memory of rats detected by passive avoiding test
3 讨 论
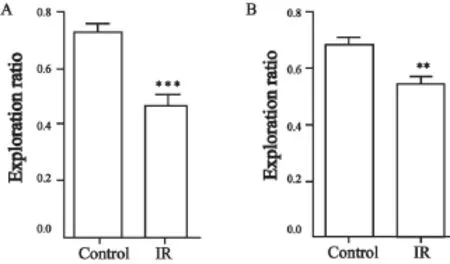
图 4 新位置识别实验检测脑部照射对大鼠空间记忆的影响Fig. 4 Brain irradiation affects the spatial memory of rats detected by novel place recognition test
旷场实验和高架十字迷宫是评价焦虑情绪的常用方法[7]。旷场实验中,中心区域对动物来说是潜在的威胁情境,而外周区则相对安全。如果大鼠的焦虑水平高则倾向于停留在外周区,进入中央区的次数减少。在高架十字迷宫中,由于开臂和外界相通,对大鼠来说具有一定的新奇性和威胁性,大鼠在产生探索好奇心的同时也会产生焦虑反应。如果焦虑程度高,则大鼠会退缩到闭臂中,对开臂的探索次数也减少。在旷场中的移动距离和在高架十字中的总探索次数可反应大鼠的活动度。
在对大鼠脑部照射1个月后,在旷场中的移动距离变短,表明大鼠的活动度降低。由于活动度和焦虑水平都会影响大鼠进入旷场中央区域的次数。因此,脑部接受照射1个月后,大鼠进入旷场中央区域次数减少的原因,无法确定是焦虑水平增加还是活动度降低。在高架十字迷宫中,大鼠对开放臂和闭合臂的总探索次数减少,也表明大鼠的活动度降低;开放臂探索次数与总探索次数间的比例可排除总探索次数的干扰,在对大鼠脑部进行照射后大鼠对开放臂的探索比例降低,表明大鼠的焦虑程度增高。脑部接受照射10个月后,在旷场实验和高架十字迷宫中照射组大鼠的各项指标均与对照组相比,差异无统计学意义,表明大鼠的焦虑情绪和活动度恢复正常。
在大鼠脑部接受照射1个月后活动度减少,可能与嗜睡综合征相关。脑部照射诱导的嗜睡综合征机制尚不清楚,有研究显示,可能与神经炎性反应有关[8]。嗜睡综合征具有自限性,不管是否使用类固醇都会在1~3个月内自行好转。本研究也观察到,在对脑部进行照射10个月后,大鼠的活动度恢复正常。临床实践中应注意不要将嗜睡综合征误认为病情恶化。
被动回避和新位置识别是评价大鼠记忆能力的常用方法[9]。大鼠喜欢黑暗,明室与暗室之间的门打开后,大鼠会迅速进入暗室。在被动回避训练阶段,当大鼠进入暗室后给予电击,对其造成惊恐;24 h后,记忆力好的大鼠从明室进入暗室的潜伏时间显著延长,记忆力差的大鼠仍较快进入明室。大鼠有探索新事物的天性,若大鼠空间记忆良好,对新位置的探索次数将显著多于旧位置。在对脑部照射1个月和10个月后,照射组大鼠在被动回避的测试阶段进入暗室的潜伏时间较对照组显著缩短,探索新位置的比例显著降低,表明大鼠的恐惧记忆和空间记忆长期受损。有文献报道,小鼠全脑接受6 Gy照射剂量后,对新物体的记忆完好,空间记忆损伤,但可在7周后恢复[10];但照射剂量增大到10 Gy后,空间记忆和对新物体的记忆都会出现损伤并长期存在[11],提示各种类型的记忆对射线的敏感性不同,并且较低剂量的照射诱导的记忆损伤可以部分恢复。
与情绪异常关系最密切的脑组织结构是边缘系统以及与其存在广泛联系的周围结构,如伏隔核、中脑腹测被盖区、丘脑、杏仁核、前额区及扣带回。大脑含两套记忆系统:前颞叶系统和后内侧系统,分别负责不同类型的记忆,其中海马在协调两套记忆系统中起重要作用[12]。海马在学习记忆和情绪调节中都起重要作用,基础研究也发现海马对射线较为敏感[13]。因此,部分放射生物学家认为海马是在对脑部照射后导致行为学改变的关键区域,并且产生在对脑部照射时降低海马照射剂量以保护记忆功能的设想[14-15]。但必须注意的是,脑功能环路上任何部位出现损伤均会导致神经功能障碍。剂量学研究发现,胼胝体、左侧额叶白质、右侧颞叶、双侧海马、脑室下区和小脑与放疗后的认知功能损伤有关[16]。海马神经发生减少[17]、突触密度降低[18]、脱髓鞘[19]、血脑屏障破坏[20]、毛细血管密度减低[21]可能与脑部照射后的功能改变有关。谷氨酸过度释放导致的神经兴奋性毒性[22]、神经炎性反应[11]及其导致的慢性氧应激[23],可能是机体受到伤害因素(射线照射)后损伤加重的重要机制。从组织、细胞、分子不同层次研究脑部照射导致情绪记忆障碍的机制,将有助于探索出放射性脑损伤的防治方法。
本研究发现,脑部照射可导致大鼠活动度降低、焦虑水平增加和恐惧记忆,并出现空间记忆受损;同时发现对脑部照射导致的情绪障碍可以恢复,但记忆损伤将长期存在。本研究将结果为深入探索脑部照射诱导情绪记忆异常的机制提供理论依据。
[参 考 文 献]
[1] GREENE-SCHLOESSER D, MOORE E, ROBBINS M E. Molecular pathways: radiation-induced cognitive impairment[J]. Clin Cancer Res, 2013, 19(9): 2294-2300.
[2] TANG Y, LUO D, RONG X, et al. Psychological disorders, cognitive dysfunction and quality of life in nasopharyngeal carcinoma patients with radiation-induced brain injury[J]. PLoS One, 2012, 7(6): e36529.
[3] CHRISTIE L A, ACHARYA M M, PARIHAR V K, et al. Impaired cognitive function and hippocampal neurogenesis following cancer chemotherapy[J]. Clin Cancer Res, 2012, 18(7): 1954-1965.
[4] LIU Y, XIAO S, LIU J, et al. An experimental study of acute radiation-induced cognitive dysfunction in a young rat model[J]. AJNR Am J Neuroradiol, 2010, 31(2): 383-387.
[5] OH S B, PARK H R, JANG Y J, et al. Baicalein attenuates impaired hippocampal neurogenesis and the neurocognitive deficits induced by gamma-ray radiation[J]. Br J Pharmacol, 2013, 168(2): 421-431.
[6] ACHARYA M M, CHRISTIE L A, LAN M L, et al. Human neural stem cell transplantation ameliorates radiation-induced cognitive dysfunction[J]. Cancer Res, 2011, 71(14): 4834-4845.
[7] SESTAKOVA N, PUZSEROVA A, KLUKNAVSKY M, et al. Determination of motor activity and anxiety-related behaviour in rodents: methodological aspects and role of nitric oxide[J]. Interdiscip Toxicol, 2013, 6(3): 126-135.
[8] BALLESTEROS-ZEBADUA P, CHAVARRIA A, CELIS M A, et al. Radiation-induced neuroinflammation and radiation somnolence syndrome[J]. CNS Neurol Disord Drug Targets, 2012, 11(7): 937-949.
[9] CHRISTIE L A, ACHARYA M M, LIMOLI C L. Quantifying cognitive decrements caused by cranial radiotherapy[J]. J Vis Exp, 2011(56): 3108.
[10] MADSEN T M, KRISTJANSEN P E, BOLWIG T G, et al. Arrested neuronal proliferation and impaired hippocampal function following fractionated brain irradiation in the adult rat[J]. Neuroscience, 2003, 119(3): 635-642.
[11] JENROW K A, BROWN S L, LAPANOWSKI K, et al. Selective inhibition of microglia-mediated neuroinflammation mitigates radiation-induced cognitive impairment[J]. Radiat Res, 2013, 179(5): 549-556.
[12] RANGANATH C, RITCHEY M. Two cortical systems for memory-guided behaviour[J]. Nat Rev Neurosci, 2012, 13(10): 713-726.
[13] PARIHAR V K, LIMOLI C L. Cranial irradiation compromises neuronal architecture in the hippocampus[J]. Proc Natl Acad Sci U S A, 2013, 110(31): 12822-12827.
[14] HARTH S, ABO-MADYAN Y, ZHENG L, et al. Estimation of intracranial failure risk following hippocampal-sparing whole brain radiotherapy[J]. Radiother Oncol, 2013, 109(1): 152-158.
[15] GHIA A, TOME W A, THOMAS S, et al. Distribution of brain metastases in relation to the hippocampus: implications for neurocognitive functional preservation[J]. Int J Radiat Oncol Biol Phys, 2007, 68(4): 971-977.
[16] PEIFFER A M, LEYRER C M, GREENE-SCHLOESSER D M, et al. Neuroanatomical target theory as a predictive model for radiation-induced cognitive decline[J]. Neurology, 2013, 80(8): 747-753.
[17] ZOU Y, CORNIOLA R, LEU D, et al. Extracellular superoxide dismutase is important for hippocampal neurogenesis and preservation of cognitive functions after irradiation[J]. Proc Natl Acad Sci U S A, 2012, 109(52): 21522-21527.
[18] CORNIOLA R, ZOU Y, LEU D, et al. Paradoxical relationship between Mn superoxide dismutase deficiency and radiationinduced cognitive defects[J]. PLoS One, 2012, 7(11): e49367.
[19] ROUGHTON K, BOSTROM M, KALM M, et al. Irradiation to the young mouse brain impaired white matter growth more in females than in males[J]. Cell Death Dis, 2013, 4(31): e897.
[20] CAO Y, TSIEN C I, SUNDGREN P C, et al. Dynamic contrast-enhanced magnetic resonance imaging as a biomarker for prediction of radiation-induced neurocognitive dysfunction[J]. Clin Cancer Res, 2009, 15(5): 1747-1754.
[21] WARRINGTON J P, CSISZAR A, MITSCHELEN M, et al. Whole brain radiation-induced impairments in learning and memory are time-sensitive and reversible by systemic hypoxia[J]. PLoS One, 2012, 7(1): e30444.
[22] ALAOUI F, PRATT J, TROCHERIE S, et al. Acute effects of irradiation on the rat brain: protection by glutamate blockade[J]. Eur J Pharmacol, 1995, 276(1-2): 55-60.
[23] COLLINS-UNDERWOOD J R, ZHAO W, SHARPE J G, et al. NADPH oxidase mediates radiation-induced oxidative stress in rat brain microvascular endothelial cells[J]. Free Radic Biol Med, 2008, 45(6): 929-938.
The effect of brain irradiation on mood and memory for rats
FAN Xing-wen, GUAN Shi-kuo, WU Kai-liang (Deptment of Radiation Oncology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
WU Kai-liang E-mail: wukailiang@aliyun.com
Background and purpose: Radiotherapy is one of the main treatment methods for brain tumor patients, but neurotoxicity was observed frequently. Because of the confounding factors in clinical data, it’s hard to summarize the characteristic of neurological changes after brain irradiation. This study used the brain irradiation injury model of rats to test whether brain irradiation change the mood and memory. Methods: Whole brain of SD rats (6-8 weeks old) was exposed to 22 Gy radiation. Open fi eld and elevated plus maze was used to assess the anxiety of rats, passive avoidance was used to assess the mood memory, and novel place recognition was used to assess the spatial memory at 1 month or 10 months after brain irradiation. Results: At 1 month post irradiation, rats moved with less distance and entrance to the central zone of open fi eld with less time, explored the open and closed arms with less time and the exploration of open arms also decreased, entered the darkroom more rapidly during the test phase of passive avoidance, and lose the interest to explore the novel place during novel place recognition. At 10 months post irradiation, rats exhibited similarly with control group during open fi eld and elevated plus maze test, but still entered the darkroom more rapidly during the test phase of passive avoidance, and lose the interest to explore the novel place during novel place recognition. Conclusion: Brain irradiation could decrease the locomotor activity, increase the anxiety mood, reduce the mood and spatial memory; mood dysfunction induced by brain irradiation could restore, but memory impairments would be long-standing.
Brain irradiation injury; Mood; Memory
10.3969/j.issn.1007-3969.2014.11.003
R739.41
A
1007-3639(2014)11-0814-06
2014-04-25
2014-06-05)
国家自然科学基金(No:81372431)。
吴开良 E-mail:wukailiang@aliyun.com

