乳腺癌患者血浆循环DNA中Sox17基因甲基化检测的临床意义
符德元 任传利2 谭好升 魏金丽 祝玉祥 何春兰 邵稳喜 章佳新
1. 江苏省苏北人民医院甲状腺乳腺外科,江苏 扬州 225001 ;
2. 江苏省苏北人民医院临床检验中心,江苏 扬州 225001
乳腺癌患者血浆循环DNA中Sox17基因甲基化检测的临床意义
符德元1任传利2谭好升1魏金丽1祝玉祥1何春兰1邵稳喜1章佳新1
1. 江苏省苏北人民医院甲状腺乳腺外科,江苏 扬州 225001 ;
2. 江苏省苏北人民医院临床检验中心,江苏 扬州 225001
背景与目的:在乳腺癌发生、发展过程中,甲基化异常是导致抑癌基因失活的重要机制,是一种可用于肿瘤诊断及预后判断、有价值的生物标志物。本研究旨在通过检测乳腺癌组织及其相应的血浆循环DNA中Sox17基因的甲基化状况,探讨其在乳腺癌早期诊断和预后判断方面的应用价值。方法:采用甲基化特异性聚合酶链反应(methylation specific-PCR,MSP)法,对86例乳腺癌组织、36例乳腺良性肿瘤的癌旁正常组织及其配对的血浆循环DNA中Sox17基因启动子甲基化进行检测,并结合乳腺癌的主要临床病理特性进行分析。结果:86例乳腺癌组织中Sox17基因启动子的甲基化率为77.9%(67/86),与其相应血浆循环DNA中Sox17基因启动子的甲基化率为61.6%(53/86),36例癌旁正常乳腺组织及血浆中均未检测到Sox17基因异常甲基化。患者血浆循环DNA中Sox17基因启动子的甲基化与肿瘤组织中该基因的甲基化显著相关(r=0.502,P=0.000)。在乳腺癌组织标本中Sox17基因甲基化率与患者肿瘤分期(χ2=6.18,P=0.041)、淋巴结转移(χ2=13.54,P=0.001)显著相关,在血浆标本中,Sox17基因甲基化率与患者肿瘤分期(χ2=27.06,P=0.000)、肿瘤大小(χ2=9.65,P=0.007)及淋巴结转移(χ2=20.80,P=0.000)显著相关,与患者年龄、组织学分级及ER、PR、HER-2/neu等指标差异无统计学意义(P>0.05)。结论:Sox17基因启动子甲基化在乳腺癌的发生、发展中起着重要作用,可能与乳腺癌的预后相关。血浆中Sox17基因甲基化,是一个有潜在应用价值的生物标志物。
乳腺癌;Sox17基因;DNA甲基化;循环DNA
癌基因突变和抑癌基因失活是肿瘤形成的两大原因,而抑癌基因CpG岛启动子甲基化则是其功能失活的主要机制之一[1]。在乳腺癌形成及其侵袭性不断增强的过程中,相关基因启动子区CpG岛的异常甲基化起重要作用。许多在乳腺癌发病和进展方面起着重要作用的癌基因,都可能因为其启动子区CpG岛的甲基化而发生功能失活[2-3]。临床上,相关基因的异常甲基化是一类有前途的生物标志物,特别是在患者的血清或血浆循环DNA中开展基因异常甲基化检测的研究已受到众多学者的重视[4]。我们先前的研究表明,在乳腺癌细胞株与组织标本中,Sox17基因启动子区CpG岛的异常甲基化普遍存在,并且Sox17基因甲基化与乳腺癌的某些临床病理特征显著相关[5]。本研究拟通过进一步检测乳腺癌肿瘤组织及其对应血浆循环DNA中Sox17基因甲基化状况,分析它们之间的相互关系,结合临床病理资料,探讨Sox17基因甲基化在乳腺癌预后及诊断方面的应用价值。
1 材料和方法
1.1 临床资料
收集江苏省苏北人民医院甲状腺乳腺外科2009年10月—2010年10月86例乳腺癌手术切除标本,患者均为女性,年龄26~75岁,平均48.4岁。所有患者术前末接受化疗、放疗及其他抗癌治疗。所有标本术后均经病理科医师确诊。另收集同期36例乳腺良性肿瘤的癌旁正常乳腺组织及相应血浆标本作为对照(乳腺病16例,纤维腺瘤17例,乳腺脂肪瘤3例)。患者均为女性,年龄18~62岁,平均43.2岁。研究获得了伦理委员会批准,患者签署知情同意书。
1.2 方法
1.2.1 标本采集
手术前1天收集所有患者外周静脉血10 mL,置于EDTA抗凝管中,室温静置30 min,以2 000×g离心速率10 min后将上层血浆部分吸至另一洁净离心管中,再以2 000×g离心速率离心10 min,完全去除血细胞成分后置于干燥洁净冻存管中,-80 ℃低温冰箱保存。肿瘤组织标本于术中取材,放入液氮中速冻后存放于-80 ℃保存待检。
1.2.2 组织标本DNA及血浆DNA抽提与纯化及亚硫酸盐处理
本研究采用DNeasy组织试剂盒(250)(德国QIAGEN公司)及QIAamp DNA Blood Mini Kit(250)(德国QIAGEN公司)试剂盒分别抽提肿瘤组织及血浆DNA,实验步骤严格按说明书进行,提取的DNA用紫外分光光度计定量,确定浓度后-20 ℃保存。DNA的亚硫酸盐处理采用EZ DNA Methylation-Gold试剂盒,具体步骤按操作说明进行,每次处理200~500 ng DNA。
1.2.3 甲基化特异性PCR(methylation specific PCR,MSP)检测Sox17基因启动子的甲基化状况
PCR引物由生工生物工程(上海)股份有限公司合成,Sox17甲基化上游引物为5’-GGAGATTCGCGTAGTTTTCG-3’,下游引物为5’-AACCCGACCATCACCGCG-3’,产物大小为198 bp;Sox17非甲基化上游引物为5’-GGAGATTTGTGTAGTTTTTG-3’,下游引物为5’-AACCCAACCATCACCACA-3’,产物大小为198 bp;MSP的反应体系为15 μL,包括经亚硫酸盐修饰的DNA模板2 μL,10×Buffer 1.5 μL (含Mg2+),20 mmol/L的dNTPs 0.45 μL,20 nmol/L的上、下游引物各0.18 μL,HotStar Taq DNA聚合酶0.12 μL,用双蒸水调整体系,使得终体积为15 μL。反应条件:95 ℃长变性15 min;然后94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,循环反应共35个循环;72 ℃延伸7 min;反应结束后,取5 μL PCR产物经2.0%的琼脂糖凝胶电泳,Bio-Rad凝胶成像系统摄像保存。实验过程中以SssⅠ甲基化酶处理的DNA作为甲基化的阳性对照,以经全基因组扩增的健康成人外周血淋巴细胞DNA作为未甲基化的阴性对照。出现甲基化特异性引物扩增产物,为甲基化(M);仅出现非甲基化特异性引物扩增产物,为非甲基化(U)。
1.3 统计学处理
应用SPSS 19.0软件对实验数据进行统计学分析;采用 Fisher精确检验分析Sox17基因甲基化与乳腺癌主要临床病理学特征之间的关系,采用Spearman相关分析方法对组织与匹配血浆标本中Sox17基因甲基化的相关性进行分析,所有检验均为双侧,P<0.05为差异有统计学意义。
2 结 果
2.1 组织及血浆循环DNA中Sox17基因启动子的甲基化情况
MSP法检测结果显示,86例乳腺癌组织中67例有Sox17基因甲基化(77.9%),36例癌旁正常乳腺组织中无一例检测到Sox17基因甲基化,差异有统计学意义(P<0.05,图1A)。86例乳腺癌患者血浆循环DNA中,53例有Sox17基因甲基化(61.6%),36例乳腺良性疾病患者相应血浆循环DNA中均未发现有Sox17基因甲基化(图1B)。

图 1 组织及血浆循环DNA中Sox17基因启动子的甲基化情况Fig. 1 Methylation status of Sox17 promoter in breast cancer tissues and corresponding Plasma circulating DNA
2.2 Sox17基因启动子甲基化与临床病理特征相关性分析
在乳腺癌组织标本中,Sox17甲基化与患者肿瘤分期(P=0.000)、淋巴结转移(P=0.001)显著相关。在乳腺癌血浆标本中,Sox17甲基化除与患者肿瘤分期(P=0.041)及淋巴结转移相关外(P=0.000),还与肿瘤大小显著相关(P=0.007);Sox17基因甲基化与患者年龄、组织学分级及ER、PR、HER-2/neu等指标间差异无统计学意义(P>0.05,表1)。
2.3 血浆与组织标本中Sox17基因甲基化的相关性分析
分析血浆循环DNA中Sox17基因甲基化与肿瘤组织中该基因的甲基化情况显示两者之间差异无统计学意义(χ2=1.00,P=1.00,表2);Spearman相关分析结果显示,血浆循环DNA中Sox17基因启动子的甲基化与肿瘤组织的该基因的甲基化显著相关(r=0.502,P=0.000,表3)。
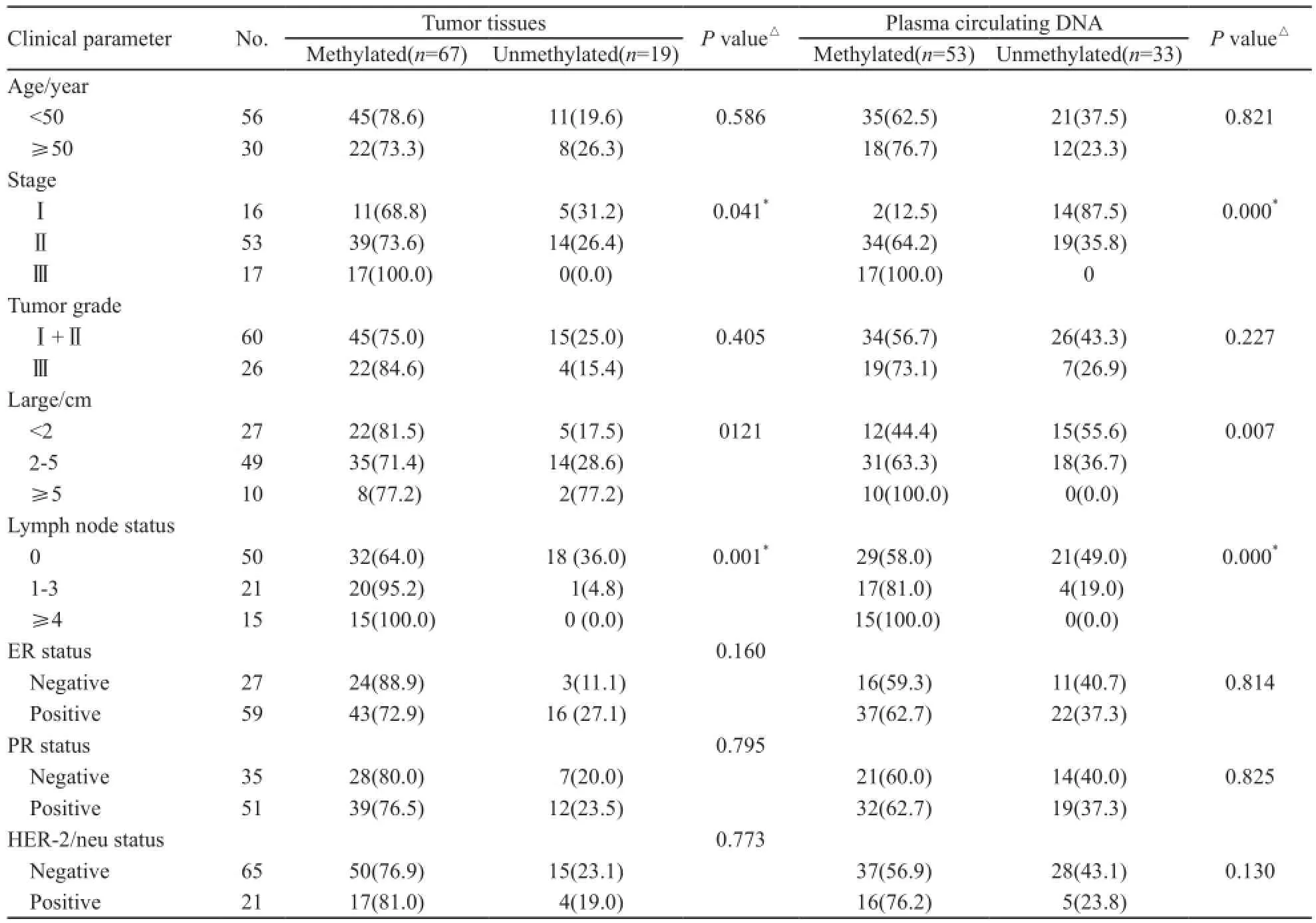
表 1 肿瘤组织和对应血浆循环DNA中Sox17基因甲基化状态与乳腺癌主要临床病理特征之间的关系Tab. 1 Clinical characteristics of 86 patients with and without Sox17 methylation in tumor tissues or plasma circulating DNA [n(%)]

表 2 血浆与组织标本中Sox17基因甲基化比较Tab. 2 Analysis of Sox17 gene methylation in breast cancer tissues and corresponding plasma circulating DNA (χ² test analysis)
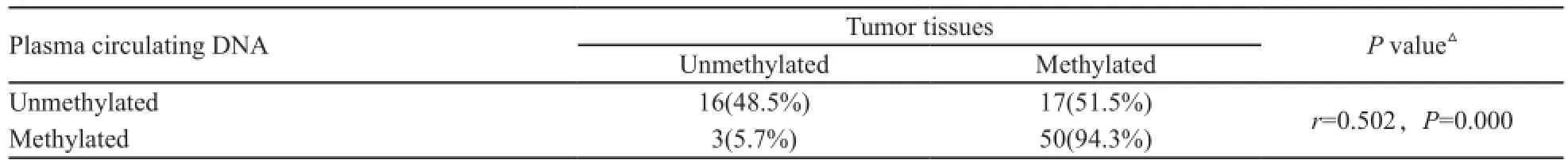
表 3 血浆与组织标本中Sox17基因甲基化的相关性分析(Spearman correlation analysis)Tab. 3 Correlation analysis of Sox17 gene methylation in breast cancer tissues and corresponding plasma circulating DNA (Spearman correlation analysis )
3 讨 论
近年来,虽然在乳腺癌诊断和辅助治疗方面有了很大进展,但乳腺癌发病率仍呈逐年上升趋势,在大城市已占女性恶性肿瘤发病率的第一位。因此,临床上进一步探索研究新的、有价值的诊断及预后标志物,对进一步提高我国乳腺癌的诊治水平具有重要意义。研究表明,肿瘤相关基因启动子甲基化所导致的基因沉默是人类的癌症的共同特点,是肿瘤抑制基因功能丧失的一个重要机制[1]。许多在乳腺癌发病和进展方面起着重要作用的癌基因[2-3],都可能因为其启动子区CpG岛的甲基化而发生功能失活。研究表明,DNA异常甲基化发生在肿瘤早期,在正常组织则很少出现,而且甲基化通常发生在基因的特定区域,较为单一,易于被临床检测,同时随着技术的不断完善发展,使得临床上能够对微量样本进行甲基化检测,因此,基因异常甲基化是一种被认为有临床应用前景的生物标志,其在肿瘤临床诊断、预后判断及疗效预测等方面的巨大潜力已开始得到重视。
Sox17定位于8qll.23,是Sox基因家族一员,作为转录因子参与多种生物细胞发育过程和生物活性,其在神经少突胶质细胞发展[6]、血管生成[7]、胚胎内胚层形成[8]及干细胞分化调控等方面具有重要功能[9],在癌变过程中,Sox17基因同样发挥重要作用,在不同组织来源的肿瘤中,Sox17基因均可因其启动子区CpG岛甲基化而导致其表达减低[10-12],从而丧失其抑癌基因的功能,促进癌变发生。在先前的研究中,我们通过系统分析Sox17基因在乳腺癌细胞株和组织标本中的表达和甲基化情况,发现在乳腺癌细胞和大部分乳腺癌组织中,Sox17基因的mRNA表达水平显著降低,而且Sox17表达水平与其启动子区CpG岛甲基化状态密切相关。在74.3%的乳腺癌组织中,Sox17基因表现为甲基化状态,且Sox17基因甲基化与乳腺癌分期及淋巴结转移显著相关[5]。本研究中,86例乳腺癌组织中,67例(77.9%)发生Sox17基因甲基化,而在36例癌旁正常乳腺组织中却无此现象,证明Sox17基因甲基化与患者肿瘤分期(P=0.000)、淋巴结转移(P=0.001)显著相关,表明在人乳腺癌中DNA甲基化是抑制乳腺癌细胞Sox17基因表达的主要机制,甲基化导致的Sox17基因表达沉默不仅是一个经常发生的事件,而且对乳腺癌的预后判断具有重要意义。
研究表明,恶性实体肿瘤可以释放大量的基因组DNA进入人体循环,而且这些循环DNA可以获得肿瘤细胞本身所具有的所有生物特性[13]。更为重要的是,这些肿瘤细胞特异性的循环DNA不仅仅限于转移癌患者,在肿瘤早期或肿瘤仍局限于原发脏器时,它即可出现在患者的血清和(或)血浆中[14]。已有研究表明,乳腺癌患者的血浆循环DNA浓度异常增高[15-16]。血浆循环DNA和原发性乳腺癌肿瘤标本中存在较为一致的表观遗传学改变,表明这些肿瘤表观遗传标志物在乳腺癌的监测中具有潜在价值[17-19],在乳腺癌患者的血清或血浆循环DNA中检测相关基因异常DNA的研究已被众多学者广泛探讨。因此,检测血清或血浆中存在的循环DNA的各种生物学特性可用于肿瘤患者的无创性诊断。
本研究中,在86例乳腺癌患者血浆循环DNA中,53例(61.6%)出现了Sox17基因甲基化,在36例乳腺良性疾病患者中则无Sox17基因甲基化发生。Spearman相关分析表明,血浆循环DNA中Sox17基因启动子的甲基化与肿瘤组织的该基因的甲基化状况显著相关(r=0.502,P=0.000),提示其外周血标本可作为肿瘤标志物诊断乳腺癌。此外,血浆循环DNA中Sox17甲基化除与患者肿瘤分期(P=0.041)及淋巴结转移相关外(P=0.000),还与肿瘤大小显著相关(P=0.007),与其在乳腺癌组织中的结果也具有高度的一致性。另外,血浆取材方便,创伤性小,可反复取材,且患者易于接受。因此,检测血浆循环DNA中Sox17基因的甲基化可用于乳腺癌早期诊断。
综上所述,本研究结果显示,在乳腺癌发生、发展过程中,Sox17基因甲基化是一个频繁发生的事件,在乳腺癌组织及血浆中具有高度一致性和特异性,是一个有潜在应用价值的生物标志物。因此,Sox17基因甲基化的研究对于进一步明确乳腺癌的发病机制、早期诊断和预后具有重要的临床意义。
[1] JONES P A, BAYLIN S B. The epigenomics of cancer [J]. Cell, 2007, 128(4): 683-692.
[2] SZYF M, PAKNESHAN P, RABBANI S A. DNA methylation and breast cancer [J]. Biochem Pharmacol, 2004, 68(6): 1187-1197.
[3] AGRAWAL A, MURPHY R F, AGRAWAL D K. DNA methylation in breast and colorectal cancers [J]. Mod Pathol, 2007, 20(7): 711-721.
[4] WIDSCHWENDTER M, MENON U. Circulating methylated DNA: a new generation of tumor markers [J]. Clin Cancer Res, 2006, 12(24): 7205-7208.
[5] FU D Y, WANG Z M, LI-CHEN, et al. Sox17, the canonical Wnt antagonist, is epigenetically inactivated by promoter methylation in human breast cancer [J]. Breast Cancer Res Treat, 2010, 119(3): 601-612.
[6] SOHN J, NATALE J, CHEW L J, et al. Identification of Sox17 as a transcription factor that regulates oligodendrocyte development [J]. J Neurosci, 2006, 26(38): 9722-9735.
[7] MATSUI T, KANAI-AZUMA M, HARA K, et al. Redundant roles of Sox17 and Sox18 in postnatal angiogenesis in mice[J]. J Cell Sci, 2006, 119(17): 3513-3526.
[8] SHIMODA M, KANAI-AZUMA M, HARA K, et al. Sox17 plays a substantial role in late-stage differentiation of the extraembryonic endoderm in vitro [J]. J Cell Sci, 2007, 120(21): 3859-3869.
[9] KIM I, SAUNDERS T L, MORRISON S J. Sox17 dependence distinguishes the transcriptional regulation of fetal from adult hematopoietic stem cells [J]. Cell, 2007, 130(3): 470-483.
[10] ZHANG W, GLÖCKNER S C, GUO M, et al. Epigenetic inactivation of the canonical Wnt antagonist SRY-box containing gene 17 in colorectal cancer [J]. Cancer Res, 2008, 68(8): 2764-2772.
[11] KUO I Y, WU C C, CHANG J M, et al. Low SOX17 expression is a prognostic factor and drives transcriptional dysregulation and esophageal cancer progression [J]. Int J Cancer, 2014, 135(3): 563-573.
[12] OISHI Y, WATANABE Y, YOSHIDA Y, et al. Hypermethylation of Sox17 gene is useful as a molecular diagnostic application in early gastric cancer [J]. Tumour Biol, 2012, 33(2): 383-393.
[13] GARCIA J M, SILVA J M, DOMINGUEZ G, et al. Heterogeneous tumor clones as an explanation of discordance between plasma DNA and tumor DNA alterations [J]. Genes Chromosomes Cancer, 2001, 31(3):300-301.
[14] SILVA J M, DOMINGUEZ G, GARCIA J M, et al. Presence of tumor DNA in plasma of breast cancer patients: clinicopathological correlations [J]. Cancer Res, 1999, 59(13): 3251-3256.
[15] SILVA J M, SILVA J, SANCHEZ A, et al. Tumor DNA in plasma at diagnosis of breast cancer patients is a valuable predictor of disease-free survival [J]. Clin Cancer Res, 2002, 8(12): 3761-3766.
[16] HUANG Z H, LI L H, HUA D. Quantitative analysis of plasma circulating DNA at diagnosis and during follow-up of breast cancer patients [J]. Cancer Lett, 2006, 243(1): 64-70.
[17] MÜLLER HM, WIDSCHWENDTER A, FIEGL H, et al. DNA methylation in serum of breast cancer patients: an independent prognostic marker [J]. Cancer Res, 2003, 63(22): 7641-7645.
[18] SHARMA G, MIRZA S, PARSHAD R, et al. DNA methylation of circulating DNA: a marker for monitoring efficacy of neoadjuvant chemotherapy in breast cancer patients [J]. Tumour Biol, 2012, 33(6): 1837-1843.
[19] HOQUE M O, FENG Q, TOURE P, et al. Detection of aberrant methylation of four genes in plasma DNA for the detection of breast cancer [J]. J Clin Oncol, 2006, 24(26): 4262-4269.
Clinical signi fi cance of Sox17 gene promoter methylation in plasma circulating DNA in breast cancer patients
FU De-yuan1, REN Chuan-li2, TAN Hao-sheng1, WEI Jin-li1, ZHU Yu-xiang1, HE Chun-lan1, SHAO Wen-xi1, ZHANG Jia-xin1(1.Department of Thyroid and Breast Surgery, Subei People’s Hospital of Jiangsu Province, Yangzhou Jiangsu 225001, China; 2.Medical Laboratory, People’s Hospital of Jiangsu Province, Yangzhou Jiangsu 225001, China)
FU De-yuan E-mail: fdy1003@163.com
Background and purpose: Aberrant DNA methylation that leads to the inactivation of tumor suppressor genes plays important roles in development and progression of breast cancer. Clinically, related gene methylation is considered to be a promising biomarker for tumor diagnosis and prognosis. This study aimed to investigate the methylation status of Sox17 gene in breast cancer tissue and its corresponding plasma circulating DNA, as well as to investigate its value in breast cancer early diagnosis and prognosis. Methods: The Sox17 gene promoter methylation status was detected by MSP in 86 cases of breast cancer, 36 normal breast tissues and its paired plasma DNA, the results were analyzed with corresponding clinical and pathological features. Results: The frequency of Sox17 gene methylation rate among 86 breast cancer tissues was 77.9%(67/86), and was 61.6%(53/86)in plasma circulating DNA, however, no Sox17 gene methylation was found in normal breast tissues. Sox17 gene promoter methylation in plasma circulating DNA was signi fi cantly associated with the methylation status in tumor tissues (r=0.502, P=0.000). In breast cancer tissue specimens, Sox17 methylation status was significantly correlated with tumor stage (χ2=6.18,P=0.041) and lymph node metastasis (χ2=13.54, P=0.001); Sox17 gene methylation rate was signi fi cantly correlated with tumor stage (χ2=27.06, P=0.000), tumor size (χ2=9.65, P=0.007) and lymph node metastasis (χ2=20.80, P=0.000) in plasma samples, and there was no signi fi cant difference of Sox17 gene methylation between patient age, histological grade and ER, PR, HER-2/neu status. Conclusion: Sox17 gene promoter methylation plays an important role in the carcinogenesis and development of breast cancer, and may be associated with the prognosis of breast cancer. Furthermore, methylated Sox17 gene may be a useful tumor biomarker in plasma circulating DNA for breast cancer detection and disease monitoring.
Breast cancer; Sox17 gene; DNA methylation; Plasma circulating DNA
10.3969/j.issn.1007-3969.2014.11.002
R737.9
A
1007-3639(2014)11-0808-06
2014-06-09
2014-09-21)
国家自然科学基金资助项目(No:81172508)。
符德元 E-mail:fdy1003@163.com

