白蛋白结合型紫杉醇治疗晚期难治性乳腺癌的疗效及安全性分析
北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,
恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
白蛋白结合型紫杉醇治疗晚期难治性乳腺癌的疗效及安全性分析
梁旭李惠平邸立军姜晗宋国红严颖王超颖邵彬林晓琳
北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,
恶性肿瘤发病机制及转化研究教育部重点实验室,北京 100142
[摘要]背景与目的:白蛋白结合型紫杉醇通过将紫杉醇与人血白蛋白相结合新型制剂方式提高了紫杉醇的疗效,目前主要应用于疾病进展迅速或联合化疗后复发的晚期乳腺癌。本研究对白蛋白结合型紫杉醇治疗晚期难治性乳腺癌的疗效和安全性进行探讨。方法:收集2009年7月—2014年1月在北京大学肿瘤医院接受白蛋白结合型紫杉醇单药或联合方案化疗的患者的临床资料,筛选疾病进展迅速和多线治疗后患者,每2个周期评价疗效,每周期评价不良反应,随访患者生存情况。结果:共58例难治性晚期乳腺癌患者入组,均可评价疗效,67.2%(39/58)为三线以上化疗患者,32.8%(19/58)接受一、二线解救化疗的均为辅助化疗后1年内复发、疾病进展迅速的患者,58例中84.5%的患者伴有内脏转移,93.1%的患者既往使用过紫杉类药物。化疗的客观有效率为13.8%(8/58),临床控制率为60.3%(35/58),中位无疾病进展时间为4.0个月,总生存时间为10.1个月。其中23例三阴性乳腺癌患者的客观有效率为13.0%,临床控制率56.5%,中位无疾病进展时间为4.1个月,总生存时间为6.6个月。3~4度不良反应主要为血液学毒性,中性粒细胞减低的发生率34.5%(20/58),粒细胞缺乏性发热发生率5.2%(3/58),贫血12.1%(7/58),血小板减低6.9%(4/58)。结论:白蛋白结合型紫杉醇单药及联合方案是进展迅速或多线治疗失败的难治性晚期乳腺癌的一种治疗选择,对既往接受过紫杉类药物治疗和晚期三阴性乳腺癌也显示出一定疗效,且毒副作用可耐受。
[关键词]晚期难治性乳腺癌;白蛋白紫杉醇;疗效;安全性
自上世纪九十年代中期以来,多项研究均肯定了紫杉类药物对转移性乳腺癌的疗效,紫杉类药物是治疗早期和转移性乳腺癌最有效、应用最广泛的药物[1-3]。但因其需要聚氧乙烯蓖麻油作为必须助溶剂,因此会导致不同程度的过敏反应,约3%患者甚至会出现严重过敏反应,进而需要在用药前较大剂量的激素给予预处理,聚氧乙烯蓖麻油还可加重骨髓抑制,引起外周神经轴突变性和脱髓鞘反应,加重紫杉醇的外周神经毒性,在血液循环中形成的溶剂胶束包裹血液中的紫杉醇,从而阻止紫杉醇分布到肿瘤组织中,即便提高紫杉醇的剂量也不能增加其抗肿瘤的活性[4-5]。白蛋白结合型紫杉醇以纳米微粒白蛋白为载体,改变了助溶剂,提高疗效的同时亦减轻了毒性。与其他剂型紫杉醇相比,白蛋白结合型紫杉醇(nab-P,Abraxane)可在肿瘤局部产生更高的紫杉醇浓度,且注射时间短。白蛋白结合型紫杉醇可通过白蛋白受体(Gp60)穿胞途径及结合于肿瘤细胞外间质的富含半胱氨酸的酸性分泌蛋白(SPARC)途径来提高肿瘤外药物浓度。目前,该药已获美国食品与药物管理局(FDA)批准用于辅助化疗6个月内转移或复发,经联合化疗无效的乳腺癌[6]。白蛋白结合型紫杉醇虽然在理论上应当明显优于传统紫杉醇制剂,因其价格的昂贵,在中国女性晚期乳腺癌的应用经验仍然较少。本研究对58例既往疾病进展迅速、治疗困难的晚期乳腺癌使用以白蛋白结合型紫杉醇为基础的化疗的临床资料进行回顾性分析,以探讨白蛋白结合型紫杉醇对此类患者治疗中的近期疗效及安全性。
1 资料和方法
1.1患者纳入标准
①经病理组织学证实的术后复发转移或确诊时无法手术的Ⅳ期乳腺癌患者;②年龄为18~80 岁;③按照实体肿瘤的疗效评价标准(response evaluation criteria in solid tumors,RECIST 1.1)至少有1 个可测量的病灶;④美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)体能状态评分≤2 ;⑤预计生存期≥3 个月;⑥重要脏器功能基本正常,化疗前血常规以及肝肾功能基本正常,无化疗禁忌证;⑦晚期难治性乳腺癌定义为既往接受过含蒽环或紫杉类药物辅助化疗结束后1年内出现复发或转移者,或转移后经二线以上化疗失败者;⑧将辅助化疗阶段未使用蒽环或紫杉类药物的复发后一线治疗患者排除;⑨对于无内脏危象的激素受体阳性患者,复发后应经过二线以上的内分泌治疗。
1.2一般资料
收集2009年7月—2014年1月北京大学肿瘤医院收治的76例接受白蛋白结合型紫杉醇单药或联合治疗患者的临床资料,按照标准共58例患者纳入研究,均为经组织细胞学及影像学确诊的晚期乳腺癌患者,中位年龄为55岁(30~79岁),浸润性导管癌49例(84.5%),浸润性小叶癌6例(5.2%),单纯癌2例(3.4%),乳头状癌1例(1.7%)。58例女性患者中,绝经前16例(20.7%),绝经后42例(79.3%)。49例患者伴有内脏转移(84.5%),转移器官或部位包括骨、淋巴结、软组织、肺、肝脏、脑等,侵及≥3个器官和(或)部位者36例(62.1%)。58例患者按照乳腺癌术后组织病理的受体表达情况分析,人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)阳性7例(12.1%),三阴型[estrogen receptor(ER)、progesterone receptor(PR)及HER-2均为阴性]23例(39.7%)。内分泌治疗敏感Luminal型(ER和/或PR阳性,HER-2阴性)28例(48.3%)。其中一线解救治疗10例(17.2%),二线解救治疗9例(15.5%),19例均为既往辅助化疗后1年内复发的患者,3~5线解救治疗23例(39.7%),5线以上解救化疗的16 例(27.6%),58例患者的具体临床特征见表1。93.1%的患者在辅助化疗或复发后解救化疗阶段使用过紫杉醇或多西他赛,81%的患者使用过蒽环类药物。
1.3治疗方法
所有患者使用的白蛋白结合型紫杉醇为美国阿博利斯生物技术公司生产的Abraxane,白蛋白结合型紫杉醇冻干粉用0.9%氯化钠注射液按说明书要求溶解后,静脉滴注30 min,用药前不予抗过敏预处理,常规给予5-羟色胺受体3拮抗剂预防恶心和呕吐,化疗期间观察患者的生命体征;观察并记录患者化疗期间的不良反应。具体方案如下:①白蛋白结合型紫杉醇单药治疗31例(53.4%),单药联合靶向治疗的3例(5.2%,贝伐单抗1例,曲妥珠单抗1例,曲妥珠单抗合并帕妥珠单抗1例),白蛋白结合型紫杉醇100~150 mg/m2,第1、8天(21 d为1个化疗周期)或第1、8、15天(28 d为1个化疗周期);②白蛋白结合型紫杉醇联合卡铂化疗18例(36.2%),联合卡铂及靶向治疗3例(5.2%,贝伐单抗1例,曲妥珠单抗2例),白蛋白结合型紫杉醇100~120 mg/m2,第1、8、15天,卡铂曲线下面积(area under curve,AUC )=2 ,静脉滴注,第1、8天(28 d为1个化疗周期);③白蛋白结合型紫杉醇联合吉西他滨3例,白蛋白结合型紫杉醇100 mg/m2,第1、8天;吉西他滨1 000 mg/m2静脉滴注,第1、8天(21 d为1个化疗周期)。曲妥珠单抗、贝伐单抗及帕妥珠单抗均按照药品说明书指示用药。全部患者均未预防性使用粒细胞集落刺激因子类药物(granulocyte colony stimulating factor,G-CSF),但出现3度以上的血液学毒性时则使用G-CSF治疗。治疗直至完成6个化疗周期、出现疾病进展、患者拒绝化疗或无法耐受化疗。

表 1 58例患者临床特征Tab. 1 Baseline characteristics of patients(n=58)
1.4疗效及不良反应评价、随访
所有可测量病灶均有化疗前的基线测量,每2周期进行影像学检查测量。按照RECIST1.1:完全缓解(complete response,CR)为所有目标病灶消失;部分缓解(partial response,PR)为基线病灶长径总和缩小≥30%;疾病进展(progressive disease,PD)为基线病灶长径总和增加1cm超过20%或出现新病灶;疾病稳定(stable disease,SD)为基线病灶长径总和有缩小但未达PR或有增加但未达PD。客观缓解率(objective response rate,ORR)=CR+PR,疾病控制率(disease control rate,DCR)=CR+PR+SD;无进展生存(progression free survival,PFS)定义为开始治疗至第一次发生PD或任何原因死亡的时间间隔。总生存(overall survival,OS)计算从化疗开始之日起至死亡或末次随访之日止。不良反应按美国国立癌症研究所不良反应事件通用术语标准(National Cancer Institue-Common Terminology Criteria for Adverse Events,NCI-CTC4.0)判定,标准分为0~4度。
1.5统计学处理
应用SPSS15.0统计软件对所有数据行统计学分析。患者的临床病理特征采用描述性统计分析进行评价,计数资料采用χ2检验,计算中位PFS和中位OS,采用Kaplan-Meier法绘制生存曲线。P<0.05为差异有统计学意义。
2 结 果
2.1近期疗效
58 例患者共完成了213个周期的化疗,中位化疗周期数为3个。58 例患者可评价疗效,其中无CR患者,8例PR(13.8%),27例SD(46.6%),23例 PD(39.7%),ORR为13.8%(8/58),DCR为60.3%(35/58)。58例患者按照所使用的8种不同化疗方案及解救化疗线数进行亚组分析,具体近期疗效见表2。可以看到应用较多的白蛋白结合型紫杉醇单药方案和联合卡铂方案的DCR率均大于60%。按照治疗线数分组后比较,19例复发后一、二线使用白蛋白结合型紫杉醇方案治疗的DCR率为78.9%,23例三至五线的DCR率为60.9%,16例五线以上使用的DCR率为37.5%,3组之间比较差异有统计学意义,P值为0.044。
2.2PFS和OS时间
58例患者中位随访时间8.4个月(95%CI:4.4~38.0个月),中位PFS为4.0个月(95%CI:2.1~6.0个月,图1A)。中位OS为10.0个月(95%CI:8.8~11.4个月,图1B)。按照复发后解救治疗线数不同进行亚组分析,其中复发后一、二线使用含白蛋白结合型紫杉醇方案解救治疗的中位PFS为6.1个月(95%CI:5.4~6.8个月),中位OS为14.2个月(95%CI:7.8~20.6个月);三至五线的中位PFS为3.9个月(95%CI:1.5~6.4个月),中位OS为8.9个月(95%CI:5.4~12.4个月);五线以上的中位PFS为2.1个月(95%CI:0.2~4.0个月),中位OS为8.1个月(95%CI:4.2~12.0个月),比较各组之间的PFS和OS差异无统计学意义,P值分别为0.407和0.353(图2)。31例使用白蛋白结合型紫杉醇单药治疗的PFS时间3.0个月(1.6~4.4个月),中位OS为9.2个月(95%CI:6.3~12.1个月,图3);18例使用白蛋白结合型紫杉醇联合卡铂化疗的PFS为5.1个月(0.5~9.7个月),中位OS为8.9个月(95%CI:3.0~14.8个月,图4)。

表 2 近期疗效亚组分析Tab. 2 Subgroup analysis of short term-responsen (%)
2.3三阴性乳腺癌使用白蛋白结合型紫杉醇方案疗效
58例患者中三阴性乳腺癌23例:10例患者接受白蛋白紫杉醇联合卡铂治疗,无PR,6例SD(60.0%),4例PD(40.0%),ORR为0%(0/10),DCR为60.0%(6/10);9例患者接受白蛋白紫杉醇单药化疗,2例SD(22.2%),2例PR(22.2%),5例PD(55.6%),ORR为22.2%(2/9),DCR为44.4%(4/9);2例患者接受白蛋白紫杉醇联合吉西他滨治疗疗效均为SD;1例患者使用白蛋白紫杉醇联合卡铂及贝伐单抗(7.5 mg/kg,21 d为1个治疗周期)疗效PD;1例患者使用白蛋白紫杉醇联合贝伐单抗(7.5 mg/kg,21 d为1个治疗周期)疗效达PR。23例患者的总体ORR为13.0%(3/23),DCR为56.5%(13/23),中位PFS为4.1个月(0.2~8.0个月),中位OS为6.6个月(95%CI:5.8~7.4个月,图5)。

图 1 58例晚期乳腺癌患者无进展生存和总生存Fig. 1 The median PFS and OS of 58 patients with refractory MBC

图 2 亚组分析比较不同解救化疗线患者的无进展生存和总生存Fig. 2 The median PFS and OS of subgroup in different chemotherapy line

图 3 31例白蛋白结合型紫杉醇单药治疗的患者无进展生存和总生存Fig. 3 The median PFS and OS of 31 patients with albumin-bound paclitaxel monotherapy

图 4 18例白蛋白结合型紫杉醇联合卡铂治疗的患者无进展生存和总生存Fig. 4 The median PFS and OS of 18 patients with albumin-bound paclitaxel combined carboplatin
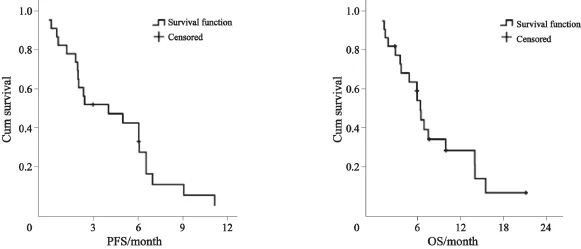
图 5 23例晚期三阴性乳腺癌患者的无进展生存和总生存Fig. 5 The median PFS and OS of 23 patients with triple negative MBC
2.4安全性分析
白蛋白结合型紫杉醇单药或联合治疗的整体安全性良好,58例患者具体不良反应评价见表3。发生率在5%以上的3~4度不良反应主要表现为血液学毒性,主要有中性粒细胞减低的发生率34.5%(20/58),粒细胞缺乏性发热发生率5.2%(3/58),贫血12.1%(7/58),血小板减低6.9%(4/58)。非血液学毒性主要表现为乏力、转氨酶升高、恶心呕吐、肌肉关节痛、外周神经炎等,基本没有3~4度的严重不良反应发生,58例患者使用过程中无超敏反应的发生。

表 3 58例患者治疗相关不良反应Tab. 3 Treatment related toxicities(n=58)[n(%)]
3 讨 论
紫杉醇是从短叶紫杉中提取或半合成的一种抗癌药,通过促进微管蛋白装配成微管,同时抑制微管的解聚,引起微管束的排列异常、纺锤体失去功能,导致细胞的死亡,已广泛的应用包括乳腺癌在内的多种恶性肿瘤的治疗。白蛋白纳米载体制剂与传统的制剂相比,能促进紫杉醇迅速从血中清除并分布至组织,对组织的亲和力增加。注射用白蛋白结合紫杉醇通过与白蛋白和细胞膜上的Gp60结合,激活细胞膜上窖蛋白1(Caveolin-1)将紫杉醇以细胞转运形式通过血管内皮细胞转运到组织中,并从组织间液中转运到肿瘤细胞内,并且使得含药物的纳米微粒也容易通过毛细血管壁细胞间隙离开血循环进入肿瘤组织中, 最终导致药物在肿瘤组织蓄积[7]。与含聚氧乙烯蓖麻油紫杉醇注射液比较,白蛋白结合纳米紫杉醇能更快离开血循环分布到组织中,并且在多个组织中的药物浓度较传统紫杉醇注射液高。白蛋白结合型紫杉醇去除了传统紫杉醇的助溶剂,用药前不需预处理,静脉输注时间明显缩短到30 min,特殊的制剂使其避免了传统紫杉醇的剂量限制,用药剂量可显著提升,其临床推荐剂量为260 mg/m2。同时有多项临床研究结果对白蛋白结合型紫杉醇按照不同的给药模式和剂量强度用药进行了探讨。1项贝伐单抗联合不同给药模式的白蛋白结合型紫杉醇联合治疗治疗晚期乳腺癌的Ⅱ期临床研究结果提示,白蛋白结合型紫杉醇按照每3周1次给予260 mg/m2,对比每周1次给予130 mg/m2,疗效相当,不良反应稍有差异[8]。灵活的给药模式和可调的剂量范围便于临床医师根据患者的一般状态和联合用药进行治疗方案的设计。白蛋白结合型紫杉醇每周期费用约为进口常规紫杉醇2~3倍,约为国产常规紫杉醇的8~10倍,这一有着多优势的新药由于昂贵的价格在中国乳腺癌患者中使用的经验还非常有限。
Gradishar等[9]在2005年发表的1项入组454例晚期乳腺癌患者的随机对照Ⅲ期临床研究结果提示,白蛋白结合型紫杉醇对比传统紫杉醇,2组的ORR分别为37%和19%,白蛋白结合型紫杉醇组的TTP时间明显延长为23周,基于这一研究结果,白蛋白结合型紫杉醇被批准应用于复发转移性乳腺癌的治疗。该研究中亚组分析提示在白蛋白结合型紫杉醇对比传统紫杉醇治疗复发一线以上的晚期乳腺癌有明显的优势,ORR和PFS均有显著性差异,ORR提高了2倍,2组分别为27%和13%,PFS时间2组分别为20.6周和16.1周。已发表的多项国际临床研究提示,对比传统紫杉醇或多西他赛,白蛋白结合型紫杉醇在疗效上具有优势,无论是260 mg/m2Q3w(第1天给药,每21天1个周期)或100~125 mg/m2Qw3/4(第1、8、15天给药,每28天1个周期),2种治疗模式均有效,且疗效相当[9-11]。晚期难治性乳腺癌尽管难以定义,但是辅助治疗中使用过紫衫类药物并1年内出现复发转移的患者,临床医师多认为是紫杉类耐药乳腺癌,疾病进展迅速,预后较差。而经过多线治疗后出现疾病进展的患者多数伴有多部位的内脏转移,且均已使用过紫杉类药物,化疗疗效随着化疗线数的增多会明显下降。本研究所入组的患者符合上述要求,84.7%的患者伴有内脏转移,且62.1%转移器官或部位大于3个,其中39例(67.2%)患者接受3线以上的化疗,且全部39例患者在辅助治疗或复发后解救治疗阶段使用过紫杉醇或多西他赛,19例1~2线使用白蛋白紫杉醇的患者均为DFS小于1年,且78.9%(15/19)为紫杉醇耐药的患者。58例患者中93.1%既往使用过紫杉类药物治疗。在日常临床实践中,晚期乳腺癌患者多数在紫杉醇或多西他赛耐药的情况下接受了白蛋白结合型紫杉醇的治疗建议。从本研究中看到,白蛋白结合型紫杉醇单药或联合方案的总体客观有效率为13.8%(8/58),临床控制率为60.3%(35/58),中位PFS为4.0个月,中位为OS为10.1个月。针对既往应用过紫杉醇或多西他赛后再次使用白蛋白紫杉醇的随机对照研究数据较少,Blum等[12]报道的1项Ⅱ期临床研究纳入181名紫杉烷类药物治疗失败的转移性乳腺癌患者,接受白蛋白结合型紫杉醇100 mg/m2或150 mg/m2每周方案治疗,2组的ORR分别为14%和16%,中位PFS分别为3.0个月和3.5个月,中位OS分别为9.2个月和9.1个月,我们的研究结果与Blum的Ⅱ期临床研究结果基本相符,说明白蛋白结合型紫杉醇对于既往使用过紫杉类药物的晚期多线化疗后患者仍有一定疗效。
三阴性乳腺癌TNBC占所有乳腺癌的10%~20%,多见于年轻女性,尤其是伴有BRCA 基因突变的女性。这类特殊类型乳腺癌具有高度侵袭性,由于缺乏相应靶点,治疗选择少,复发风险高、预后差而成为的治疗难点,因此对该群体的研究非常重要[13]。晚期三阴性乳腺癌的治疗长期以来以全身化疗为主[14-15]。近期有1项Ⅱ期临床研究报道了白蛋白结合型紫杉醇联合卡铂和贝伐单抗应用于三阴性乳腺癌复发转移后一线解救化疗,ORR为85%,中位PFS为9.2个月,表现出较好的疗效和安全性[16],以白蛋白结合型紫杉醇为基础的联合方案在三阴性乳腺癌的新辅助化疗、复发一线、二线解救化疗的临床研究均有报道[17-18]。本研究的58例患者中有23例为三阴性乳腺癌,均为多线化疗后患者,ORR为13.0%,DCR为56.5%,中位PFS为4.1个月。对比一线临床研究的结果,我们可以看到该白蛋白结合型紫杉醇方案应用于多线治疗后的三阴性乳腺癌时疗效下降,尽早应用于复发后一线解救治疗可能取得更加的疗效。
本研究中白蛋白结合型紫杉醇方案安全性分析中发现,不良反应主要表现为血液学毒性,3~4度血液学毒性的包括:白细胞减少发生率占32.8%;中性粒细胞减少发生率占34.5%;血小板减少发生率占6.9%;贫血12.1%;粒细胞缺乏性发热占5.2%,经临床积极对症处理,骨髓抑制均可恢复,无骨髓抑制引发的感染、出血等严重不良反应的发生。本研究报道的3~4度血液学毒性的发生率与Gradishar等[9,11]报道的CA012和CA024的临床研究相似。CA012研究和CA024研究中结果均表明,白蛋白结合型紫杉醇组具有良好的安全性,尽管白蛋白结合型紫杉醇组的剂量强度与累积剂量比传统紫杉醇制剂组高49%,但3~4度中性粒细胞减少发生率在2个研究中均低于对照的传统紫杉醇组和多西他赛组;3度感觉神经病发生率虽然比传统紫杉醇制剂组更常见,但易控制并很快恢复。白蛋白结合型紫杉醇的非血液学毒性主要表现为乏力、转氨酶升高、恶心呕吐、肌肉关节痛及外周神经炎等。白蛋白结合型紫杉醇使用前不需要预处理,58例患者使用过程中无超敏反应的发生,4例患者出现皮疹,经激素治疗后可恢复。研究发现,尽管应用于多线治疗后的晚期乳腺癌患者,白蛋白结合型紫杉醇方案的总体耐受性良好。
鉴于越来越多的证据支持白蛋白结合型紫杉醇对比传统紫杉醇在在耐受性和疗效上均展现出了明显的优势,白蛋白结合型紫杉醇单药或联合化疗和分子靶向药物治疗作为晚期乳腺癌的一种治疗选择已得到了充分的肯定[19-21]。最近较多的白蛋白结合型紫杉醇的临床研究多针对侵袭性强伴有较差预后因素的晚期乳腺癌患者,如三阴性乳腺癌、多发内脏转移及无病间期短等[22-23],这与本研究所探讨的目的相符。此外,白蛋白结合型紫杉醇具备不需预处理,输注时间短,给药剂量模式灵活等诸多优势,这些特点使其对许多一般状态较差和预后不佳的患者具有吸引力和可行性。对于晚期治疗困难的乳腺癌患者,传统紫杉醇或多西他赛作为一线治疗选择绝大多数已经应用过,在本研究中,白蛋白结合型紫杉醇为基础的化疗方案治疗既往使用紫杉类药物的晚期乳腺癌和既往接受过多重化疗的晚期乳腺癌患者显示出较好的疗效,且耐受性良好。白蛋白结合型紫杉醇与哪种药物联合治疗晚期乳腺癌最佳,到目前为止尚未可知。但鉴于从多项临床研究的乐观的结果,将来它可能直接取代传统紫杉类药物的地位,应用于各种已经经过证明了的联合治疗方案。当然,在这一领域还要进行更进一步的探索。
[参考文献]
[1] PICCART-GEBHART M J, BURZYKOWSKI T, BUYSE M, et al. Taxanes alone or in combination with anthracyclines as first-line therapy of patients with metastatic breast cancer[J]. J Clin Oncol, 2008, 26:1980-1986.
[2] SPARANO J A, WANG M, MARTINO S, et al. Weekly paclitaxel in the adjuvant treatment of breast cancer[J]. N Engl J Med, 2008, 358:1663-1671.
[3] HENDERSON I C, BERRY D A, DEMETRI G D, et al. Improved out-comes from adding sequential paclitaxel, but not from escalating doxorubicin dose in an adjuvant chemotherapy regimen for patients with node-positive primary breast cancer[J]. J Clin Oncol, 2003, 21:976-983.
[4] IBRAHIM N K, DESAI N, LEGHA S, et al. Phase Ⅰ and pharmacokinetic study of ABI-007, a Cremophor-free, protein-stabilized, nanoparticle formulation of paclitaxel[J]. Clin Cancer Res, 2002, 8(5): 1038-1044.
[5] NYMAN D W, CAMPBELL K J, HERSH E, et al. Phase Ⅰand pharmacokinetics trial of ABI-007, a novel nanoparticle formulation of paclitaxel in patients with advanced nonhematologic malignancies[J]. J Clin Oncol, 2005, 23(31):7785-7793.
[6] MONTERO A J, ADAMS B, DIAZ-MONTERO C M, et al. Nab-paclitaxel in the treatment of metastatic breast cancer: a comprehensive review[J]. Expert Rev Clin Pharmacol, 2011, 4(3):329-334.
[7] GIANNI L, KEARNS C M, GIANI A, et al. Nonlinear pharmacokinetics and metabolism of paclitaxel and its pharmacokinetic/pharmacodynamic relationships in humans[J]. J Clin Oncol, 1995, 13(1):180-190.
[8] SEIDMAN A D, CONLIN A K, BACH A, et al. Randomized phase Ⅱ trial of weekly vs every 2 weeks vs every 3 weeks nanoparticle albumin-bound paclitaxel with bevacizumab as first-line chemotherapy for metastatic breast cancer[J]. Clin Breast Cancer, 2013, 13(4):239-246.
[9] GRADISHAR W J, TJULANDIN S, DAVIDSON N, et al. Phase Ⅲ trial of nanoparticle albumin-bound paclitaxel compared with polyethylated castor oil-based paclitaxel in women with breast cancer[J]. J Clin Oncol, 2005, 23(31):7794-7803.
[10] GRADISHAR W J, KRASNOJON D, CHEPOROV S, et al. Significantly longer progression-free survival with nabpaclitaxel compared with docetaxel as first-line therapy for metastatic breast cancer[J]. J Clin Oncol, 2009, 27(22): 3611-3619.
[11] GRADISHAR W J, KRASNOJON D, CHEPOROV S, et al. Phase Ⅱ trial of nab-paclitaxel compared with docetaxel as first-line chemotherapy in patients with metastatic breast cancer: final analysis of overall survival[J]. Clin BreastCancer, 2012, 12(5): 313-321.
[12] BLUM J L, SAVIN M A, EDELMAN G, et al. Phase Ⅱstudy of weekly albumin-bound paclitaxel for patients with metastatic breast cancer heavily pretreated with taxanes[J]. Clin Breast Cancer, 2007, 7(11):850-856.
[13] 周淑玲, 杨文涛. 三阴性乳腺癌的临床病理特征及分子研究进展[J]. 中国癌症杂志, 2013, 23 (8): 603-608.
[14] DENT R, TRUDEAU M, PRITCHARD K I, et al. Triplenegative breast cancer: clinical features and patterns of recurrence[J]. Clin Cancer Res, 2007, 13:4429-4434.
[15] RAKHA E A, CHAN S. Metastatic triple-negative breast cancer[J]. Clin Oncol (R Coll Radiol), 2011, 23:587-600.
[16] HAMILTON E, KIMMICK G, HOPKINS J, et al. Nabpaclitaxel/bevacizumab/carboplatin chemotherapy in firstline triple negative metastatic breast cancer[J]. Clin Breast Cancer, 2013, 13(6):416-420.
[17] O’SHAUGHNESSY J, ROMIEU G, DIERAS V, et al. Metaanalysis of patients with triple-negative breast cancer (TNBC) from three randomized trials of first-line bevacizumab (BV) and chemotherapy treatment for metastatic breast cancer (MBC) (abstract) [J]. Cancer Res, 2010, 70 (suppl 2):P6-12-03.
[18] SACHDEV J C, SINDER J, SCHWARTZBERG L, et al. Interim results of weekly nanoparticle albumin bound (nab)-paclitaxel plus carboplatin followed by doxorubicin plus cyclophosphamide with concurrent bevacizumab for triplenegative breast cancer (abstract AB2013-2) [C]. National Comprehensive Cancer Network Annual Conference, Hollywood FL, March 2013.
[19] JACKISCH C, LÜCK HJ, UNTCH M, et al. Weekly nab-Paclitaxel in Metastatic Breast Cancer-Summary and Results of an Expert Panel Discussion[J]. Breast Care (Basel), 2012, 7(2):137-143.
[20] YARDLEY D A, RAEFSKY E, CASTILLO R, et al. Phase Ⅱstudy of neoadjuvant weekly nab-paclitaxel and carboplatin, with bevacizumab and trastuzumab, as treatment for women with locally advanced HER2+ breast cancer[J]. Clin Breast Cancer, 2011, 11(5):297-305.
[21] CIRUELOS E, JACKISCH C. Evaluating the role of nabpaclitaxel (Abraxane) in women with aggressive metastatic breast cancer[J]. Expert Rev Anticancer Ther, 2014, 14(5):511-521.
[22] GLÜCK S. nab-Paclitaxel for the treatment of aggressive metastatic breast cancer[J]. Clin Breast Cancer, 2014, 14(4):221-227.
[23] O’ SHAUGHNESSY J, G RADISHAR W J, BHAR P, et al. Nab-paclitaxel for first-line treatment of patients with metastatic breast cancer and poor prognostic factors: a retrospective analysis[J]. Breast Cancer Res Treat, 2013, 138:829-837.
DOI:10.3969/j.issn.1007-3969.2014.11.007
中图分类号:R737.9
文献标志码:A
文章编号:1007-3639(2014)11-0836-10
收稿日期:(2014-07-08 修回日期:2014-08-14)
通信作者:李惠平E-mail:huipingli2013@yahoo.com
Albumin-bound paclitaxel for treatment of patients with refractory metastatic breast cancer
LIANG Xu, LI Hui-ping, DI Li-jun, JIANG Han-fang, SONG Guo-hong, YAN Ying, WANG Chao-ying, SHAO Bin, LIN Xiao-lin (Key laboratory of Carcinogenesis and Translational Research (Ministry of Education), Department of Breast Oncology, Peking University Cancer Hospital & Institute, Beijing 100142, China)
Correspondence to: LI Hui-ping E-mail: Huipingli2013@yahoo.com
[Abstract]Background and purpose: Nab-paclitaxel (Abraxane) is an albumin-bound form of paclitaxel that utilizes the natural properties of albumin to improve paclitaxel delivery to the tumor. It has recently been approved for treatment of breast cancer after failure of combination chemotherapy for metastatic disease or relapse within short time after adjuvant chemotherapy. The purpose of this study was to evaluate the ef fi cacy and safety of albumin-bound paclitaxel in patients with aggressive and refractory metastatic breast cancer (MBC). Methods: A total of 58 patients with MBC were enrolled into this study from Jul. 2009 to Jan. 2014. All patients received albumin-bound paclitaxelbased chemotherapy. The adverse reactions were evaluated every cycle, and the short-term response was evaluated every two cycles. The patients were followed-up, and the survival was analyzed. Results: 58 patients with refractory MBC were evaluable for response, 67.2% of patients received multiple line (≥3 lines) chemotherapy, 32.8% of patients with first and second line of chemotherapy were involved metastasis within one year after adjuvant chemotherapy, 84.5% of patients with visceral metastasis and 93.1% with prior taxane treatment. The objective response rate (ORR) was 13.8%, and disease control rate (DCR) was 60.3%, the median progression free survival (PFS) was 4.0 months, and the overall survival (OS) was 10.1 months. For 23 patients with triple negative breast cancer, ORR was 13.0% and DCR was 56.5%, the median PFS was 4.1 months, and OS was 6.6 months. The main toxicity was myelosuppression (grades3 and 4 neutropenia, anemia and thombocytopenia were seen in 34.5%, 12.1% and 6.9% of patients, respectively), gastrointestinal reactions, sensory neuropathy, myodynia/arthragia, fatigue, alopecia and so on. Conclusion: The albumin-bound paclitaxel-based chemotherapy can be used in aggressive and refractory MBC. It also showed antitumor activity in taxanes-resistance patients and triple negative patients with good safety and tolerance.
[Key words]Refractory metastatic breast cancer; Albumin-bound paclitaxel; Effect; Safety

