乙型脑炎病毒基因组cDNA克隆在宿主菌中不稳定因子的初步研究
郑旭晨,郑 浩,郭亦非,刘 飞,梁 超,童 武,单同领,于 海,童光志
(中国农业科学院上海兽医研究所,上海 20041)
·研究论文·
乙型脑炎病毒基因组cDNA克隆在宿主菌中不稳定因子的初步研究
郑旭晨,郑 浩,郭亦非,刘 飞,梁 超,童 武,单同领,于 海,童光志
(中国农业科学院上海兽医研究所,上海 20041)
为了探求乙型脑炎病毒(Japanese encephalitis virus,JEV)基因组cDNA克隆在宿主菌中不稳定遗传的影响因子,本研究以猪源JEV HEN0701株基因组片段1~2913 bp为研究对象,分析基因组原核启动子和相关毒力基因在不稳定遗传中的作用。在5'端,分析片段中潜在的原核启动子序列,通过PCR扩增得到不同长度的cDNA片段;在3'端,通过内切酶酶切截断基因组prM蛋白或E蛋白编码区,获得3'末端不同的cDNA片段。将各片段克隆入pCR-BluntII-TOPO载体,转化大肠杆菌,于37℃条件下培养。结果显示,片段73~2913 bp、97~2913 bp、355~2913 bp及1~933 bp、1~1275 bp能够在转化菌中稳定遗传;含有其他片段39~2913 bp、54~2913 bp及1~1800 bp、1~1971 bp的重组细菌不能在37℃条件下生长;片段1~1600 bp虽然能够在转化菌中传代,但是出现不规律突变。以上结果表明:软件所预测各原核启动子片段中,基因组73~118 bp区域与cDNA克隆稳定性有关,且上游的54 bp至73 bp的序列对该区域启动子存在影响;在JEV基因组1275 bp至1600 bp之间可能存在毒性蛋白编码序列。
乙型脑炎病毒;遗传不稳定性;潜在启动子;毒性蛋白编码序列位置
乙型脑炎(Japanese encephalitis,JE)是由乙型脑炎病毒(Japanese encephalitis virus,JEV)引起的一种急性流行性病毒性脑炎。JEV为虫媒病毒,是黄病毒科黄病毒属(Flavivirus)成员,通过侵害中枢神经系统中的神经元细胞、星形胶质细胞和小胶质细胞引发病毒性脑炎[1]。人、猪、马和野生水禽均可感染。其中,猪为JEV最主要的扩大宿主,感染发病后,其临床症状表现为新生仔猪脑炎和种猪的繁殖障碍;水禽为JEV的携带宿主;人为JEV的终末宿主,特别是儿童,感染发病后,死亡率可高达25%,而50%的幸存者将发展为永久性脑炎后遗症,危害严重[2,3]。
反向遗传操作系统的建立是深入研究JEV的基础,但JEV cDNA克隆在宿主菌中具有遗传不稳定性,成为构建JEV cDNA的一大障碍,使得JEV反向遗传操作平台难以建成。其遗传不稳定性主要表现为载有病毒cDNA克隆的宿主菌株死亡,或者病毒cDNA克隆发生外源序列的插入和核苷酸的缺失[4,5]。人们对于病毒cDNA克隆无法稳定遗传的原因知之甚少,普遍认为,原因之一是病毒克隆所表达的基因产物对宿主菌具有毒性[5]。我们相信,JEV基因组cDNA克隆在宿主菌中稳定与否,与cDNA克隆在宿主菌中所表达的毒性蛋白以及调控该蛋白表达的启动子活性有关。因此,本研究选取基因I型猪源乙型脑炎病毒HEN0701株[6],以其基因组1~2913位核苷酸序列片段作为研究对象,寻找潜在启动子活性区及毒性蛋白编码序列在JEV基因组中的位置,以期找到稳定繁殖JEV重组质粒的方法,克服由于发生突变导致的JEV cDNA克隆不具备感染性的难点。
1 材料与方法
1.1菌株、毒株、质粒大肠杆菌TOP10感受态细胞,购自北京TIANGEN生物公司;猪源JEV基因I型HEN0701株,由中国农业科学院上海兽医研究所猪病实验室(以下简称本实验室)保存;质粒pTHENC1为将HEN0701株基因组1~2913位核苷酸克隆入pCR-BluntII-TOPO载体,其方法见文献[6]。
1.2 主要试剂LB固体培养基;LB液体培养基;卡那霉素;小量质粒快速提取纯化试剂盒和DNA凝胶回收试剂盒购自广州东盛生物科技有限公司;PfuUltraTMHotstart High-Fidelity DNA Polymerase购于Stratagene公司;pCR-BluntII-TOPO购自Invitrogen公司。
1.3 引物设计与合成使用软件Primer Premier 5.0,参照Genbank中HEN0701株基因组序列,设计引物(见表1),并由上海英骏生物技术公司合成。
1.4 寻找JEV基因组中可能具有原核启动子活性的序列区段利用Berkeley Drosophila Genome Project中的Neural Network promoter prediction软件(http://www. fruitfly.org/seq_tools/promoter.html)对HEN0701株1~2913位核苷酸序列进行分析,在线预测该段序列中具有原核启动子序列特征的序列区段。针对所预测序列区段设计引物, PCR扩增pTHENC1,获得具有不同5'端的cDNA片段,插入pCR-BluntII-TOPO载体,构建缺少JEV 基因组1~2913 bp片段5'端部分序列的重组质粒。转化E.coli TOP10感受态细胞中,于37℃培养,对长出的菌落,提取重组质粒并测序。
1.5 定点突变潜在的原核启动子序列利用软件The Mfold Web Server(http://mfold.rna.albany. edu/?q=mfold)对HEN0701株RNA二级结构进行在线分析,在不改变该二级结构的前提下,通过PCR定点突变的方法对潜在启动子活性区序列进行定点突变,得到突变质粒。将突变质粒转化大肠杆菌,观察细菌生长状况并测定克隆序列。
1.6 寻找毒性蛋白序列位置利用JEV及pCR-BluntIITOPO基因组中合适的酶切位点,以pTHENC1为模板,对JEV E蛋白和prM蛋白编码序列不同位置进行切割,剩余片段重新自连,构建缺少JEV 基因组1~2913 bp片段中3'端部分序列的克隆质粒,转化大肠杆菌TOP10,37℃培养,提取重组质粒测定克隆序列。

表1 引物序列Table 1 The sequence of the primers
2 结果
2.1 潜在原核启动子序列在JEV基因组中的位置在线分析结果显示,在JEV基因组1~2913位核苷酸序列中,评分在0.8分以上的可能具有原核启动子活性的序列共有7段,分别为73~118 bp、305~350 bp、1045~1090 bp、1330~1375 bp、1348~1393 bp、1695~1740 bp、2090b~2135 bp,命名为P1~P7(见表2)。根据P1~P7位置,PCR扩增pTHENC1,从HEN0701株5'端不同位置起始至2913 bp为止(分别为355~2913 bp、97~2913 bp、73~2913 bp、54~2913 bp、39~2913 bp),构建各重组质粒,分别命名为pTHENO355、pTHENO97、pTHENO73、pTHENO54、pTHENO39。将所构建的克隆质粒转化大肠杆菌TOP10,37℃培养。结果发现,pTHENO355、pTHENO97、pTHENO73能够在大肠杆菌中稳定遗传,而pTHENO54和pTHENO39转化大肠杆菌后转化菌不能生长(见表3)。可见,序列P1可能与cDNA克隆稳定性相关,其上游的 54~73 核苷酸序列对P1的活性存在影响。因此,对于pTHENO355和pTHENO97,P1的序列结构被破坏后,虽保持了所预测其他各潜在启动子序列结构的完整性,由于P1所控制的毒性蛋白的表达被阻碍,JEV基因组对宿主菌株的毒害作用减弱,JEV基因组得以稳定遗传;pTHENO54和pTHENO39所载目的序列则保持了P1序列结构的完整,P1控制对宿主菌有毒害作用的相关蛋白的表达,使得JEV基因组无法稳定遗传;而对于pTHENO73,虽具有完整P1序列结构,仍然不能稳定遗传,说明JEV基因组54~73 bp序列对P1的功能产生一定影响。

表2 潜在启动子预测结果Table 2 Predicted prokaryotic promoters within nt 1 to 2913 of the HEN0701 genome
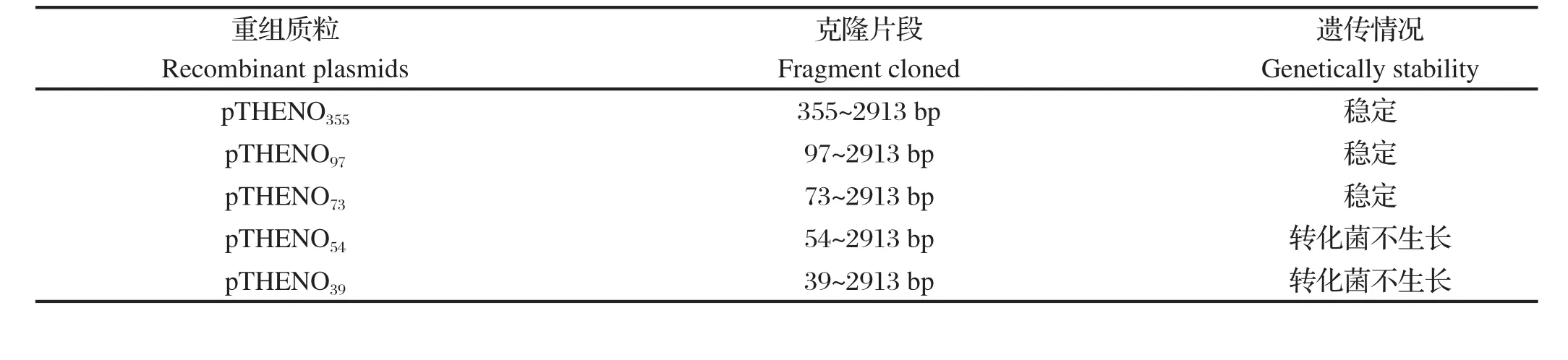
表3 缺少5'端部分序列的重组质粒在大肠杆菌中的遗传情况Table 3 Genetically stability of recombinant plasmids lacking sequences at 5'terminus in E.coli
2.2 PCR定点突变对JEV cDNA克隆稳定性有影响的序列区段根据RNA二级结构预测的结果,通过PCR定点突变的方法,在JEV 54~118 bp区段内富含A/U的区域选取位置进行定点突变。分别于66 bp及69 bp处同时做U-C及A-G突变、76 bp处做U-C突变、90 bp处做A-C突变、105 bp处做A-G突变,共构建了4种突变克隆(见图1),4种突变克隆都不能在E.coli中稳定遗传。据报道,Pu等[7]对JEV RP-9株基因组序列进行分析,预测出在JEV基因组中具有大肠杆菌启动子活性的序列区段,在该区段中90 bp处做A-C定点突变,结果发现,该突变可以有效降低大肠杆菌启动子活性,并成功构建出在37℃条件下能稳定在宿主菌中扩增的JEV全长感染性克隆。本研究对90 bp处进行A-C定点突变所获突变克隆质粒,转化 TOP10感受态细胞后,克隆在37℃条件下培养会于其他位置发生点突变,仍然不能稳定生长。这说明,90 bp处的突变不能影响本毒株cDNA克隆在E.coli中的遗传不稳定性。
2.3 毒性蛋白序列在JEV基因组中的位置在初步研究中发现,HEN0701株易于在E蛋白编码基因区域发生突变[13]。本研究利用JEV基因组和pCRBluntII-TOPO载体中合适的酶切位点,将pTHENC1中HEN0701序列的3'端部分序列切除,剩余片段自我连接成新的重组质粒。这些重组质粒分别携带有JEV基因组序列的1~933 bp、1~1275 bp、1~1600 bp、1~1800 bp、1~1971 bp片段,依次命名为:pTHENE933、pTHENE1275、pTHENE1600、pTHENE1800、pTHENE1971。将重组质粒转化大肠杆菌TOP10并在37℃条件下培养,测序结果表明,pTHENE933和pTHENE1275能够在37℃条件下于大肠杆菌中稳定遗传,而pTHENE1600、pTHENE1800、pTHENE1971转化大肠杆菌后,不能稳定遗传(见表4)。这说明,在1275~1600 bp之间可能存在毒性蛋白编码序列。在1600 bp下游进行的酶切反应没有破坏JEV基因组中的毒性蛋白基因,因此对毒性蛋白的表达没有影响,毒性蛋白毒害宿主菌,导致JEV cDNA不具备遗传稳定性。而在1275 bp上游进行的酶切反应,破坏了3'端毒性蛋白编码序列的结构,使得JEV基因组对大肠杆菌的毒害作用减弱,保证了宿主菌的正常生长和JEV基因组的稳定遗传。
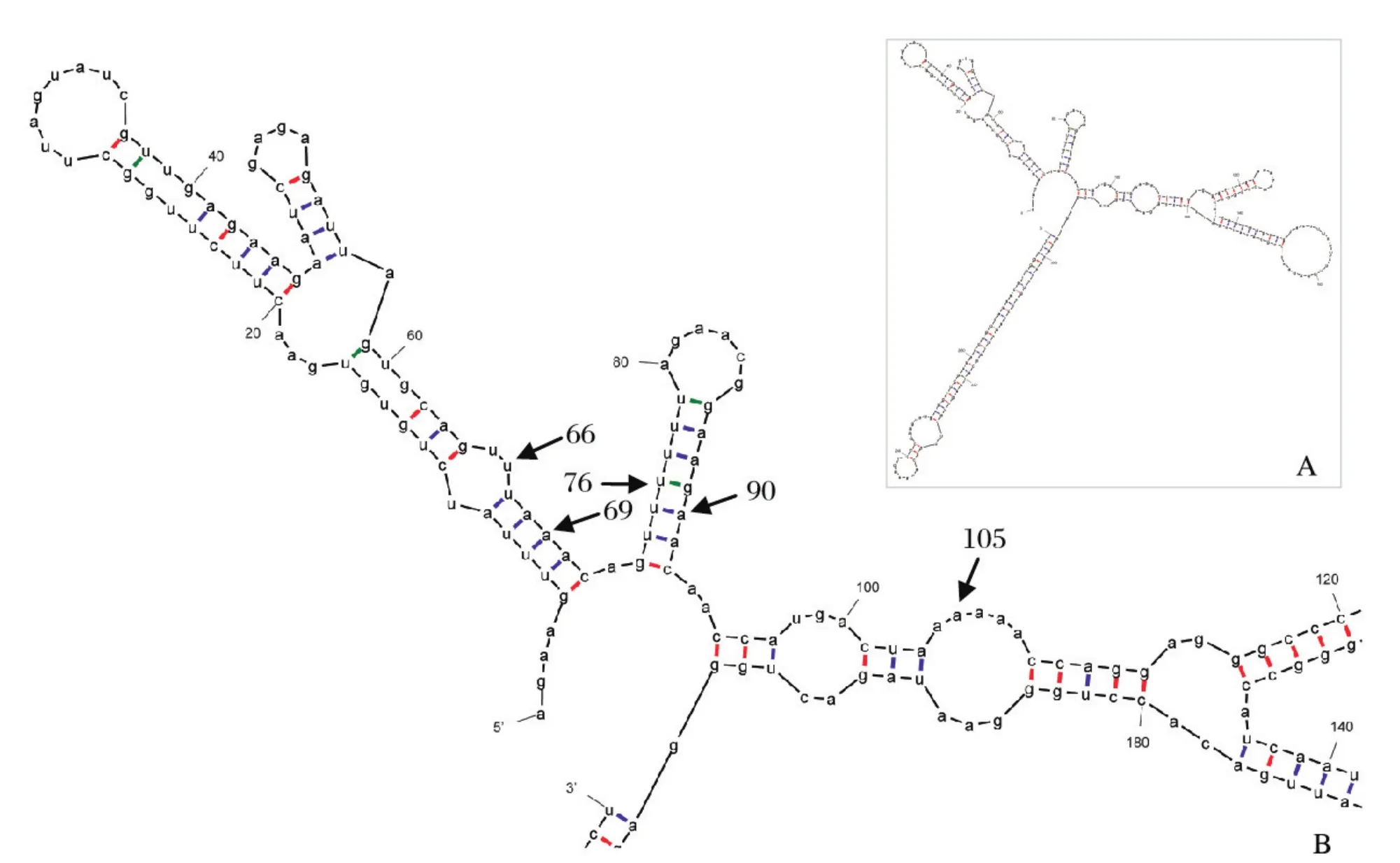
图1 JEV HEN0701 RNA二级结构整体示意图(A)及主要研究区域示意图(B)Fig.1 Modelled RNA structure for global (A) and local (B) of JEV HEN0701 strain
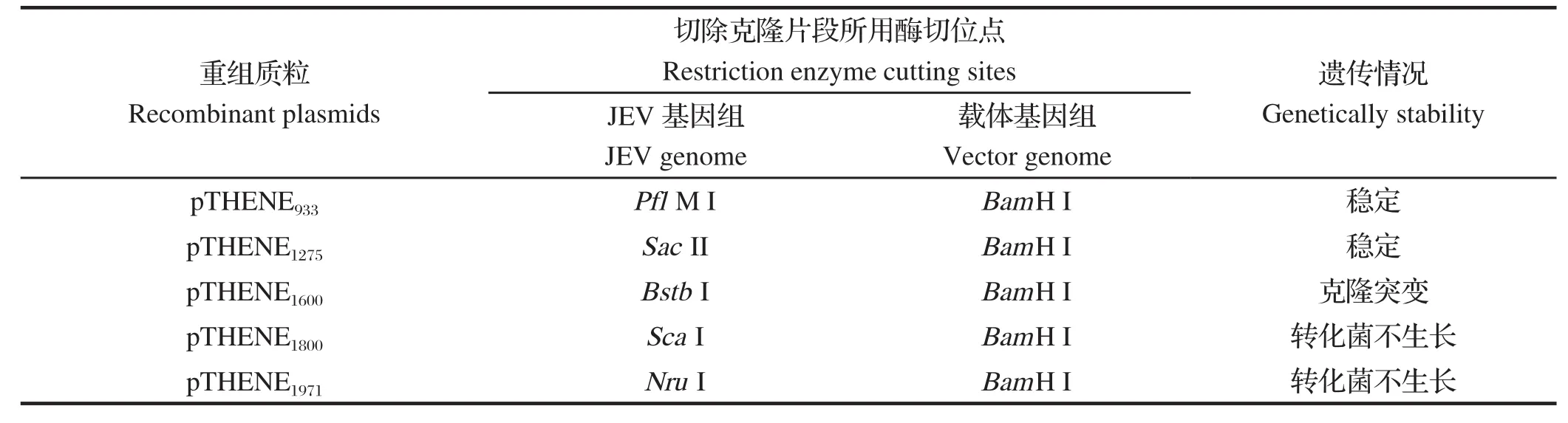
表4 缺少3'端部分序列的重组质粒在大肠杆菌中的遗传情况Table 4 Genetically stability of recombinant plasmids lacking sequences at 3'terminus in E.coli
3 讨论
在亚洲,每年有133 000以上的儿童患有急性脑炎综合征(acute encephalitis syndrome,AES),其中1/4为乙型脑炎患者[8]。猪可以迅速复制JEV并表现出极强的病毒血症,在JEV传播过程具有重要作用。特别在近几十年来,猪的集约化工业化养殖得到大力发展(如中国、缅甸、泰国、越南),使得JEV传播在密集化猪群中产生放大效应,加大了JEV传播的风险,这成为人感染JEV的主要因素[9],因此对猪乙型脑炎病毒进行深入研究意义重大。
本次研究对象HEN0701株为猪源GI型JEV,在对其进行分段克隆过程中,发现1~2913位核苷酸序列在大肠杆菌中最易发生突变,因此选取这一段进行cDNA克隆不稳定因子的研究。我们认为,影响JEV cDNA克隆稳定性的因素有以下三点:第一,宿主菌株和培养温度等外界因素对cDNA克隆的影响;第二,JEV基因组中极易发生插入、缺失和点突变的位置实为JEV序列高变区,是序列自身特性决定了其cDNA克隆难以稳定遗传;第三,JEV基因组具有能在宿主菌中发挥启动子活性的序列,能够启动某些对宿主菌株有毒害作用的JEV蛋白的表达。在研究初期,我们排除了外因的影响,认为宿主菌株对cDNA克隆稳定性的影响不显著,低温培养可以克服克隆序列的不稳定[4]。同时,PCR扩增除5'UTR以外的连续序列,即97~2913 bp序列片段,该片段包含极不稳定的序列区域,所构建的重组质粒能够在宿主菌中稳定遗传,这否定了高变区存在于JEV基因组中的可能性。因此认为,JEV基因组中具有原核启动子活性的序列可能对cDNA克隆的稳定性具有影响。
研究表明,在JEV基因组1~2913 bp序列中,包含有具有原核启动子序列特征的序列。经过对这些序列的研究,我们筛选出对cDNA克隆稳定性存在影响的序列为所预测的第一段潜在原核启动子序列,即73~118 bp序列,上游54~73 bp对该序列的功能有影响。因此,针对该区段进行定点突变,期望在不改变RNA二级结构的基础上,降低所预测的潜在启动子的活性,以达到稳定克隆的目的。分析发现,在此段序列中具有富含A/U区域,相信这些特殊区域对序列发挥启动子功能具有重要意义。在这些区域中选取位置进行突变,却没有取得预期结果,说明这些位置对克隆的稳定性没有影响。另外,我们在E蛋白编码区中找到了毒性蛋白的序列位置在1297~1600 bp之间。本研究为后续反向遗传操作系统的构建奠定了一定的研究基础。
[1] Thongtan T, Cheepsunthorn P, Chaiworakul V, et al. Highly permissive infection of microglial cells by Japanese encephalitis virus: a possible role as a viral reservoir[M]. Microbes Infect, 2010, 12 (1): 37-45.
[2] Wang H, Li Y, Liang X, et al. Japanese encephalitis in mainland China[J]. Jpn J Infect Dis, 2009, 62(5): 331-336.
[3] van den Hurk A F, Ritchie S, Mackenzie J S. Ecology and geographical expansion of Japanese encephalitis virus[J]. Annu Rev Entomol, 2009, 54 : 17-35.
[4] 郑旭晨, 郑浩, 童武, 等. 宿主菌株及培养温度对乙型脑炎病毒cDNA克隆稳定性的影响[J]. 中国动物传染病学报, 2013, 21(5): 27-33.
[5] 黄耀伟, 李龙, 于涟. 人类及动物RNA病毒的反向遗传系统[J]. 生物工程学报, 2004, 20(3): 311-318.
[6] 郑浩, 孙春清, 袁世山. 猪源乙型脑炎病毒HEN0701 株全基因组的分子特征[J]. 中国兽医科学, 2011, 41(5): 441- 447.
[7] Pu S Y, Wu R H, Yang C C, et al. Successful propagation of flavivirus infectious cDNAs by a novel method to reduce the cryptic bacterial promoter activity of virus genomes[J]. J Virol, 2011, 85(6): 2927-2941.
[8] Griffiths M J, Lemon J V, Rayamajhi A, et al. The functional, social and economic impact of acute encephalitis syndrome in Nepal-a longitudinal follow-up study[J]. PLoS Negl Trop Dis, 2013, 7(9): e2383.
[9] Le Flohic G, Porphyre V, Barbazan P, et al. Review of climate, landscape, and viral genetics as drivers of the Japanese encephalitis virus ecology[J]. PLoS Negl Trop Dis, 2013, 7(9): e2208.
PRELIMINARY STUDY ON GENETIC INSTABILITY OF JAPANESES ENCEPHALITIS VIRUS CDNA CLONE TRANSFORMED IN ESCHERICHIA COLI
ZHENG Xu-chen, ZHENG Hao, GUO Yi-fei, LIU Fei, LIANG Chao, TONG Wu, SHAN Tong-ling, YU Hai, TONG Guang-zhi
(Shanghai Veterinary Research Institute, CAAS, Shanghai 20041, China)
In the present study, a series of fragments from 1 to 2913 bp were generated from Japanese encephalitis virus (JEV) HEN0701genome in order to explore factors affecting genetic instability of cDNA clone when propagated in E. coli. These cDNA fragments were obtained using either PCR starting at 5' terminus or restriction enzyme digestion at different positiosn of 3' terminus. Each fragment was cloned into pCR-BluntII-TOPO vector and transformed into E. coli cultures, then were incubated at 37℃. Fragments 73 to 2913 bp, 97 to 2913 bp, 355 to 2913 bp and 1 to 933 bp, 1 to 1275 bp showed stability during passages of the transformed bacteria. However, recombinant bacteria containing fragments of 39 to 2913 bp, 54 to 2913 bp and 1 to 1800 bp, 1 to 1971 bp did not grow at 37℃. In addition, fragment 1 to 1600 bp of JEV genome was passaged in transformed bacteria but mutation occurred. The above results indicated that the fragment 73 to 118 bp affected the stability of JEV cDNA clone. The upstream sequences at 54 to 73 bp might be involve in this process as well. The results also suggest that toxic protein coding sequence might exist between 1275 to 1600 bp of JEVgenome.
Japanese encephalitis virus (JEV); genetic instability; potential prokaryotic promoter; toxic protein coding sequence position
S852.659.6
:A
:1674-6422(2014)04-0017-06
2014-01-14
上海市自然基金项目(11ZR1446200);国家自然基金青年基金项目(31201917);上海市重点科技攻关项目(09391910800);中央级公益性科研院所基本科研业务费项目(2012JB08)
郑旭晨,女,博士研究生,预防兽医学专业
童光志,E-mail:gztong@shvri.ac.cn

