口蹄疫病毒前导蛋白的分子生物学研究进展
张 萌,白兴文,李平花,范朋举,包慧芳,孙 普,卢曾军,曹轶梅,刘在新
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 国家口蹄疫参考实验室 农业部畜禽病毒学重点开放实验室,兰州 730046)
口蹄疫病毒前导蛋白的分子生物学研究进展
张 萌,白兴文,李平花,范朋举,包慧芳,孙 普,卢曾军,曹轶梅,刘在新
(中国农业科学院兰州兽医研究所 家畜疫病病原生物学国家重点实验室 国家口蹄疫参考实验室 农业部畜禽病毒学重点开放实验室,兰州 730046)
口蹄疫病毒(Foot-and-mouth disease virus ,FMDV)编码的前导蛋白,不仅是一个重要的蛋白酶,而且对于病毒来说是一个重要的毒力因子,其能够作用于宿主细胞的特异性蛋白,抵抗宿主细胞所产生的抗病毒效应。本文章简述了口蹄疫病毒前导蛋白酶的基本特性,例如前导蛋白的基因结构与病毒复制的关系,前导蛋白酶活性的具体特点,以及前导蛋白影响病毒毒力的分子机制。
口蹄疫病毒;前导蛋白;先天性免疫
口蹄疫病毒(Foot-and-mouth disease virus, FMDV)属于小RNA病毒科,口蹄疫病毒属的一个成员,是引起口蹄疫的主要病原。该病是一种急性烈性高度传染性疾病,主要感染猪、牛、羊等偶蹄动物[1]。FMDV分为O、A、C、Asia1、 SAT1、SAT2、SAT3七种血清型[2],并且每种血清型有很多亚型。FMDV为单链正链RNA病毒,全长8500 nt左右,由一个长的5'端非编码区(untranslated regions,5'UTR),一个开放阅读框(open reading frame,ORF),一个多聚腺嘌呤核糖核酸(PloyA)尾巴组成。FMDV进入宿主细胞后,直接利用宿主细胞的翻译机器,首先翻译为一个长的多肽链,在病毒编码的蛋白酶(Lpro、2A、3C)的作用下,加工成14种蛋白和其前体蛋白,这14种蛋白分别是10种非结构蛋白(Lpro、2A、2B、2C、3A、3B1、3B2、3B3、3Cpro、3Dpol)和4种结构蛋白(VP1、VP2、VP3、VP4)组成[3](如图1所示)。其中非结构蛋白基因L位于其ORF的5'端,为第一个被翻译的基因。正是由于其是第一个被翻译的基因,所以其在FMDV复制和毒力方面起着至关重要的作用。FMDV可以从两个可变的起始密码子(AUG)起始翻译,所以有两种形式的Lpro(Lab和Lb);Lab从第一个AUG开始翻译,而Lb从第二个AUG开始翻译,一般情况下,两个AUG相距84 nt[4],现在一致认为通过核糖体扫描的方式选择两个不同的起始密码子起始病毒的翻译。细胞内存在两种形式的Lpro,既然功能相同,但是为什么在FMDV感染的细胞里存在两种形式的Lpro还不是很清楚。
根据病毒血清型的不同,Lab的长度在199~202 nt[5]。两种形式的Lpro都存在于病毒感染的细胞里,以Lb占多数[6,7],目前来说,两种形式的L蛋白功能是相同的。所有的病毒,能够在宿主细胞中完成其生命周期,其一定存在某种抗细胞反应机制,在本篇综述里,主要介绍FMDV通过编码的Lpro与细胞的相互作用,来完成其抗细胞防御反应的研究进展。
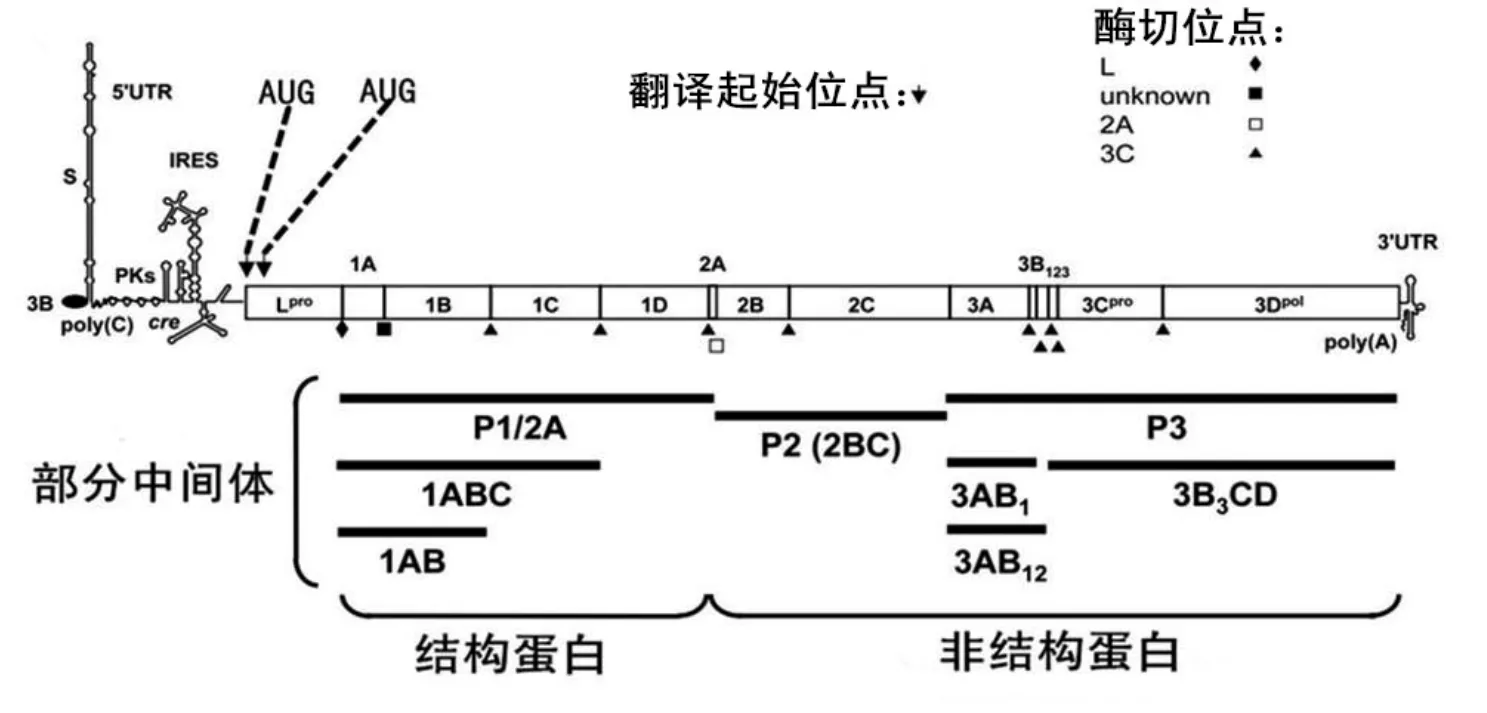
图1 口蹄疫病毒基因组结构示意图Fig.1 The genome structure diagram of FMDV
1 Lpro的基因结构与病毒复制的关系
Lpro作为非结构蛋白,但是其基因组具有较高的易变性,尤其是两个起始密码子之间的区域,尽管其序列变异性较大,但是在该区域内的RNA二级结构相对不变[8],推测该结构可能参与病毒翻译的起始;并且序列长度保守性很强,两个起始密码子的位置也非常保守。当两个起始密码子中加入一个长达57 nt的转位子后,其毒力下降,在该嵌合突变病毒中分别插入两个表位(HA和Flag)或者一个四个半胱氨酸基序(CCGPCC),这些突变病毒都表现出小的蚀斑形态,在这些嵌合病毒中,要么不表达Lab蛋白,要么Lab蛋白的表达量严重下降,但是这些嵌合病毒毒力下降的根本原因还不是很清楚[9]。
在构建Lpro缺失型cDNA克隆时(如图2所示),必须保留两个起始密码子及其之间的序列,病毒才能够被拯救,这表明两起始密码子之间的区域可能与细胞内调控翻译的因子相互作用;但是只缺失两个起始密码子之间区域的序列,可以拯救到完整的活病毒粒子,只是其病毒的复制水平相对于未缺失的原毒有所下降。完全缺失L蛋白基因序列不能够拯救到活的病毒粒子,但是单纯缺失Lb区域或者两个起始密码子之间的序列能够拯救到活的病毒粒子,表明L蛋白的编码序列能够影响病毒复制[10],但是其影响病毒复制的分子机制还不是很清楚。
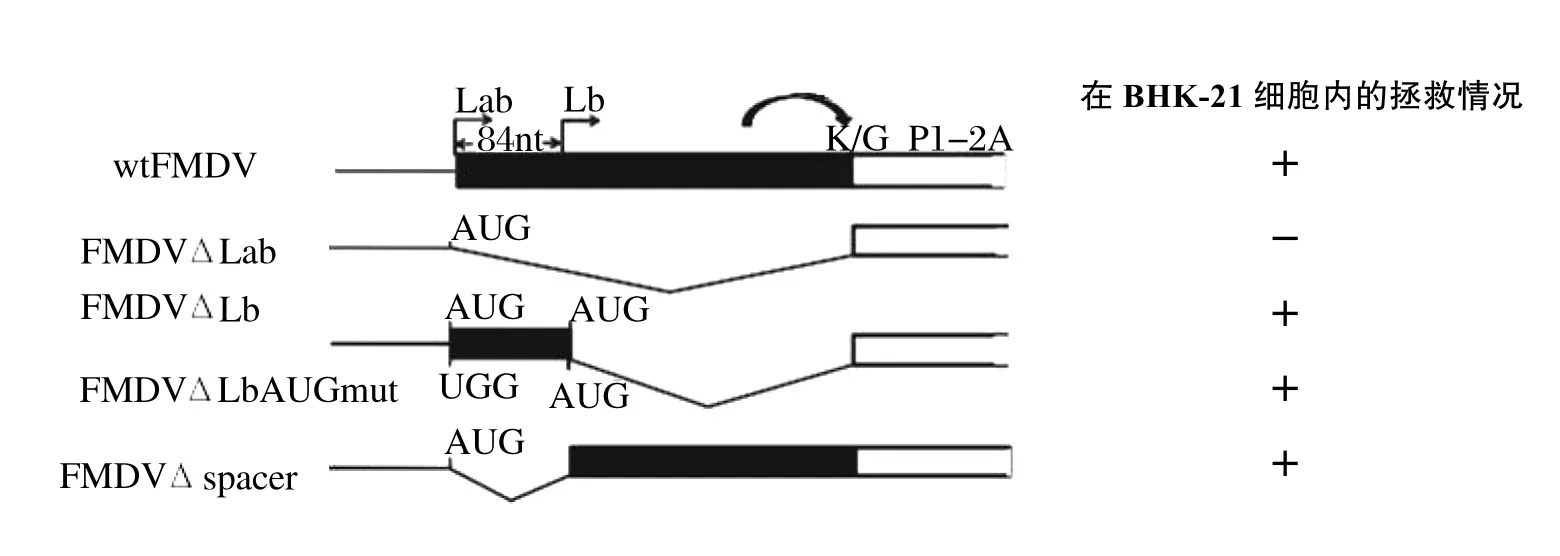
图2 不同L蛋白缺失型感染性克隆示意图及其在BHK-21细胞内被拯救的情况Fig.2 Different Foot and mouth disease virus leader protein deleted infectious clone and the situation of its rescue in BHK-21
2 Lpro的蛋白酶特性
序列比对研究表明Lpro是木瓜蛋白酶样的半胱氨酸蛋白酶,其他研究(蛋白酶抑制剂,基因工程,X-射线衍射技术)也均都证明L蛋白是一种木瓜蛋白酶样的蛋白酶。像其他木瓜蛋白酶样半胱氨酸蛋白酶一样,Lpro也具有典型的α螺旋和β折叠结构域,唯一不同的是Lpro拥有一个突出于球状结构的C末端(C-terminal extension,CTE)。酶活性中心由C51和H148组成的裂口组成,通过对Lpro结构分析表明,Q146和E147可能做为底物结合位点(S1')能够与底物eIF4GI酶切位点的R(P1')相互作用,引起eIF4GI的切割[11](如图3所示)。
Lpro至少有两种特征性活性,一种是它能够自身从病毒编码的多肽链L蛋白N端与1A蛋白C切割下来,通过顺式作用或者反式作用来实现自身切割[12,13];Lpro的另一种活性是其能够切割宿主细胞中翻译起始因子eIF4GI和eIF4GII,关闭宿主帽子依赖的翻译,而病毒RNA存在内部核糖体进入位点(internal ribosome entry site,IRES),不需要完整的eIF4G,所以病毒蛋白翻译不受影响(如图4所示)。Lpro切割效率在eIF4G结合eIF4E情况下,比单独切割eIF4G时高。Lpro的表达能够抑制宿主蛋白合成,这对于病毒抵抗细胞防御反应是非常重要的,研究发现在FMDV感染的细胞内,能够抑制干扰素合成,从而减弱宿主细胞的抗病毒反应[14]。
David[15]证实FMDV的Lpro能够酶切细胞的RNA结合蛋白Gemin5,这有助于细胞的基因失活。Lpro也能够切割真核细胞的细胞周期素,但是在FMDV感染的细胞里,Lpro切割细胞周期素对于FMDV复制是否有影响知之甚少。最近Rod rí guez Pulido[16]研究表明,在FMDV感染的细胞里,PloyA结合蛋白(PloyA binding protein,PABP)和聚嘧啶结合蛋白(Ploypyrimidine tract-binding protein,PTB)的翻译起始因子eIF3(eIF3a和eIF3b)都能被病毒编码的蛋白酶切割,但这个过程是否有其他蛋白参与还有待于进一步研究。
Lpro在病毒编码的多肽链Q-R-K-L-K↓G-AG-Q 处实现自身切割,若P2位Leu变为Phe或Met,自身切割受到阻碍,而Leu变为Ala又能实现自身切割;在 F-A-N-L-G ↓ R-T-T-L 处切割eIF4GI,在L-L-N-V-G↓S-R-R-S处切割eIF4GII[17-19]。通过对Gemin5的分析表明,Lpro能识别(R)(R/K)(L/A)(R)基序[15]。以上仅有的几处切割反应表明,Lpro是一个特异性蛋白酶,但是,仅仅从这几处切割反应,我们不能够确定Lpro特异性切割位点。经过序列比对表明所有血清型Lpro第143位为Leu或者Met,Christina Mayer[20]表明第143位的Leu对底物的识别有重要作用;Lpro识别eIF4GI氨基酸残基在645~657 aa;Lpro起催化作用的区域存在于其C端的183~195 aa;第184位的Asp和186位的Glu在所有病毒中高度保守,这两个氨基酸的突变,影响对eIF4GI的结合和切割,而对自身切割没有影响[21];除此之外164位Asp突变会严重影响Lpro对eIF4G的酶切活性,由此表明164D对Lpro发挥蛋白酶活性至关重要[22](关键性位点如图3所示)。
3 Lpro影响病毒的毒力
利用基因工程缺失L基因的FMDV相比野生型FMDV表现出微弱的细胞病变反应,缺失L基因的A12 FMDV感染牛不能够从感染部位传播到全身,而且更不能传给其他动物,表明L蛋白与病毒毒力有关。
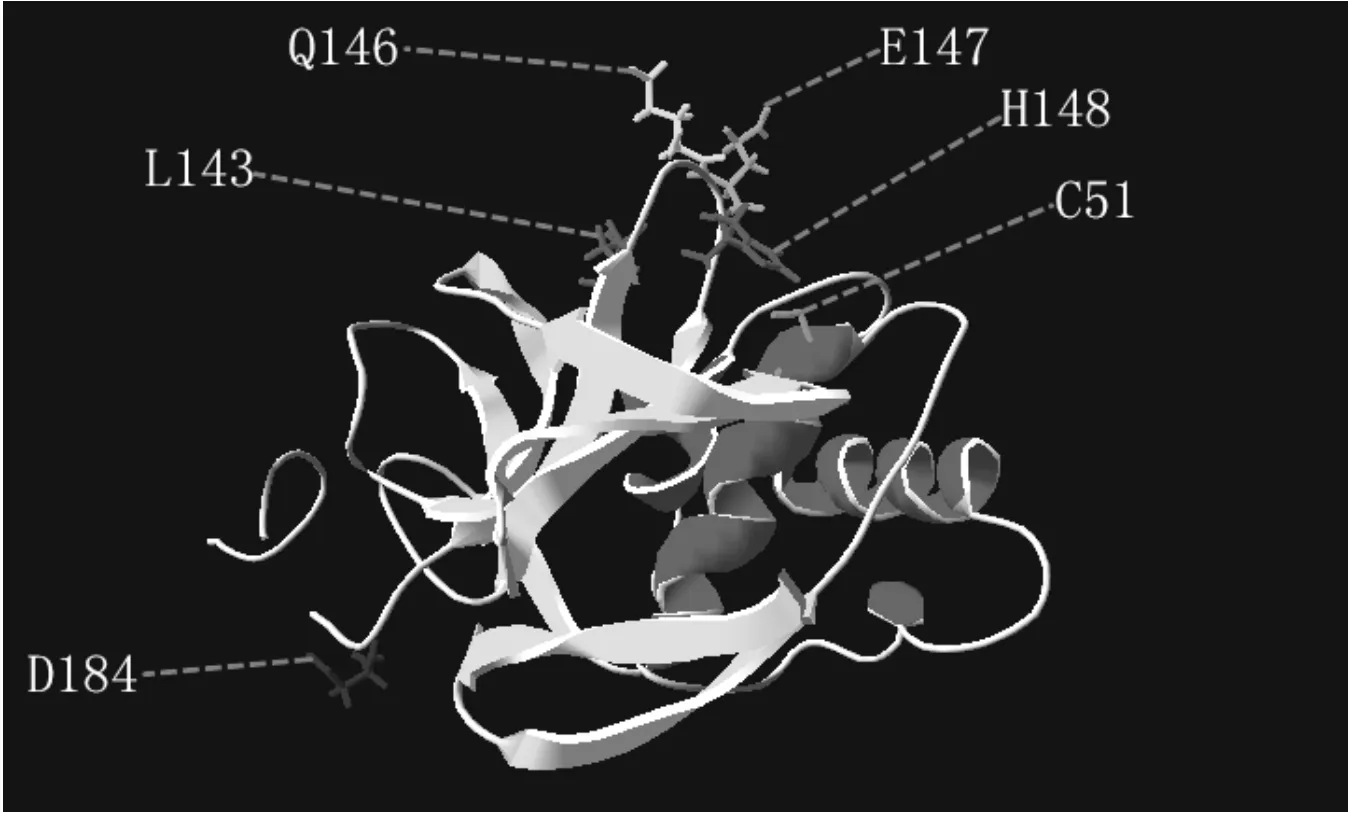
图3 L蛋白的高级结构及关键性氨基酸Fig.3 The tertiary structure of leader protein and its critical amino acid
病毒与宿主细胞的相互作用是复杂的,其中,FMDV编码的Lpro在抗宿主先天性免疫方面发挥着重要作用,包括转录水平和翻译水平。Lpro通过切割宿主的eIF4G,关闭宿主帽子依赖的翻译,影响细胞因子的翻译和主要组织相容性复合体(major histocompatibility complex,MHC)的表达,在机体产生抗病毒反应之前,快速利用宿主的原料合成出大量的子代病毒。
Lpro主要通过阻碍宿主细胞的先天性免疫使FMDV获得较高的毒力。L蛋白降解宿主细胞内的转录调控因子NF-kB[23],干预IRF3/7的活性[24],影响细胞因子的转录,能够显著降低I型干扰素IFNβ[14]、III型干扰素IFNγ1[25]、趋化因子RANTES[26]的转录水平和表达水平(如图4所示)。在FMDV感染的PK细胞里,IFN表达被抑制,但是在FMDV感染的pDC中,能够分泌IFN,FMDV是通过什么具体途径来抑制这些细胞因子的活性,目前来说还不是很清楚。病毒进入细胞后,通过细胞内的RLR受体(retinoic acid-inducible gene I,RIG-1和melanoma differentiation-associated gene-5,MDA5)识别病毒的病原相关分子模式(pathogen associated molecular patterns,PAMPs),经过一系列的信号转导,激活转录因子NF-kB和IRF3/7,从而引起IFN基因和RANTES基因的转录,IFN表达后,通过自分泌或者旁分泌的方式与细胞表面的IFN受体结合,进一步引起IFN刺激基因(interferonstimulated genes,ISGs)的表达,主要是双链RNA依赖的蛋白激酶,RNaseL,这些表达产物能够抑制病毒的复制。而FMDV表达Lpro能够通过抑制NF-kB和IRF3/7的活性,进而抑制ISGs的表达,使其逃逸宿主细胞的抗病毒防御反应机制。野生型和缺失L基因的口蹄疫病毒感染没有IFN受体的细胞,因为L蛋白能够关闭宿主细胞的翻译,所以说野生型病毒感染后应该拥有更多的原料来复制,根据已有的知识来说,野生型病毒复制速度应该快于缺失L基因的病毒,但是实验发现,两者的复制速度相当,为什么会出现这种情况,目前来说还不是很清楚。最近研究表明,泰勒氏病毒(Theiler's virus)能够直接与RNase L相互作用,抑制干扰素诱导的OAS/RNase L信号通路,从而逃逸宿主细胞的先天性免疫抗病毒作用[27]。
Lpro在细胞质中表达后,并不是在细胞中均匀分布,而是首先进入细胞核,随后才出现在细胞质中[28]。FMDV感染细胞后,能够激活NF-kB,随后激活的NF-kB进入细胞核,而进入细胞核的Lpro能够降解激活的NF-kB,但是其降解机制还不明确。经过生物信息学预测,并经过实验证实,Lpro存在一个保守的区域SAP(for SAF-A/B,Ainus and PIAS),其位于Lb蛋白的47 ~83 aa,在某些情况下,该结构域与存在于细胞核中的转录调控因子相联系。如果SAP区域内发生突变,病毒的毒力将会下降,因为细胞核中不出现Lpro,细胞核中的NF-kB也没有被降解[29]。
4 Lpro的去泛素化活性
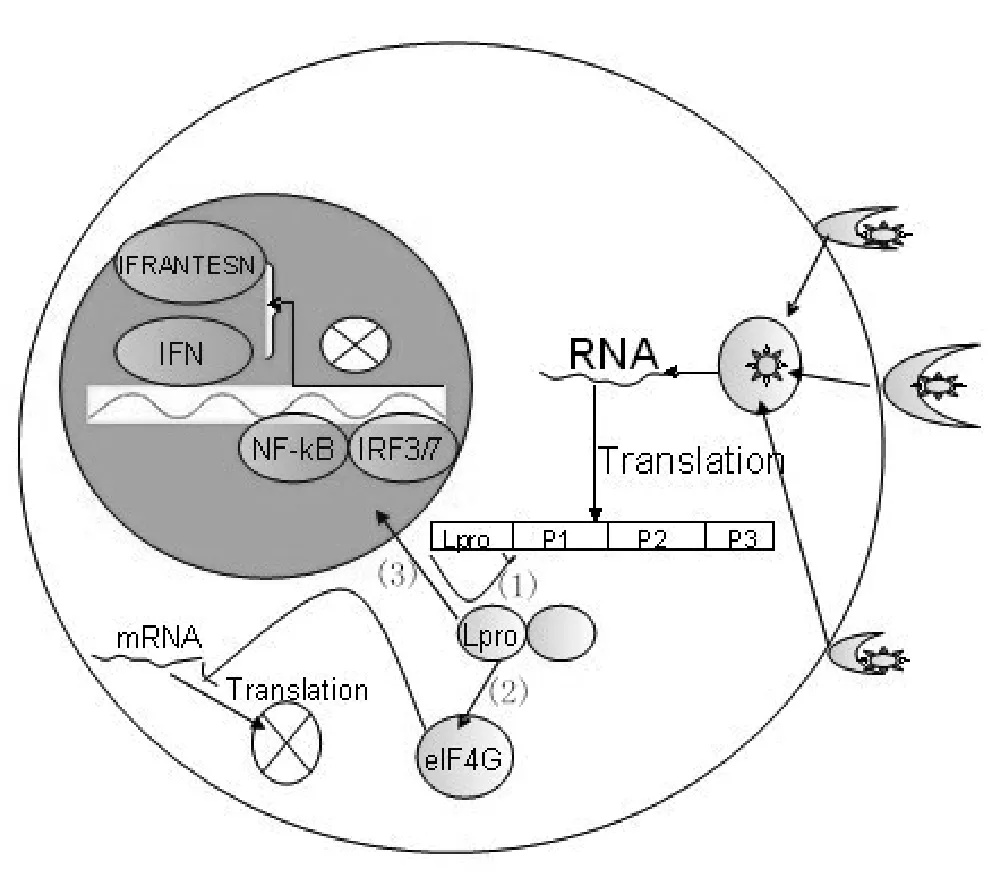
图4 口蹄疫病毒与宿主细胞相关作用示意图Fig.4 The diagram of FMDV interaction with host cell
经过生物信息学序列比对和结构分析表明,两个催化残基(Cys51 和 His148)在FMDV所有的七个血清型Lb蛋白存在两个高度保守,FMDV Lpro的拓扑型与细胞内的泛素特异性蛋白酶14(USP14),非典型性肺炎病毒(SARS-CoV)的木瓜蛋白酶样蛋白酶(papain-like protease,PLpro)非常相似,这两个酶都具有去泛素化活性。体外表达的Lpro和体内转录的Lpro都能对细胞内的lysine-48或者63相连的多聚泛素化链进行去泛素化处理。而且Lpro还能抑制细胞内对I型IFN起激活作用的信号分子的泛素化,这些信号分子包括视磺酸诱导的基因I(retinoic acid-inducible gene I,RIG-I)、TANK(TRAF family member associated NF-kB binding kinase)结合的激酶1(TANK binding kinase-1,TBK1)、肿瘤坏死因子受体结合的因子6和3(tumor necrosis factor receptor-associated factor,TRAF6/TRAF3)。如果突变催化活性位点(C51A 或者 D163N/D164N)或者SAP区域(I83A/L86A)将废止其去泛素化活性或者其阻止β-IFN表达的活性[30]。
5 FMDV通过Lpro作用抗机体的适应性免疫
体内感染的FMDV进入初级细胞后,L蛋白通过关闭宿主帽子依赖的翻译,抑制MHCⅠ类分子的翻译,进而影响病毒蛋白的递呈以及NK、NKT和CTL的识别,使感染病毒的细胞得以存活,从而给病毒复制留有空间,逃逸宿主细胞的先天性免疫[31]。
6 展望
FMDV Lpro作为一个蛋白酶,现在已经发现其能够切割宿主细胞内个别的蛋白,能否切割其他底物还有待于进一步研究。FMDV能够通过其编码的L蛋白抗宿主的先天性免疫反应,这已经是一个不争的事实,但是还需要借助细胞生物学等方法进一步剖析其完成抗宿主先天性免疫反应的具体过程,这将有助于深入了解FMDV致病的分子机理,除此之外,还有助于推进免疫学、细胞生物学的研究进程。
口蹄疫作为一个危害重大的传染病,一旦发病,能造成严重的经济损失,现在各国都在努力控制并且清除该病的发生。研究口蹄疫病毒的致病分子机理,尤其是研究L蛋白抗宿主免疫反应的分子机理,有助于研究新型高效疫苗,来达到控制并且最终清除该病的目标。
[1] Grubman M J, Baxt B. Foot-and-mouth disease[J]. Clin Microbiol Rev, 2004, 17(2): 465-493.
[2] Knowles N J, Samuel A R. Molecular epidemiology of foot-and-mouth disease virus[J]. Virus Res, 2003, 91(1): 65-80.
[3] Rueckert R R. Picornaviridae: the viruses and their replication[J]. Fields Virol, 1996, 1: 609-654.
[4] Cao X, Bergmann I E, Füllkrug R,et al. Functional analysis of the two alternative translation initiation sites of foot-and-mouth disease virus[J]. J Virol, 1995, 69(1): 560-563.
[5] Carrillo C, Tulman E R, Delhon G,et al. Comparative genomics of foot-and-mouth disease virus[J]. J Virol, 2005, 79(10): 6487-6504.
[6] Clarke B E, Sangar D V, Burroughs J N,et al. Two initiation sites for foot-and-mouth disease virus polyprotein in vivo[J]. J Gen Virol, 1985, 66(12): 2615-2626.
[7] Sangar D V, Newton S E, Rowlands D J,et al. All foot and mouth disease virus serotypes initiate protein synthesis at two separate AUGs[J]. Nucleic Acids Res, 1987, 15(8): 3305.
[8] Carrillo C, Tulman E R, Delhon G,et al. Comparative genomics of foot-and-mouth disease virus[J]. J Virol, 2005, 79(10): 6487-6504.
[9] Piccone M E, Segundo F D S, Kramer E,et al. Introduction of tag epitopes in the inter-AUG region of foot and mouth disease virus: effect on the L protein[J]. Virus Res, 2011, 155(1): 91-97.
[10] Belsham G J. Influence of the Leader protein coding region of foot-and-mouth disease virus on virus replication[J]. J Gen Virol, 2013, 94(Pt 7): 1486-1495.
[11] Cencic R, Mayer C, Juliano M A,et al. Investigating the substrate specificity and oligomerisation of the leader protease of foot and mouth disease virus using NMR[J]. J Mol Biol, 2007, 373(4): 1071-1087.
[12] Medina M, Domingo E, Brangwyn J K,et al. The two species of the foot-and-mouth disease virus leader protein, expressed individually, exhibit the same activities[J]. Virology, 1993, 194(1): 355-359.
[13] Glaser W, Cencic R, Skern T. Foot-and-Mouth Disease Virus Leader Proteinase involvement of C-terminal residues in self-processing and cleavage of eIF4GI[J]. J Biol Chem, 2001, 276(38): 35473-35481.
[14] De Los Santos T, de Avila Botton S, Weiblen R,et al. The leader proteinase of foot-and-mouth disease virus inhibits the induction of beta interferon mRNA and blocks the host innate immune response[J]. J Virol, 2006, 80(4): 1906-1914.
[15] Piñeiro D, Ramajo J, Bradrick S S,et al. Gemin5 proteolysis reveals a novel motif to identify L protease targets[J]. Nucleic Acids Res, 2012, 40(11): 4942-4953.
[16] Rodríguez Pulido M, Serrano P, Sáiz M,et al. Footand-mouth disease virus infection induces proteolytic cleavage of PTB, eIF3a, b, and PABP RNA-binding proteins[J]. Virology, 2007, 364(2): 466-474.
[17] Strebel K, Beck E. A second protease of foot-and-mouth disease virus[J]. J Virol, 1986, 58(3): 893-899.
[18] Kirchweger R, Ziegler E, Lamphear B J,et al. Foot-andmouth disease virus leader proteinase: purification of the Lb form and determination of its cleavage site on eIF-4 gamma[J]. J Virol, 1994, 68(9): 5677-5684.
[19] Kirchweger R, Ziegler E, Lamphear B J,et al. Foot-andmouth disease virus leader proteinase: purification of the Lb form and determination of its cleavage site on eIF-4 gamma[J]. J Virol, 1994, 68(9): 5677-5684.
[20] Mayer C, Neubauer D, Nchinda A T,et al. Residue L143 of the foot-and-mouth disease virus leader proteinase isa determinant of cleavage specificity[J]. J Virol, 2008, 82(9): 4656-4659.
[21] Foeger N, Kuehnel E, Cencic R,et al. The binding of foot-and-mouth disease virus leader proteinase to eIF4GI involves conserved ionic interactions[J]. FEBS J, 2005, 272(10): 2602-2611.
[22] Kronovetr J, Skern T. Foot-and-mouth disease virus leader proteinase: a papain-like enzyme requiring an acidic environment in the active site[J]. FEBS Lett, 2002, 528(1): 58-62.
[23] de Los Santos T, Diaz-San Segundo F, Grubman M J. Degradation of nuclear factor kappa B during foot-andmouth disease virus infection[J]. J Virol, 2007, 81(23): 12803-12815.
[24] Wang D, Fang L, Luo R,et al. Foot-and-mouth disease virus leader proteinase inhibits dsRNA-induced type I interferon transcription by decreasing interferon regulatory factor 3/7 in protein levels[J]. Biochem Biophys Res Commun, 2010, 399(1): 72-78.
[25] Wang D, Fang L, Liu L,et al. Foot-and-mouth disease virus (FMDV) leader proteinase negatively regulates the porcine interferon-λ1 pathway[J]. Mol Immunol, 2011, 49(1): 407-412.
[26] Wang D, Fang L, Bi J,et al. Foot-and-mouth disease virus leader proteinase inhibits dsRNA-induced RANTES transcription in PK-15 cells[J]. Virus Genes, 2011, 42(3): 388-393.
[27] Sorgeloos F, Jha B K, Silverman R H,et al. Evasion of Antiviral Innate Immunity by Theiler's Virus L* Protein through Direct Inhibition of RNase L[J]. PLoS Pathog, 2013, 9(6): e1003474.
[28] Garc í a-Briones M, Rosas M F, González-Magaldi M,et al. Differential distribution of non-structural proteins of foot-and-mouth disease virus in BHK-21 cells[J]. Virology, 2006, 349(2): 409-421.
[29] de Los Santos T, Diaz-San Segundo F, Zhu J,et al. A conserved domain in the leader proteinase of foot-andmouth disease virus is required for proper subcellular localization and function[J]. J Virol, 2009, 83(4): 1800-1810.
[30] Wang D, Fang L, Li P,et al. The leader proteinase of foot-and-mouth disease virus negatively regulates the type I interferon pathway by acting as a viral deubiquitinase[J]. J Virol, 2011, 85(8): 3758-3766.
[31] Grubman M J, Moraes M P, Segundo D S,et al. Evading the host immune response: how foot-and-mouth disease virus has become an effective pathogen [J]. FEMS Immunol Med Microbiol, 2008, 53(1): 8-17.
CHARACTERISTICS OF LEADER PROTEIN OF FOOT-AND-MOUTH DISEASE VIRUS
ZHANG Meng, BAI Xing-wen, LI Ping-hua, FAN Peng-ju, BAO Hui-fang, SUN Pu, LU Zeng-jun, CAO Yi-mei, LIU Zai-xin
(State Key Laboratory of Veterinary Etiological Biology, National Foot-and-Mouth Disease Reference Laboratory, Engineering Research Center of Biological Detection of Gansu Province, Lanzhou Veterinary Research Institute, CAAS, Lanzhou 730046, China)
Foot-and-mouth disease virus (FMDV) encodes a leader protein, which is not only an important protease but also a crucial virulence factor. The leader protein interacts with specif c proteins within host cells, leading to resist cellular defensive mechanisms. The present article summarizes characteristics of the leader protease of FMDV, for example, the relationship of its coding region with viral replication, structure, properties and molecular mechanism affecting viral virulence.
Foot-and-mouth disease virus; leader protein; innate immunity
S852.659.6
A
1674-6422(2014)01-0073-07
2013-10-14
甘肃省科技重大专项计划项目(1102NKDA032)
张萌,男,硕士研究生,预防兽医学专业
刘在新,E-mail:Liuzaixin@caas.cn

