PAI-1启动子序列与荧光素酶报告基因扩增及载体连接问题分析*
张莎莎崔 琳宰军华* 李 强,3路玲玲
(1 河南中医学院,河南 郑州,450008;2 河南中医学院第一附属医院,河南 郑州4500003 河南省病毒性疾病中医药防治重点实验室,河南 郑州450000)
PAI-1启动子序列与荧光素酶报告基因扩增及载体连接问题分析*
张莎莎1崔 琳2宰军华2* 李 强2,3路玲玲1
(1 河南中医学院,河南 郑州,450008;2 河南中医学院第一附属医院,河南 郑州4500003 河南省病毒性疾病中医药防治重点实验室,河南 郑州450000)
目的探讨纤溶酶原激活物抑制剂-1(Plasminogen activator inhibitor-1,PAI-1)启动子荧光素酶表达质粒构建中扩增、转化、酶切及连接的问题。方法利用PCR技术扩增1100 bp长度PAI-1启动子片段,与PUC-19T载体连接,将PUC19T-PAI-1 1100质粒,及荧光素酶报告基因pGL3-Basic质粒转染大肠肝菌(DH5a)后扩增,提取并纯化;以BglⅡ,MluⅠ酶切,电泳并回收PAI-1 1100片段和pGL3-Basic酶切大片段,将PAI-1 1100片段插入荧光素酶报告基因pGL3-Basic中,构建含PAI-1 1100片段荧光素酶质粒。结果扩增PAI-1 1100 bp片段成功,目的片段与载体PUC19T,pGL3-Basic载体连接条件较苛刻,需要增加连接时间及效率的摸索。结论 控制扩增时DNA浓度,胶回收,感受态质量,LB平板质量,内切酶,连接时间及质量比等问题都可增加连接成功概率。
PAI-1;启动子;荧光素酶报告基因;载体连接
基因重组技术是我们在分子生物学研究中较常使用到的基本技术,也是分子生物学实验的基础,它在现代中医药的研究中应用越来越广泛。载体构建是将外源性DNA目的片段通过重组技术转化入受体细胞中繁殖及表达,人工构建为需要的目的质粒,为进一步实验做基础[1,2]。当外源性DNA片段插入到相应载体内时,由于操作方法繁琐,所需时间长,人为性因素较大,容易导致实验难以继续。本文根据自身操作,在扩增、酶切及连接问题上进行总结,现报道如下。
1 实验材料
1.1 试剂
报告基因表达载体pGL-3Basic(PromegaE6721)、PUC19T载体(TAKARA公司D);大肠杆菌DH5α感受态菌株(TAKARA公司D9057A)、人血基因组DNA提取试剂盒(北京天根生化科技公司)、PCR扩增mix(北京康为公司CW0069)、DNA marker V、500 bp DNA marker(上海莱枫生物科技有限公司);DNA凝胶回收试剂盒(GX50)、DNA质粒小量提取试剂盒(Axygen公司AP-MN);限制性内切酶BglⅡ(Fermentas公司ER0561)和MluⅠ(Fermentas公司ER0081)、T4 DNA连接酶(Fermentas公司ER0041);琼脂糖(美国Invitrogen公司)。
1.2 仪器
PCR仪(美国Applied Biosystems公司),电泳系统(美国Bio-Rad公司),UVIpro型凝胶成像分析系统(英国Silver Uvitec公司),Milli-Q型超纯水仪(美国Milipore公司),Thermo-I368超低温冰箱,高速低温离心机(德国heraus公司),恒温培养箱(DNP-9082型上海精宏实验设备有限公司),微量离心机(Thermo 公司 MICR017)。
2 方 法
2.1 PAI-1 1100片断的扩增
按试剂盒操作提取人全血基因组DNA,根据设计的引物PCR扩增目的基因组DNA,1.1kb上游:5‘CGACGCGTGAGCCTAACTTTCC GACTG3’;下游:5‘GAAGATCTTCTGCCCTCTGCCTGTG3’,反应体系:PCR mix25 μL,上游引物:1 μL,下游引物1 μL,模板DNA 10 μL,ddH2O 13 μL,总反应体系50 μL。反应条件:95 ℃,预变性3 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸5 min,35个循环。取5 u PCR产物进行1%琼脂糖凝胶电泳,在紫外透射灯下观察电泳条带并用凝胶成像分析系统拍照[3]。
2.2 PUC19T-PAI-1 1100连接反应
获取表达载体的信息,根据试剂盒操作进行连接反应。连接体系:PUC19T 1 μL,solutionⅠ5 μL,DNA产物:4 μL,总10 μL,16度连接3 h,见图1、图2。
2.3 PUC19T-PAI-1 1100及PGL-3 Basic质粒的提取
将连接的PUC19T-PAI-1 1100及pGL-3 Basic转入大肠杆菌DH5a中。具体操作步骤如下:取3支100 μL感受态细菌于冰上融化,在其中2支分别小心加入连接产物,另一支阳性对照,轻轻混匀,冰水浴30 min,42 ℃热休克90 s,快速冰浴5 min,使其骤冷。加入800 μL不含Amp的液体LB培养基,37 ℃摇床150 rpm培养1 h。3000 rpm离心3 min,弃上清,余200 μL液体使沉淀重悬,涂布于含Amp的固体LB平板上,待液体完全吸收后,37 ℃恒温培养箱过夜培养。第2天挑取阳性克隆,使用质粒小提试剂盒抽提质粒,进行双酶切,电泳鉴定后,纯化PAI-1 1100片段和pGL-3 basic质粒,获得目的质粒[4]。
2.4 pGL3 Basic-PAI-1 1100的连接
双酶切PAI-1 1100片断及pGL-3 Basic质粒,取5 μL琼脂糖凝胶分析后,进行纯化回收,再次电泳鉴定后,根据试剂盒操作进行连接反应。连接体系:T4DNA Ligase 2 μL,T4 buffer 1 μL,DNA产物:13 μL,pGL-3 Basic 4 μL,总20 μL,16度连接过夜。
2.5 pGL3 Basic-PAI-1 1100的转化:按2.3步骤进行。
2.6 质粒小提试剂盒抽提质粒DNA并酶切鉴定,待第2天观察连接转化的固体LB平板,如果长出单个菌落,挑菌摇菌小提后酶切初步鉴定。
3 结 果
实验证明,扩增时DNA浓度问题,感受态问题,内切酶问题及连接产物质量比等都会导致实验室败。
3.1 扩增条件及结果分析
扩增PAI-1 1100启动子片段,并将之与PUC19T载体连接,提取后酶切纯化,获得目的片段。
3.2 连接产物酶切纯化后电泳
见图3、图4。
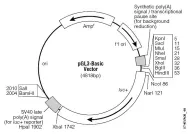
图1 pGL-3 Basic质粒载体表达信息
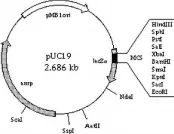
图2 pUC19T连接载体表达信息
图3 连接产物酶切图
图4 模板量过大导致的大量多聚体
3.3 连接后转化
将酶切后的质粒与片段连接后,经反复实验,LB平板上仍长不出菌斑(图5),提示载体未与目的片段连接成功(图6)。

图5 感受态效率低下导致的连接产物空载

图6 连接比例错误导致的空载
4 讨 论
基因重组技术是分子生物学的核心技术,它从基因组DNA的提取,载体的选择,目的片段的扩增,限制酶的切割,载体的连接,大肠杆菌的转化,质粒的提取,每一步都可能产生问题,导致载体与目的片段不能正常连接,现分析如下:
4.1 ①DNA模板量过大会导致PCR产物电泳出现多聚体(图4)在基因重组实验中,基因组DNA的质量是后续所有实验的基础,所以,首先应保证提取高浓度的基因组DNA。人基因组DNA多存在于血白细胞内,因此,应从白细胞中提取高浓度的DNA。②胶回收问题,如果切胶时目的片段切不完全,或者切到杂带,可能导致回收到的不是目的片段。切胶时,要保证回收到目的片段,而且胶不能再紫外线下暴露过长时间,融胶时间不能太短,以免融胶不完全,堵塞柱子,影响回收效率[5]。
4.2 感受态问题,由于使用效率不高的感受态,造成空载(图5)。感受态细胞是处理后容易接受外来DNA进入的细胞,因此,应选择高效率的感受态,才能使连接产物容易转化入感受态内。建议在铺板时同时取20 μL感受态铺于Amp阴性LB平板上,观察感受态生长状况,确保没有因感受态问题影响实验进行。
4.3 LB平板的问题,主要是铺板加入Amp时温度的问题,加入Amp时温度过高,就会导致Amp抗性失活,从而导致克隆菌斑无法筛选出来(图6)。一般选择将消毒好的培养基放入60 ℃水浴锅中,待培养基温度降至60 ℃时加入Amp,以保证Amp的未失活。
4.4 内切酶问题
①因公用buffer体积错误而导致酶切不开(图7)限制酶的选择非常重要,酶切位点选择好后,就要选择效率高的内切酶,了解酶的特征,注意双酶切时公用buffer的体积问题,确定合适的酶切体系。可用两管质粒同时进行,一管双酶切,另一管先单酶切,然后再用另一个酶单切,判断酶切质量,保证酶切效率[6]。②酶切时间问题,酶切时间过长可能引起酶切太过,导致酶切产物丢失(图8),应根据试剂盒选择酶切温度及时间,一般用16 ℃过夜或者37 ℃过夜,其实酶切时间3 h就足够了。酶切完纯化回收后,跑胶确定目的片段和载体回收回来,确保目的片段及载体仍在。
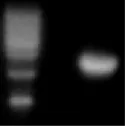
图7 公用buffer错误导致的酶切错误
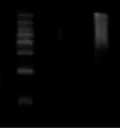
图8 酶切时间过长导致的产物丢失
4.5 载体与目的片段的质量比问题
如果连接时载体量过大,或者载体去磷酸化,或者连接上其他目的片段的载体,可能导致连接的不是目的片段(图9)。连接时一般载体和目的片段的比例是1∶(3~10),如果连接时效率不高,排除感受态问题后,就要反复试验载体与目的片段的摩尔比,最好电泳一下由亮度判断载体与目的片段大致体积,或者测一下分别的浓度再选择用量。
经长期反复实验总结,DNA的提取及模板量,胶回收,感受态质量,平板质量,到内切酶用量及时间,以及载体的连接整个过程都应时刻注意。但是,由于一定的局限性,我们对载体构建原理及应用,实验结果分析的能力都有很大的不足,因此,我们应严格操作,尽量避免实验中的各种问题才得出正确的结果(图10)。
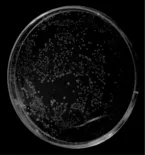
图9 质量比错误导致的链接错误
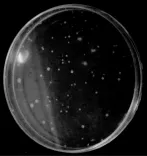
图10 排除各种问题后的正确结果
[1] Eckel RH,York DA,Rossner S,et al.Prevention Conference VII: Obesity,a worldwide epidemic related to heart disease and stroke: executive summary[J].Circulation,2004,110(18): 2968-2975.
[2] Giltay EJ,Elber JM.Visceral fat accumμLation is an important determinate of PAI-1 levels in young,nonbese men and woman modμLation bycross-sex hormone administration[J].Thromb Vasc Biol,2004,18(11):1716-1722.
[3] 方肇勤.分子生物学在中医药研究中的应用[M].上海:科学技术出版社,2008.
[4] 彭韦霞.Caveolin1基因沉默对胰岛素刺激的内皮细胞表达PAI1的影响[D].衡阳:南华大学,2007.
[5] 尹晓玲.IL-12真核表达质粒构建及其瘤苗抗肺癌免疫作用研究[D].重庆:重庆医科大学,2009.
[6] 张琴.EBV-LMP2A基因慢病毒载体质粒的构建及体外表达、鉴定[D].温州:温州医学院,2010.
R346
B
1671-8194(2014)11-0062-02
河南省教育厅自然科学研究资助计划项目(2010B360009);郑州市科技公关计划项目(0910SGYS33391-1)
*通讯作者:E-mail: zaijunh@163.com

