RNA干扰HIF-1α对类风湿关节炎成纤维样滑膜细胞的VEGF表达及增殖的影响
陈勇 彭勇 于静雅 邬秀娣 罗晶 张振 干敏芝 黄娴倩 章海均
RNA干扰HIF-1α对类风湿关节炎成纤维样滑膜细胞的VEGF表达及增殖的影响
陈勇 彭勇 于静雅 邬秀娣 罗晶 张振 干敏芝 黄娴倩 章海均
目的 探讨shRNA特异性干扰沉默缺氧诱导因子-1α(HIF-1α)对类风湿关节炎(RA)成纤维样滑膜细胞(FLS)的血管内皮生长因子(VEGF)表达及其增殖的影响。方法获取9例RA患者滑膜组织进行RA-FLS的分离培养及传代。将FLS分为4组:常氧组、缺氧组、阴性质粒组(转染阴性质粒)和阳性质粒组(转染HIF-1α阳性质粒),常氧组进行常规培养,后3组进行缺氧培养12h;采用Western blot和qRT-PCR法分别检测各组FLS中HIF-1α和VEGF以及HIF-1α和VEGF mRNA表达情况。将缺氧组、阴性质粒组和阳性质粒组的FLS分别于缺氧条件下培养6、12、24、48h,应用MTT比色法检测各组细胞增殖情况。结果与常氧组相比,缺氧组FLS的HIF-1α和VEGF以及HIF-1α和VEGF mRNA表达明显升高,差异均有统计学意义(均P<0.05),而阴性质粒组和缺氧组FLS的HIF-1α和VEGF以及HIF-1α和VEGF mRNA表达水平无明显差异(P>0.05);阳性质粒组FLS的HIF-1α和VEGF以及HIF-1α和VEGF mRNA较缺氧组下调,差异均有统计学意义(均P<0.05)。4组FLS的HIF-1α和VEGF以及HIF-1α和VEGF mRNA表达呈正相关(P<0.01)。缺氧培养12h后阳性质粒组的FLS生长较缺氧对照组及阴性质粒组减慢,差异有统计学意义(P<0.05),而后两组FLS生长无统计学差异(P>0.05)。结论RNA干扰HIF-1α表达能有效下调RA-FLS中HIF-1α和VEGF以及HIF-1α和VEGF mRNA水平,并且能抑制FLS的异常增殖。
类风湿关节炎 成纤维样滑膜细胞 RNA干扰 细胞增殖 缺氧诱导因子-1α 血管内皮生长因子
类风湿关节炎(rheumatoid arthritis,RA)是一种常见的以关节滑膜炎为特征,以慢性、进行性、侵袭性关节炎为主要表现的全身性自身免疫性疾病,是造成我国人群致残的主要原因之一。目前对于RA的发病机制尚未十分清楚,其基本病理表现为滑膜炎和血管翳的形成。早在上世纪80年代Fassbender等[1]发现RA成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)具有类肿瘤生长特性,而近年来的研究发现RA-FLS类似肿瘤细胞样的生物学特性表现为FLS的异常增殖、迁移和浸润及抗凋亡[2]。而RA的滑膜炎就主要表现为滑膜异常增生、炎症细胞的浸润及炎症因子的释放,这些又将引起关节微环境的缺氧[3],体内细胞缺氧反应的核心调节因子是缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)[4]。血管翳的形成是RA的另一重要病理表现,也是RA发生、发展过程的中心环节,主要表现为新生血管的形成。而血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种较强的刺激血管新生的因子,在血管新生中起着核心的作用;关节微环境的缺氧就是VEGF表达的主要诱导因素之一。我们前期研究结果也发现,缺氧条件下RA患者滑膜细胞的HIF-1α及VEGF表达水平较骨关节炎(osteoarthritis,OA)患者显著升高,且两者水平呈密切相关[5]。因此,笔者推测“缺氧-HIF-1α-VEGF”这一信号途径在RA的发生、发展过程中起着至关重要的作用,而HIF-1α又在其中起着核心作用。因此,本研究拟通过体外应用RNA干扰技术特异性靶向抑制RA-FLS的HIF-1α基因,探讨缺氧条件下其对RA-FLS的VEGF表达及增殖的影响,从而为RA的靶向治疗提供实验依据,现报道如下。
1 材料和方法
1.1 材料 选取2012-03—2013-05宁波市第二医院及宁波市第六医院行关节置换术的RA患者的滑膜组织9例(宁波市第二医院6例,宁波市第六医院3例),其中男2例,女7例,年龄42~64岁,平均(54.3±10.5)岁。诊断符合2010年美国风湿病学会/欧洲风湿病联盟(ACR/EULAR)的类风湿关节炎分类标准[6]。本实验经两家医院伦理委员会批准,术前获患者同意并签署知情同意书。获取滑膜组织后将其保存于无血清的DMEM培养基中,2h内冰盒运送至实验室处理。
1.2 主要试剂 眼科剪;眼科镊;细胞培养皿及培养瓶(美国NUNC公司);DMEM培养基及胎牛血清(FBS)(美国Hyclone/Thermo Scientific公司);Tris-HCl缓冲液(TBS)及含0.2%吐温的TBS缓冲液(TBST)、总蛋白提取试剂盒(上海索莱宝公司);HIF-1α-shRNA重组质粒、质粒提取试剂盒、转染试剂Effectene Transfection Reagent(德国Qiagen公司);BCA蛋白定量试剂盒(上海捷瑞生物工程有限公司);兔抗人HIF-1α多克隆抗体(一抗,美国Cell Signaling公司);兔抗人VEGF多克隆抗体(一抗,美国Canta Cruz公司);兔抗人β-actin单抗(一抗)及鼠抗兔二抗(北京博奥森生物技术有限公司);Western Bright Quantum增强型发光底物(APG BIO环亚生物科技有限公司);总RNA提取剂(日本Takara公司);RNA逆转录试剂盒、qRT-PCR检测试剂盒、MTT试剂盒(美国Invitrogen公司)。
1.3 方法
1.3.1 滑膜细胞培养 在生物安全柜内无菌条件下,用眼科剪和镊去除滑膜组织块表面血污及脂肪组织,PBS缓冲液清洗2遍。将组织块转移至新的盛有DMEM培养基(含抗生素)的培养皿内,将滑膜组织块剪成1mm3;用枪头将组织块摆放至25cm2的培养瓶内,组织间隔1cm,将培养瓶倒置(组织块面朝上)于细胞培养箱中。孵育4h后向瓶内加入5ml DMEM培养基 (含15%FBS和青、链霉素),然后将培养瓶轻轻翻转让培养基浸没组织块,置于培养箱内常规培养24h后换液,以后每隔2~3d换液。培养期间偶有组织块离壁、漂浮,即时换液去除漂浮组织块。待细胞生长密度至90%,1∶2常规消化传代。实验所用RA-FLS均采用第3~5代细胞。
1.3.2 细胞转染 将HIF-1α-shRNA(携带绿色银光蛋白,GFP)重组质粒和阴性质粒进行扩增和提取。将滑膜细胞分为常氧组、缺氧组、阳性质粒组和阴性质粒组;常氧组和缺氧组未处理,常氧组作为空白对照;阳性质粒组转染HIF-1α-shRNA阳性质粒,阴性质粒组转染阴性质粒(即无关序列组)。细胞转染参考Effectene Transfection Reagent转染试剂盒并做条件优化处理,荧光显微镜下观察转染率并取最佳优化条件进行转染。转染4~6h后对各组细胞进行换液,继续常规条件下培养24h后。然后将常氧组继续常氧条件下培养12h,其余3组转移至缺氧条件下(1%O2)培养12h。
1.3.3 Western blot检测HIF-1α及VEGF的表达 分别收集上述4组滑膜细胞并提取各组细胞总蛋白,采用BCA法测定总蛋白浓度。取30μg总蛋白进行蛋白电泳:分离胶恒压80V 20min,浓缩胶恒压100V 90min;转膜:转膜前将滤纸于转移缓冲液中平衡20min,恒流41 mA半干转2h,将蛋白转到PVDF膜上;封闭:将膜置于5%BSA封闭液中封闭1h,采用TBST洗膜2次,10min/次,TBS洗膜1次,10min;加待测的相应目的蛋白的一抗(抗HIF-1α或抗VEGF抗体),4℃过夜孵育,同上洗膜;加二抗,室温孵育1h,同上洗膜。ECL发光剂发光,Tanon-4200 SF全自动数码凝胶成像仪中,CCD曝光成像。凝胶图像分析软件对结果进行吸光度扫描,以βactin做内参进行校正,以HIF-1α和VEGF蛋白条带的吸光度值比上各自β-actin的吸光度值为目的蛋白的相对表达量。
1.3.4 实时荧光定量PCR(qRT-PCR)HIF-1α及VEGF mRNA表达 分别收集上述4组滑膜细胞并提取细胞总RNA,测定RNA浓度。取2μg上述总RNA在MMLV逆转录酶作用下将其合成cDNA。采用qRT-PCR法检测4组滑膜细胞HIF-1α和VEGF mRNA相对表达量。根据GenBank数据库提供的基因核苷酸序列,采用分子生物学软件Primer5进行qRT-PCR扩增引物的设计,将设计好的引物送上海生物工程有限公司合成。引物序列:HIF-1α上游引物:TTGCTCATCAGTTGCCACTTCC,HIF-1α下游引物:AGCAATTCATCTGTGCTTTCATGTC,产物长度153bp。VEGF上游引物:AAGGAGGAGGGCGAGAATCAT。VEGF下游引物:GCAGTAGCTGCGCTGATAGA,产物长度 66bp。设GAPDH为内参基因,上游引物:GGAAGGTGAAGGTCGGAGTC,GAPDH下游引物:AATGAAGGGGTCATTGATGG,产物长度110bp。根据qRT-PCR试剂盒操作,反应体系为25μl,每个样品设3个复孔。qRTPCR反应条件为:95℃4min预变性;95℃15s变性,65℃30s退火,72℃30s延伸,共40个循环。qRT-PCR检测CT值,采用2-△△Ct法进行数据的相对定量分析,△△Ct=实验组基因△Ct值-对照组基因△Ct值,△Ct=目的基因△Ct-内参基因△Ct值。
1.3.5 MTT比色法检测细胞增殖活性 将滑膜细胞分为缺氧组、阳性质粒组和阴性质粒组,取1×104个/孔分别接种于96孔培养板,并设空白调零孔,缺氧组为对照组,培养12h贴壁。其余组同上进行细胞转染,每组做5个复孔,于缺氧条件下分别培养6、12、24、48h。向各孔加入0.5mg/ml的MTT试剂20μl,37℃反应4h后弃去孔内液体;加入二甲基亚砜200μl终止反应,酶标仪测定在570nm波长处测定各孔吸光度值(A)。以A值为纵坐标,时间为横坐标绘制细胞曲线。
1.4 统计学处理 采用SPSS18.0统计软件。计量资料用表示,多组间比较采用单因素方差分析,两两比较采用SNK法;两组间比较采用t检验。相关性分析采用Person相关分析。
2 结果
2.1 转染shRNA后对RA-FLS中HIF-1α和VEGF表达的影响 通过荧光显微镜可观察到转染后细胞表达shRNA质粒携带的绿色荧光蛋白,详见图1。
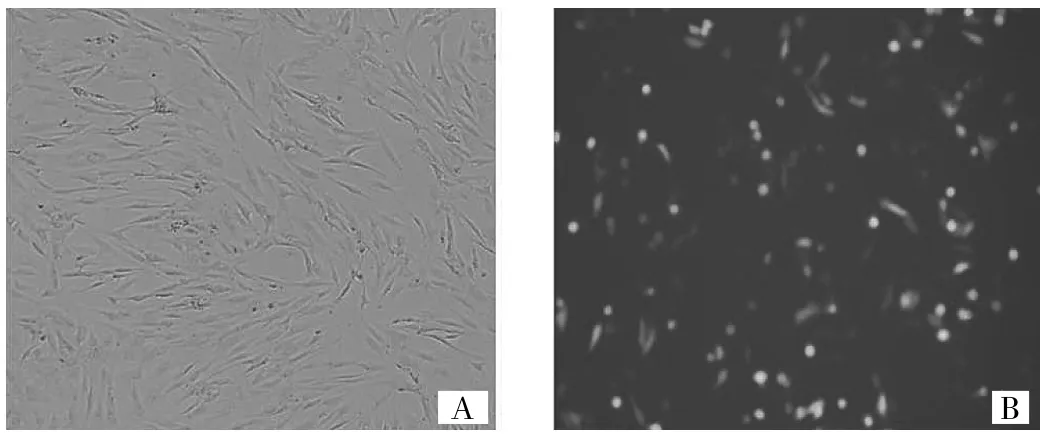
图1 HIF-1α-shRNA转染前后FLS(A:转染前普通光镜下RA-FLS;B:转然后荧光显微镜下RA-FLS表达绿色荧光蛋白;倒置显微镜,×40)
Western blot检测结果显示,缺氧组的HIF-1α和VEGF表达较常氧组明显升高,差异有统计学意义(P<0.05),而与阴性质粒组比较差异无统计学意义(P>0.05);阳性质粒转染组HIF-1α和VEGF表达较缺氧组下调,差异有统计学意义(P<0.05);同时也发现常氧组两种蛋白几乎不表达,详见图2。
2.2 转染shRNA后对RA-FLS中HIF-1α和VEGF mRNA表达水平的影响 缺氧组的HIF-1α和VEGF mRNA与常氧组相比表达显著上调,差异有统计学意义(P<0.05),与阴性质粒组比较差异无统计学意义(P>0.05);而阳性质粒组的HIF-1α和VEGF mRNA表达较缺氧组水平降低,差异有统计学意义(P<0.05);同时也发现常氧组的HIF-1α和VEGF mRNA几乎不表达,详见图3。GAPDH内参、HIF-1α和VEGF的qRT-PCR产物的溶解均呈单峰,说明实验特异性较高、结果可靠。
2.3 RA-FLS中HIF-1α和VEGF表达水平的相关分析 通过对常氧组、缺氧组、阴性质粒组和阳性质粒组FLS中HIF-1α及VEGF表达情况进行相关分析,结果表明两者表达呈正相关(r=0.89,P<0.01),详见图4。同时对上述4组FLS中HIF-1α和VEGF mRNA表达情况进行相关分析,结果表明两者表达呈正相关(r=0.79,P<0.01),详见图5。

图2 各组FLS中HIF-1α和VEGF表达(与常氧组相比,*P<0.05;与缺氧组相比,#P<0.05)
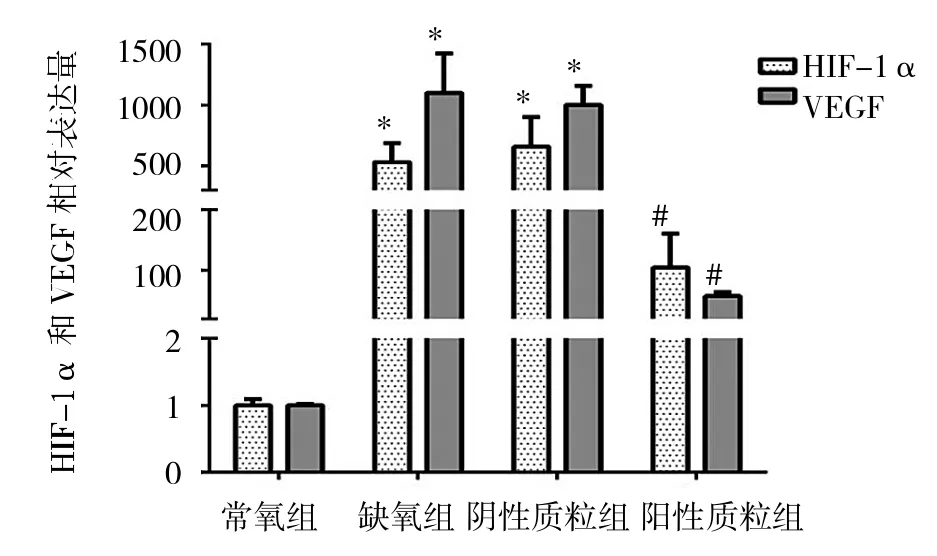
图3 各组FLS中HIF-1α和VEGF mRNA的表达(与常氧组相比,*P<0.05;与缺氧组相比,#P<0.05)
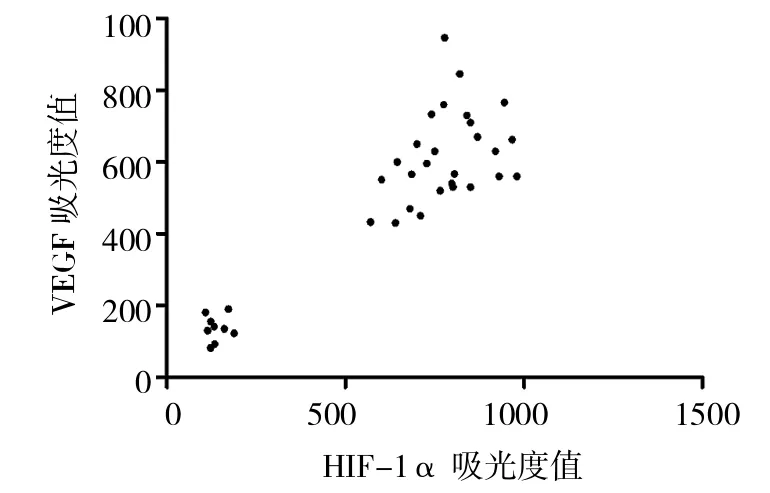
图4 HIF-1α和VEGF表达水平相关关系
2.4 转染shRNA后对RA-FLS增殖的影响 MTT法检测缺氧组、阴性质粒组和阳性质粒组滑膜细胞缺氧不同时间后的增殖情况发现,从缺氧12h开始阳性质粒组的滑膜细胞生长较缺氧对照组和阴性质粒组明显减慢,且差异均有统计学意义(均P<0.01);而后两组滑膜细胞生长速度无统计学差异,详见图6。

图5 HIF-1α和VEGF mRNA表达水平相关关系
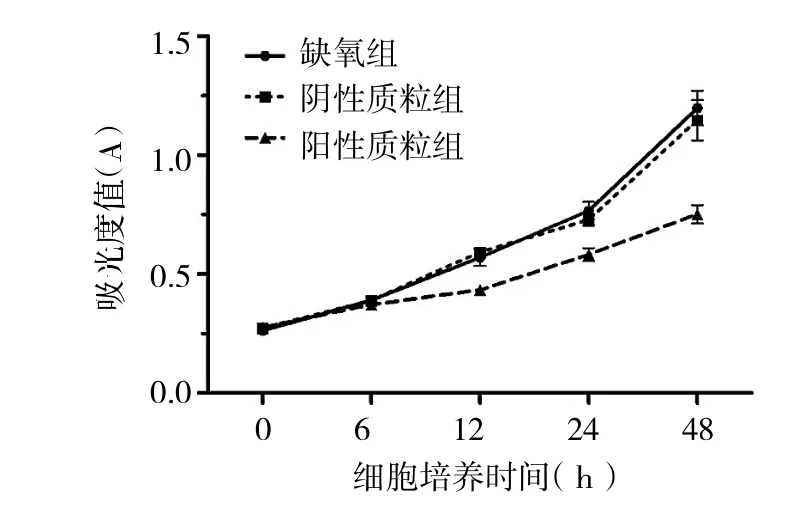
图6 HIF-1αshRNA干扰对缺氧条件下RA-FLS增殖的影响
3 讨论
RA最大的危害在于其致残性,即可导致患者关节破坏和畸形。目前有大量研究都认为活化的RA-FLS在RA的发生、发展过程中起至关重要的作用,其具有类肿瘤生长特性即侵蚀性,是RA患者关节软骨与骨破坏的主要参与者[7-8],而滑膜炎和血管翳的形成是RA的基本病理表现。RA关节滑膜炎主要表现在炎症关节中的大量炎症细胞浸润、炎症因子的产生及滑膜细胞的异常增生,而这些都将导致RA关节微环境的缺氧,从而诱导滑膜组织的HIF-1α高表达。目前研究已经证实,RA受累关节微环境中存在缺氧[9]。而Brouwer等[10]研究也发现RA患者滑膜组织的HIF-1α表达水平显著高于OA患者滑膜组织,还发现RA滑膜组织HIF-1α阳性细胞数与其血管数目、炎症细胞浸润数及滑膜炎症得分成正相关。国内学者也发现,早期活动组RA患者的血清HIF-1α要显著高于OA患者组及健康对照组,并且高于中晚期活动组及稳定组RA患者[11]。血管翳的形成则是RA发生、发展过程的中心环节,主要表现为新生血管的形成。Ozgonenel等[12]发现RA患者的血清和滑液中VEGF水平显著升高,并且VEGF水平与疾病的活动有关。而关节微环境的缺氧是VEGF及其受体表达的主要诱导因素之一。近年来一些针对缺氧核心调节因子HIF-1α的抑制剂被也证明对炎症性关节有效,如Shankar等[13]应用二苯甲酮类似物(BP-1)处理佐剂诱导型关节炎(AIA)大鼠模型后,BP-1可下调早期关节炎大鼠VEGF和HIF-1α的表达,同时可减轻关节症状。Chou等[14]报道向AIA大鼠模型关节中注入透明质酸可以抑制其HIF-1α、诱导型一氧化氮合酶(iNOS)、MMP-3的表达同时还可减轻关节疼痛。这些都表明HIF-1α可能参与了RA的发病过程,并且起着重要作用。
本研究通过对RA滑膜组织的成纤维样滑膜细胞进行体外分离培养,并应用shRNA对其HIF-1α基因进行特异性干扰,检测常氧和缺氧条件下HIF-1α shRNA对RA滑膜细胞的HIF-1α和VEGF蛋白及其mRNA表达,同时观察其对滑膜细胞增殖的影响。结果显示,缺氧组的RA滑膜细胞HIF-1α和VEGF及其mRNA表达水平要显著高于常氧组,而两者在常氧条件下几乎不表达;通过HIF-1α shRNA干扰后发现阳性质粒组滑膜细胞的HIF-1α和VEGF及其mRNA水平较缺氧组对照组有所下调,并且通过相关分析发现HIF-1α和VEGF的表达呈正相关。这表明RA炎症关节微环境的缺氧可以通过上调HIF-1α表达从而诱导滑膜细胞表达VEGF,进而可能加剧滑膜炎症。通过干扰抑制滑膜细胞不仅可以下调VEGF的表达,本研究还发现阳性质粒组的滑膜细胞与对照组相比生长受到抑制。这表明下调滑膜细胞的HIF-1α表达可能可以延缓滑膜炎症并且抑制滑膜细胞的异常增殖从而达到控制和治疗疾病的目的。
综上所述,本研究发现缺氧培养条件下RA-FLS中HIF-1α和VEGF的表达升高,而通过HIF-1α-shRNA体外特异性抑制RA-FLS的HIF-1α表达,不仅可以抑制FLS的HIF-1α的表达从而下调RA血管新生的核心调节因子-VEGF,并且可以抑制缺氧条件下RA-FLS的异常增殖,提示以HIF-1α为靶向的RNA干扰治疗RA的有效性。我们进一步拟应用病毒载体转染HIF-1α shRNA,在RA动物模型中进一步明确RNA干扰HIF-1α的有效性和安全性,为临床治疗RA提供新的策略和依据。
[1]Fassbender H G,Simmling-Annefeld M.The potential aggressiveness of synovial tissue in rheumatoid arthritis[J].J Pathol, 1983,139(3):399-406.
[2]Karouzakis E,Gay R E,Gay S,et al.Epigenetic control in rheumatoid arthritis synovial fibroblasts[J].Nat Rev Rheumatol,2009,5(5): 266-272.
[3]Biniecka M,Kennedy A,Fearon U,et al.Oxidative damage in synovial tissue is associated with in vivo hypoxic status in the arthritic joint[J].Ann Rheum Dis,2010,69(6):1172-1178.
[4]Muz B,Khan M N,Kiriakidis S,et al.Hypoxia.The role of hypoxia and HIF-dependent signalling events in rheumatoid arthritis[J].Arthritis Res Ther,2009,11(1):201.
[5]彭勇,陈勇,邬秀娣,等.HIF-1α及VEGF在类风湿关节炎成纤维样滑膜细胞中的表达及意义[J].浙江医学,2013,35(18):1628-1631,1643.
[6]Aletaha D,Neogi T,Silman A J,et al.2010 Rheumatoid arthritis classification criteria:an American College of Rheumatology/European League Against Rheumatism collaborative initiative[J].Arthritis Rheum,2010,62(9):2569-2581.
[7]Huber L C,Distler O,Tarner I,et al.Synovial fibroblasts:key players in rheumatoid arthritis[J].Rheumatology(Oxford),2006,45(6): 669-675.
[8]Bartok B,Firestein G S.Fibroblast-like synoviocytes:key effector cellsinrheumatoidarthritis[J].ImmunolRev,2010,233(1):233-255.
[9]Sivakumar B,Akhavani M A,Winlove C P,et al.Synovial hypoxia asa cause of tendon rupture in rheumatoid arthritis[J].J Hand Surg Am,2008,33(1):49-58.
[10]Brouwer E,Gouw A S,Posthumus M D,et al.Hypoxia inducible factor-1-alpha (HIF-1alpha)is related to both angiogenesis and inflammation in rheumatoid arthritis[J].Clin Exp Rheumatol, 2009,27(6):945-951.
[11]黄娴倩,陈勇,龚丽敏,等.类风湿关节炎患者血清缺氧诱导因子-1α的检测及与关节滑膜病变的相关性[J].浙江医学,2011,33(10): 1420-1422.
[12]Ozgonenel L,Cetin E,Tutun S,et al.The relation of serum vascular endothelial growth factor level with disease duration and activity in patients with rheumatoid arthritis[J].Clin Rheumatol, 2010,29(5):473-477.
[13]Shankar J,Thippegowda P B,Kanum S A.Inhibition of HIF-1alpha activity by BP-1 ameliorates adjuvant induced arthritis in rats[J].Biochem Biophys Res Commun,2009,387(2):223-228.
[14]Chou L W,Wang J,Chang P L,et al.Hyaluronan modulates accumulation of hypoxia-inducible factor-1 alpha,inducible nitric oxide synthase,and matrix metalloproteinase-3 in the synovium of rat adjuvant-induced arthritis model[J].Arthritis Res Ther, 2011,13(3):R90.
Effects of shRNA-HIF-1α-mediated gene silencing on VEGF expression and proliferation of fibroblast-like synoviocytes in patients with rheumatoid arthritis
Objective To investigate the effects of shRNA-HIF-1α-mediated gene silencing on VEGF expression and proliferation of fibroblast-like synoviocytes (FLS)in patients with rheumatoid arthritis in vitro.MethodsThe fibroblast-like synoviocytes were isolated and cultured from synovial tissue of 9 patients with rheumatoid arthritis.The cultured FLSs were divided into 4 groups:hypoxic group,normoxic group,the negative control group (transfected with blank plasmids)and the positive group (transfected with HIF-1α-shRNA).The cells in normoxic group were incubated under normoxia,and cells in other three groups were incubated under hypoxia.The expression of HIF-1α and VEGF protein and mRNA were detected by Western blot and qRT-PCR,respectively.The cells in hypoxia,negative control and positive groups were incubated under hypoxia for 6,12,24 and 48 hours.The proliferation of RA-FLS was examined by MTT.ResultsHigher expressions of HIF-1α and VEGF protein and mRNA were detected in hypoxic group compared with those in normoxia group (P<0.05).There were no significant differences in protein and mRNA expression of HIF-1α and VEGF between normoxic group and negative control group (P>0.05).Compared with the normoxic group and the negative control group,the expression of HIF-1α and VEGF protein and mRNA in positive group were significantly lower(P<0.05).The expression of HIF-1α were positively correlated with VEGF in all 4 groups (P<0.05).MTT assays showed that the FLS proliferation in positive group were slower than that in normoxic and negative control groups(P<0.05).ConclusionThe plasmids of HIF-1α-shRNA can inhibit HIF-1α and VEGF expression and cell proliferationsof fibroblast-like synoviocytes in patients with rheumatoid arthritis.
Rheumatoid arthritis Fibroblast-like synoviocytes RNA interfering Cell proliferation Hypoxia-inducible factor-1α Vascular endothelial growth factor

2014-03-17)
(本文编辑:严玮雯)
宁波市社会发展科研项目基金资助(2012C50010);宁波市自然基金项目(2013A610259)
315010 宁波市第二医院风湿免疫科(陈勇、彭勇、于静雅、邬秀娣、张振、干敏芝、黄娴倩、章海均);宁波市第六医院风湿免疫科(罗晶)
陈勇,E-mail:nbdeyycy@163.com

