LAMA4基因对喉癌细胞增殖和侵袭的调控机制
邬振华 李群 龚朝晖 沈志森
LAMA4基因对喉癌细胞增殖和侵袭的调控机制
邬振华 李群 龚朝晖 沈志森
目的 构建层粘连蛋白α4亚基(LAMA4)的过表达和干扰序列重组慢病毒,观察其对Hep-2喉癌细胞株增值和侵袭的调控机制。方法 全基因合成LAMA4序列并筛选有效的LAMA4基因干扰序列,重组入带有绿色荧光蛋白慢病毒载体。采用慢病毒感染喉癌细胞株Hep-2后,通过Western blot检测过表达和干扰效率。MTT法检测LAMA4基因表达变化时Hep-2细胞株增殖能力的变化。Transwell实验检测喉癌细胞株感染前后侵袭能力的变化。利用Western blot和Real-time PCR检测基质金属蛋白酶-2(MMP-2)与膜型基质金属蛋白酶(MT1-MMP)的基因表达量变化情况。结果 (1)携带LAMA4基因片段和小干扰片段的重组慢病毒成功构建,包装慢病毒后浓缩病毒悬液滴度达到5×105TU/μl。(2)基因沉默组LAMA4蛋白相对表达量明显低于对照组,过表达组相对表达量明显高于对照组,差异均有统计学意义(均P<0.05)。(3)LAMA4干扰慢病毒感染Hep-2喉癌细胞株后,细胞株增殖无明显变化。(4)Transwell小室检测发现,基因沉默组及过表达组Transwell细胞数与对照组的差异均有统计学意义(均P<0.05)。(5)与对照组比较,基因沉默组及过表达组MMP-2及MT1-MMP基因与蛋白表达均发生明显变化,差异均有统计学意义(均P<0.05)。结论 LAMA4基因可能是通过MMP-2和MT1-MMP基因相关通路调节喉癌细胞的侵袭能力,LAMA4可以作为治疗喉癌转移的潜在靶点。
基因 喉癌 慢病毒 侵袭能力 增殖
喉癌是耳鼻喉-头颈外科常见的恶性肿瘤之一,发 生率约占全身恶性肿瘤的5%,在我国的发病率呈上升趋势[1]。喉癌患者5年内死亡的主要原因之一为肿瘤的侵润和转移,而肿瘤的侵袭和转移机制已成为目前全球研究的热点。喉癌作为头颈外科的多发病,其发生、发展涉及多中心、多环节、多通路,分子生物学机制尚未明确。随着分子生物学研究技术的发展,喉癌侵袭和转移的分子机制研究逐渐受到重视[2-3]。层粘连蛋白(Laminin,LN)是构成基底膜的重要成分之一,有研究证实,LN在高分化喉癌组织中表达水平显著低于低分化及中分化喉癌,并且和淋巴结转移能力相关[4]。LNα4亚基(Laminin A1-pha4,LAMA4)是LN的重要功能型亚基,是细胞外基质中与肿瘤侵袭和转移密切相关的一种功能性基因。肿瘤的侵袭和转移包括细胞黏附、细胞外基质降解、细胞移动等步骤,LAMA4基因被证明在此过程中发挥了重要作用[5]。本研究拟通过构建重组慢病毒使LAMA4基因表达量发生变化,在过表达和沉默LAMA4基因后,观察喉癌细胞增殖和侵袭能力的变化,以初步探讨LAMA4基因对喉癌Hep-2细胞株增殖和侵袭能力的影响及作用机制。
1 材料和方法
1.1 材料 Hep-2喉癌细胞株购于上海中科院细胞库。DMEM培养基、FBS、0.25%胰蛋白酶军购自Invitrogen公司;多克隆抗体购于Creative Biomart公司。βactin单克隆抗体购于美国Santa Cruz公司,二抗购于北京中杉公司。慢病毒由宁波大学生化实验室包装。细胞LAMA4基因的Genebank编号为NM 001105208。
1.2 方法
1.2.1 细胞培养 Hep-2喉癌细胞株培养在含10%FBS的DMEM培养基中,置于5%CO237℃恒温培养箱中。
1.2.2 重组慢病毒感染Hep-2喉癌细胞株 用携带LAMA4全基因序列和LAMA4的小干扰RNA(sma11 interfering RNA,siRNA)序列的慢病毒感染Hep-2细胞株。将5×105个Hep-2细胞接种于24孔板,融合度达到50%~60%时分别用LAMA基因和siRNA的慢病毒和空载体病毒感染复数为50的病毒感染Hep-2细胞,72h后用荧光显微镜观察绿色荧光蛋白(green f1uorescent protein,GFP)表达阳性的细胞,计算重组慢病毒感染效率(重组慢病毒感染效率=GFP阳性细胞数/该视野下的总细胞数)。
1.2.3 基质金属蛋白酶-2(matrix meta11oproteinases-2,MMP-2)、膜型基质金属蛋白酶(membranetype-1 MMP,MT1-MMP)及LAMA4蛋白表达量检测 (1)分别将基因沉默组、过表达组和空载体病毒对照组细胞收集起来,PBS洗涤2次,去上清液,迅速加入100μ1细胞裂解液,用细胞刮刀刮下细胞后超声裂解,4℃离心20min。取上清液BCA法测定蛋白浓度后,按比例加入5×SDSPAGE上样缓冲液,沸水浴10min后保存待用。配制5%浓缩胶及10%分离胶后,取20μg蛋白上样进行SDSPAGE电泳。80V电压于浓缩胶中电泳,待溴酚蓝达到浓缩胶和分离胶分界时,改用120V电压继续电泳,至溴酚蓝至凝胶底部时终止电泳。电泳后4℃下12V转膜过夜,室温封闭60min。将蛋白条带按照分子量大小裁剪后,放入LAMA4和β-actin的相应一抗(兔多克隆抗体)中,4℃过夜。次日,先将孵育一抗的PVDF膜取出,用缓冲液洗涤后,加入相应的二抗(山羊抗兔)进行孵育,1h后将条带取出,进行曝光处理,同时将膜上相应的内参条带置入内参抗体中进行孵育过夜,次日孵育二抗后曝光处理。以结果条带与内参β-肌动蛋白(βactin)吸光度值的比值作为目的条带测量值。(2)依照前一步骤方法对3组细胞的蛋白分别进行提取,测定蛋白浓度后待用。将各组细胞取20μg蛋白上样进行SDSPAGE电泳,转膜。剪裁相应分子量大小的PVDF膜孵育MMP-2、MT1-MMP的兔多克隆抗体,4℃过夜。次日孵育山羊抗兔二抗后,进行曝光处理。同样与内参比较后进行灰度分析得出测量值。
1.2.4 Hep-2细胞侵袭能力测定 将Transwe11小室(BD公司)上下室之间用孔径为8 μm的硝酸酯膜分开,膜上铺Matrige1胶,50μg/室。下室用10%FBS作为趋化因子,上室分别加入密度为1×106个/m1的Hep-2细胞400μ1。孵育24h,取出拭去膜上层剩余细胞,用4%多聚甲醛固定,苏木素染色,光学显微镜下观察。每张膜随机取5个视野,实验重复3次,取均值作为最终结果。
1.2.5 细胞生长检测 采用MTT法。选对数生长期的各组细胞,胰蛋白酶消化,以5 000个细胞/孔接种于96孔板中。连续培养3d,每天选择3个孔,单孔加入20μ1(5mg/m1)MTT,37℃、5%CO2培养4h;每孔加入150μ1 DMSO,室温下摇床震荡10min,使紫色结晶充分溶解,490nm测定吸光值。
1.2.6 MMP-2和MT1-MMP基因表达量检测 分别提取各组细胞的总RNA,逆转录后,运用Rea1-time PCR方法检测。Rea1-time PCR反应总体系为20μ1,其中上下游引物各1 μ1,cDNA模板2μ1,SYBR Premix Ex TaqⅡ10μ1,双蒸水补足体系至20μ1。反应条件为95℃预变性3min;94℃变性30s、60℃退火30s、72℃延伸30s,共40个循环。PCR反应结束后采用比较阈值法测定目的基因的相对表达水平,可以直接得到目的基因相对于内参基因(GAPDH)的定量。目的基因的表达水平=2-△Ct,其中△Ct=(目的基因Ct-参照基因Ct)。PCR引物序列见表1。
1.3 统计学处理 采用SPSS18.0统计软件,所得数据以表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验。
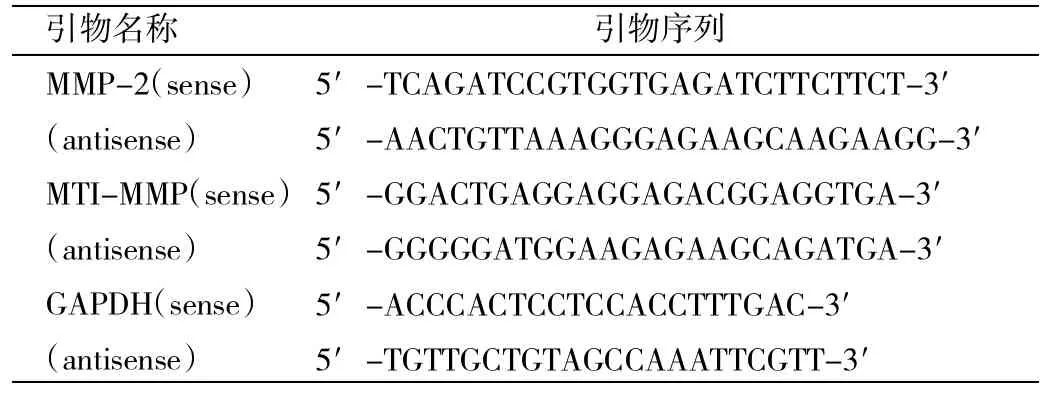
表1 PCR引物序列
2 结果
2.1 慢病毒感染效率 携带LAMA4基因片段和小干扰片段的重组慢病毒成功构建,包装慢病毒后,浓缩病毒悬液滴度达到5×105TU/μ1。重组慢病毒感染Hep-2细胞72h后,倒置荧光显微镜下观察各孔中GFP的表达量,携带LAMA4全基因序列和siRNA序列的慢病毒及空载体病毒感染组中,Hep-2细胞GFP表达均成阳性,且阳性率达90%,详见图1。

图1 光镜下重组慢病毒感染Hep-2细胞株的情况(×200)
2.2 过表达和基因沉默后喉癌细胞中LAMA4蛋白水平的变化 对照组LAMA4蛋白相对表达量为0.56± 0.15,基因沉默组为0.39±0.16,过表达组为0.87±0.20,其电泳图见图2。基因沉默组相对表达量明显低于对照组,过表达组相对表达量明显高于对照组,差异均有统计学意义(均P<0.05)。

图2 LAMA4蛋白相对表达量的变化
2.3 LAMA4基因表达变化对Hep-2细胞侵袭能力的影响 Transwe11小室检测发现,对照组Transwe11细胞数为(26±3.61)个,基因沉默组及过表达组分别为(45± 5.80)、(14±3.26)个,基因沉默组及过表达组与对照组的差异均有统计学意义(均P<0.05)。
2.4 LAMA4基因表达变化对喉癌细胞株生长的影响见表2。

表2 第1~3天喉癌细胞株生长情况的比较(吸光值)
由表2可见,第1~3天各组喉癌细胞生长情况并无明显区别,差异均无统计学意义(均P>0.05)。
2.5Hep-2细胞中MMP-2及MT1-MMP基因及蛋白表达变化的比较 见表3。

表3 Hep-2细胞中MMP-2及MT1-MMP基因表达变化的比较
由表3可见,与对照组比较,基因沉默组及过表达组MMP-2及MT1-MMP基因与蛋白表达均发生明显变化,差异均有统计学意义(均P<0.05)。
3 讨论
在肿瘤组织中,基底膜和细胞外基质是肿瘤侵袭和转移过程中的第一道屏障,在肿瘤的发生、发展过程中起着重要的生物学作用。研究表明,基底膜断续或消失的实验组,颈淋巴结转移率远高于基底膜完整组。而肿瘤转移则需先突破基底膜的限制,而后侵袭周围组织,进而向远处转移。而完整的基底膜则具有限制肿瘤转移的作用。Laminin-8是基底膜中主要的非胶原成分,参与细胞的生长、运动、分化等生物过程,介导肿瘤细胞和基底膜的黏附;其表达缺失程度提示着基底膜的破坏程度,预示肿瘤的稳定性同时也受到了破坏[6]。而LAMA4是Laminin-8中重要的功能型亚基,其主要参与了肿瘤转移过程中细胞间质的降解、细胞微环境改变等步骤[3]。有研究表明,LAMA4可能具有抑制肿瘤转移的作用[5,7]。
本研究成功构建了携带LAMA4基因片段和小干扰片段的重组慢病毒,包装慢病毒后浓缩病毒悬液滴度达到5×105TU/μ1。Transwe11侵袭小室实验证明,在LAMA4基因过表达时,穿过小室的细胞数相比对照组减少,提示喉癌细胞株Hep-2的侵袭能力减弱。而将LAMA4基因沉默后,Hep-2细胞的侵袭能力显著增强。由此可推断,LAMA4在喉癌细胞侵袭转移的过程中可能发挥着重要的作用。LAMA4的表达量与喉癌细胞的侵袭和转移能力呈负相关。细胞侵袭能力增强会直接导致喉癌的局部浸润、颈淋巴结转移和远处转移,因此LAMA4在喉癌组织中的表达量可以作为预测喉癌侵袭和转移的重要因素之一。LAMA4影响喉癌侵袭和转移的分子机制目前还不明确,而增加LAMA4基因的表达很可能对喉癌的侵袭和转移产生抑制作用。因此,LAMA4基因可以作为喉癌药物治疗的潜在靶点。
在肿瘤侵袭和转移的诸多研究中MMPs具有重要的意义。MMPs是一组锌离子依赖性蛋白,其中MMP-2和MT1-MMP作为肿瘤细胞的侵袭标志物,与基底膜的降解有着重要的关系[7-8],在肿瘤的发生、发展中发挥着重要的作用[9]。为了进一步探寻LAMA4的作用机制,采用Western B1ot检测发现,LAMA4表达量变化时MMPs家族蛋白表达随之发生变化;当LAMA4基因被沉默后,MMP-2和MT1-MMP的表达升高,这进一步证实了当LAMA4表达量减少时,喉癌细胞的侵袭相关分子的表达量升高,侵袭能力增强;而LAMA4过表达时,MMP-2和MT1-MMP的表达量随之下降,喉癌细胞的侵袭能力进而降低。因此可以推断,作为基底膜中的重要组成部分,LAMA4表达量的变化则与喉癌细胞侵袭和转移的能力有着密切的联系,LAMA4可能是通过MMPs蛋白家族发挥作用。
[1]Ji X,Jingli J V,Liu Q,et al.Construction of the superantigen SEAtransfected laryngocarcinoma cells[J].Lin chuang er bi yan hou tou jing wai ke za zhi=Journal of clinical otorhinolaryngology, head,and neck surgery,2013,27(7):376-378.
[2]陈英武,张靖华,平金良,等.E-cadherin,FAK在声门上型喉癌组织中的表达及其与颈淋巴结隐性转移的相关性[J].浙江医学,2011,33(10): 1439-1440.
[3]Aumailley M.The laminin family[J].Cell adhesion&migration,2013, 7(1):48-55.
[4] 夏晓丽,齐恒,刘清明,表皮钙黏蛋白和层粘连蛋白在喉癌及下咽鳞状细胞癌中表达及意义[J].中华实用诊断与治疗杂志,2012,26(7):680-681.
[5]Yang X,Li W,Guo L.The study on the anti-tumor function of lysozyme in the regional lymph nodes of laryngocarcinoma patients[J].Lin chuang er bi yan hou ke za zhi=Journal of clinical otorhinolaryngology,1998,12(2):51-53.
[6]Badran E F,Battah H A,Akl K F,et al.Detection of novel LAMA3 mutation in Herlitz junctional epidermolysis bullosa in a Jordanian family[J].The Australasian Journal of Dermatology,2013,54(3): 218-221.
[7]Secco M,Bueno C Jr,Vieira N M,et al.Systemic delivery of human mesenchymal stromal cells combined with IGF-1 enhances muscle functional recovery in LAMA2 dy/2j dystrophic mice[J].Stem cell reviews,2013,9(1):93-109.
[8]Rah B,Amin H,Yousuf K,et al.A novel MMP-2 inhibitor 3-azidowithaferin A (3-azidoWA)abrogates cancer cell invasion and angiogenesis by modulating extracellular Par-4[J].PloS one,2012, 7(9):e44039.
[9]Cui J,Chen S,Zhang C,et al.Inhibition of MMP-9 by a selective gelatinase inhibitor protects neurovasculature from embolic focal cerebral ischemia[J].Molecular neurodegeneration,2012,7:21.
[10]Oyanagi J,Ogawa T,Sato H,et al.Epithelial-mesenchymal transition stimulates human cancer cells to extend microtubule-based invasive protrusions and suppresses cell growth in collagen gel[J].PloS one,2012,7(12):e53209.
Laminin α4(LAMA4)regulates proliferation and invasion of laryngeal carcinoma Hep-2 cells
ObjectiveTo investigate the effects of laminin α4(LAMA4)on proliferation and invasion of laryngeal carcinoma Hep-2 cells.Methods Recombinant lentiviral vector with completed LAMA4 gene and LAMA4 siRNA sequences combined with GFP were constructed,respectively.Both of them were transfected into Hep-2 cells.The over-expression and knock-down rates were verified by western blot.MTT and Transwell assays were performed to determine the proliferation and invasion ability of transfected Hep-2 cells.The expressions of MMP-2,MT1-MMP proteins and mRNA were evaluated by Western blot and real-time PCR.Results Recombinant lentiviruses with LAMA4 gene and LAMA4 siRNA were successfully constructed.The virus titer was 5×105TU/μl.Lentivirus-mediated LAMA4 and LAMA4 siRNA were transfected into Hep-2 cells.Lower LAMA4 expression was detected in LAMA4 siRNA group,while over-expression was detected in LAMA4 group as compared to the control group(P<0.05).No effect on cell proliferation was detected in both LAMA or LAMA4 siRNA-transfected Hep-2 cells.Compared to control group the invasive ability of Hep-2 cells was increased in LAMA4 over-expression group and reduced in LAMA4 knock-down group(P<0.05);meanwhile the expression of MMP-2,MT1-MMP proteins and mRNA levels were increased in LAMA4 over-expression group and decreased in LAMA4 knockdown group(P<0.05).Conclusion LAMA4 may be involved in the invasion of laryngeal carcinoma Hep-2 cells by regulating MMP-2 and MT1-MMP expression,suggesting that LAMA4 would be a potential therapeutic target for laryngocarcinoma.
Gene Laryngocarcinoma Lentivirus Invasion Proliferation

2013-11-06)
(本文编辑:欧阳卿)
宁波市科技创新团队项目(2012B82019)
315040 宁波大学医学院附属李惠利医院耳鼻喉科(邬振华、沈志森);宁波大学医学院生物化学与分子生物学研究所(李群、龚朝晖)

