单侧腰痛患者腰椎多裂肌萎缩相关因素研究
钭大雄 王君瑞 陈绍东 陶涛
单侧腰痛患者腰椎多裂肌萎缩相关因素研究
钭大雄 王君瑞 陈绍东 陶涛
目的 探讨单侧腰痛患者多裂肌萎缩的相关因素。 方法 单侧腰痛患者62例,记录腰痛时间长短,进行视觉模拟疼痛(VAS)评分和Oswestry功能障碍指数(ODI)评分,腰椎MRI进行病变节段多裂肌萎缩评估。 结果 单侧腰痛病史3~42个月,平均(16.6±8.3)个月;VAS评分5.6±1.2;ODI评分(61.2±9.6)%。疼痛侧多裂肌净横截面积(731.2±192.6)mm2,非疼痛侧多裂肌净横截面积(862.5±228.1)mm2,差异有统计学意义(P<0.01)。疼痛侧多裂肌T2信号比率2.02±0.21,非疼痛侧多裂肌T2信号比率1.75±0.15,差异有统计学意义(P<0.01)。以非疼痛侧为标准,疼痛侧多裂肌萎缩(15.3±4.9)%,T2信号比率增高(13.3±6.8)%,均与腰痛病史时间长短、VAS疼痛评分及ODI功能障碍指数呈正相关(P<0.01)。 结论 腰痛病史时间长短、疼痛及功能障碍程度是引起腰痛患者多裂肌萎缩的相关因素。
腰痛 多裂肌 萎缩
腰痛是严重影响人类健康的全球性疾患之一,60%~80%的成年人均经历过不同程度的腰痛,是仅次于上呼吸道疾患而就诊的第二大常见临床症状[1]。多项调查性研究表明,在一些发达国家,腰痛是失业甚至致残的主要原因之一;由此带来的经济损失巨大,仅美国,腰痛所导致的费用总额已超过国民生产总值的1.5%;在德国,平均每人每年因腰痛所产生的费用大约为1 322欧元[2]。既往研究表明,腰痛与多裂肌萎缩密切相关[3-4];临床上,通过脊旁肌功能锻炼,可明显缓解腰痛症状,也说明脊旁肌萎缩可能是引起腰痛的一个重要原因[5]。本研究通过单侧腰痛病例MRI检查,与同节段双侧多裂肌配对比较,分析腰痛对多裂肌萎缩的影响及相关因素。
1 资料和方法
1.1 一般资料 回顾性分析2012-6—2013-12在本院骨科门诊治疗的单侧腰痛患者。纳入标准:(1)单侧腰痛反复发作,病程3个月以上;(2)影像学检查病变为单节段、单侧。排除标准:(1)有双侧腰痛病史;(2)影像学检查显示双侧神经根均有明显压迫;(3)有手术、骨折、脊柱畸形、肿瘤等病史。最终选取62例患者,其中男38例,女24例,年龄34~75岁,平均54.5岁;单侧腰椎间盘突出50例,单侧神经根管狭窄12例;L3~4节段6例,L4~5节段38例,L5~S1节段18例;BMI指数(21.26±1.63)kg/m2。
记录患者单侧腰痛病史时间长短,进行视觉模拟疼痛(VAS)评分和Oswestry功能障碍指数(ODI)评分。
1.2 方法 多裂肌萎缩通过多裂肌净横截面积的减小和脂肪组织的沉积(MRI T2加权像上表现为高信号)进行评估。MRI检查采用1.5T超导系统核磁成像(德国西门子公司生产),使用脊柱表面线圈。所有MRI影像采用T2加权,自旋回波脂肪饱和脉冲序列,像素大小0.94× 0.47 mm,矩阵255×512,扫描层厚4mm。扫描时,患者俯卧于工作台上,双膝部软枕垫高,保证双侧的脊旁肌在重力作用下向两侧均匀分布。MRI平扫根据矢状面定位线和相关解剖学标志,选取前后两次相近层面MRI横断影像。计算机上下载并安装图像处理软件ImageJ 1.43(美国国立卫生研究院免费提供下载,网址http://rsbweb.nih. gov/ij/down1oad.htm1)对储存的MRI图像进行分析。每一患者选取L3~4、L4~5和L5~S1节段腰椎横断位影像,对双侧多裂肌分别进行测量。多裂肌净横截面积通过在多裂肌轮廓上勾勒不规则曲线进行测量,并尽可能去除脂肪组织、骨性结构和其他软组织结构(图1右)。多裂肌脂肪化程度通过不规则曲线勾勒肌肉解剖轮廓,包括肌内脂肪组织,进行平均 T2信号强度测量(图1左)。选取腰大肌中心区域约 100mm2大小肌肉面积测量平均 T2信号强度值,多裂肌 T2信号比率=多裂肌平均 T2信号强度值/100mm2腰大肌平均 T2信号强度值。

图1 多裂肌MRI测量[1为右侧多裂肌净横截面积,2为右侧多裂肌整个区域,3为选取的腰大肌中心区域;Area为选定区域面积,Mean为选定区域平均灰度值]
1.3 统计学处理 采用SPSS16.0统计软件,计量资料以表示,组间比较采用配对t检验,相关性分析采用Pearson积差相关系数分析。
2 结果
62例患者有腰痛病史3~42个月,平均16.6个月。VAS评分5.6±1.2,ODI功能障碍指数(61.2±9.6)%。
患者疼痛侧与非疼痛侧多裂肌横断面净横截面积及MRI T2信号比率比较见表1。

表1 患者疼痛侧与非疼痛侧多裂肌横断面净横截面积及MRI T2信号比率比较
由表1可见,疼痛侧多裂肌净横截面积、T2信号比率与非疼痛侧比较差异均有统计学意义(均P<0.01)。
以非疼痛侧为标准,疼痛侧多裂肌净横截面积减小(15.3±4.9)%,多裂肌明显发生了萎缩;而T2信号比率增高(13.3±6.8)%,多裂肌脂肪化更明显。
患者多裂肌净横截面积减小率(%)、MRI T2信号比率增高率(%)与腰痛病史时间长短、VAS疼痛评分及ODI功能障碍指数相关性分析见表2。
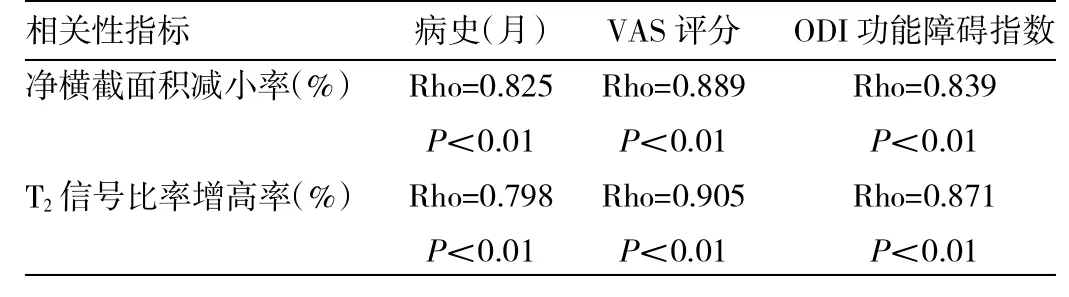
表2 患者多裂肌净横截面积减小率(%)、MRI T2信号比率增高率(%)与腰痛病史时间长短、VAS疼痛评分及ODI功能障碍指数相关性分析
由表2可见,Pearson积差相关系数显示,多裂肌净横截面积减小率与腰痛病史时间长短、VAS疼痛评分和ODI功能障碍指数呈明显正相关(P<0.01);多裂肌T2信号比率增高率与与腰痛病史时间长短、VAS疼痛评分和ODI功能障碍指数也呈明显正相关(P<0.01)。
3 典型病例
例1 女,54岁。左侧腰痛病史24个月,MRI提示左侧椎间盘突出;VAS评分6.1分,ODI功能障碍指数68.9%;左侧多裂肌净横截面积585.5mm2,右侧多裂肌净横截面积712.4mm2,疼痛侧多裂肌萎缩17.8%;左侧多裂肌T2信号比率2.33,右侧多裂肌信号比率2.14,疼痛侧T2信号比率增高8.2%,见图2。
例2 男,62岁。VAS评分5.6分,ODI功能障碍指数62.2%;左侧多裂肌净横截面积799.9mm2,右侧多裂肌净横截面积698.2mm2,疼痛侧多裂肌萎缩12.7%;左侧多裂肌T2信号比率1.64,右侧多裂肌信号比率1.78,疼痛侧T2信号比率增高7.9%,见图3。
4 讨论
腰痛致病原因众多,包括关节突关节紊乱、椎间盘退变、神经根压迫、腰椎管狭窄、肌肉痉挛等,既往研究虽证实了腰痛与多裂肌萎缩密切相关,但是到底是腰痛引起多裂肌萎缩还是多裂肌萎缩引起腰痛,目前尚不明确[3-4]。我们的研究通过单侧腰痛病例,同一病例双侧对比研究发现,腰痛侧多裂肌净横截面积明显小于非腰痛侧,而脂肪化程度则明显重于非腰痛侧,证明腰痛是引起多裂肌萎缩的重要原因。
同时我们认为失神经改变和慢性废用可能是腰痛致多裂肌萎缩的两个重要原因。研究发现骨骼肌失神经后,骨骼肌迅速发生萎缩,肌肉组织被纤维和脂肪组织替代[6]。解剖研究表明[7],多裂肌由腰神经后支的内侧支唯一支配,神经走行于多裂肌深面,并且每个肌束仅有单一分支支配,分支间并无交通。L1~4内侧支从后支的内侧索发出,向后向下穿过横突间隙,走在横突底部和上关节突连接处的沟内,在关节突关节的下方转向内侧,通过骨纤维管道,进而向内下横过椎板,进入多裂肌深面,分支支配多裂肌,L5内侧支在腰骶关节突关节的下方转向内进入多裂肌深面。Hodges等[8]在猪模型中,通过切断腰神经后大支内侧分支,发现3d后多裂肌即发生了明显的萎缩。本研究中单侧腰痛病例为单侧腰椎间盘突出和神经根管狭窄症患者,均对疼痛侧腰神经根产生明显压迫。而肌电图研究也已证实椎间盘突出或神经根管狭窄,均可导致脊旁多裂肌的失神经改变(纤颤电位和高尖波)[9]。腰痛患者常因疼痛缺乏腰部活动,导致脊旁多裂肌废用,毛细血管反应能力下降,肌肉内毛细血管关闭的时间延长,肌肉血供不足,多裂肌长期处于缺氧状态,肌糖元不能得到充分利用,大量乳酸及各种代谢产物在组织内堆积,进而导致肌肉水肿,长期作用,使得肌肉逐渐变性萎缩,最后为脂肪组织所替代,产生废用性肌萎缩[5]。研究表明,椎间盘和多裂肌之间存在神经反射通路,椎间盘退变可反复刺激该反射通路,使多裂肌长期处于痉挛状态,导致肌肉发生缺血性改变[4]。一项腰痛和健康人群的影像学对比研究发现,腰痛引起的废用和炎症反应是引起腰背肌萎缩的重要原因[10]。
腰椎脊旁肌从内向外依次分为多裂肌、最长肌和髂肋肌;其中多裂肌是腰骶部面积最大,也是稳定腰椎最重要的肌肉;同时,多裂肌也是唯一从腰背部跨越到骶部的肌肉,是维持腰骶区域稳定性的最主要肌肉。多裂肌起于上位椎体的棘突,斜行走向下位椎体的横突,可分为表层肌束和深层肌束。表层肌束可跨越多个椎体,具方向特异性,对脊柱活动起定向作用;深层肌束只分布于两个相邻椎体间,对脊柱节段间的旋转运动和剪切力起控制作用[7]。研究表明,一旦多裂肌发生不对称性萎缩,原有脊旁肌之间的力学平衡被打破,引发脊柱不稳,加速脊柱退变,甚至使腰痛症状加重,进而恶性循环,进一步损害腰椎脊柱[4]。本研究发现,多裂肌萎缩程度与腰痛病史时间长短、VAS疼痛评分和ODI功能障碍指数密切相关。因此我们认为,早期对单侧腰痛病例进行药物治疗缓解疼痛;对椎间盘巨大突出病例进行手术干预,解除神经根压迫;早期进行腰背肌功能锻炼;预防多裂肌萎缩,保护腰椎脊柱的稳定,具有十分重要的意义。
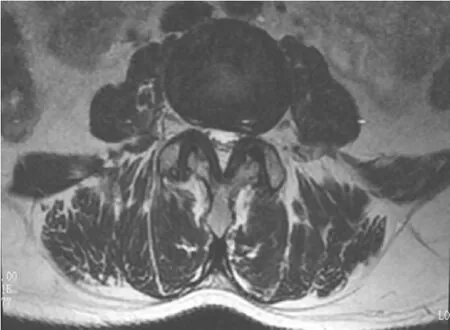
图2 例1MRI提示左侧椎间盘突出
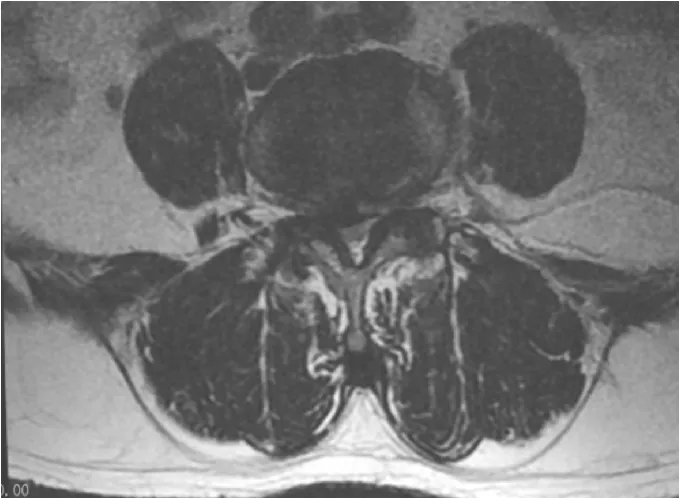
图3 例2MRI提示右侧神经根管狭窄
[1]Deyo R A,Weinstein JN.Lowbackpain[J].NEnglJ Med,2001,344 (5):363-70.
[2]Hoy D,Bain C,Williams G,et al.A systematic review of the global prevalence of low back pain[J].Arthritis Rheum,2012;64(6): 2028-37.
[3] 符楚迪,张志敬,潘兵,等.应用MRI观察多裂肌萎缩及与下腰痛关系的研究[J].浙江医学,2010,32(9):1366-1368.
[4]Freeman M D,Woodham M A,Woodham A W.The role of the lumbarmultifidusinchronic lowbackpain:a review[J].PMR,2010,2 (2):142-167.
[5]Olivier N,Thevenon A,Berthoin S,et al.An exercise therapy program canincrease oxygenation and blood volume of the erector spinae muscle duringexercise in chronic low back pain patients[J].Arch Phys Med Rehabil,2013,94(3):536-542.
[6]Dulor J P,Cambon B,Vigneron P,et al.Expression of specific white adipose tissue genes in denervation-induced skeletalmuscle fatty degeneration[J].FEBS Lett,1998,439(1-2):89-92.[7]范顺武,胡志军,方向前.腰椎后路手术中脊旁肌保护的相关思考[J].中华骨科杂志,2011,31(4):400-407.
[8]Hodges P,Holm A K,Hansson T,et al.Rapid atrophy of the lumbar multifidusfollows experimental disc or nerve root injury[J].Spine(Phila Pa 1976),2006,31(25):2926-2933.
[9]Yoshihara K,Nakayama Y,Fujii N,et al.Atrophy of the multifidusmuscle in patients with lumbar disk herniation:histochemical andelectromyographicstudy[J].Orthopedics,2003,26(5):493-495.
[10]Parkkola R,Ryt?koski U,Kormano M.Magnetic resonance imaging of the discsand trunk muscles in patients with chronic lowbackpainandhealthycontrolsubjects[J].Spine(PhilaPa1976), 1993,18(7):830-836.
Factors related to lumbar multifidus muscle atrophy in patients with unilateral low back pain
ObjectiveTo analyze the related factors to multifidus muscle atrophy in patients with unilateral low back pain (LBP). Methods Sixty-two patients with unilateral LBP underwent magnetic resonance imaging (MRI)examination,and the medical history,visual analogue scale(VAS)and Oswestry disability index(ODI)were reviewed retrospectively.Results The history of unilateral LBP was 16.6±8.3 months(3~42months),VAS score was 5.6±1.2,and ODI was 61.2±9.6%.The lean cross-sectional area(CSA)of multifidus muscle was 731.2±192.6mm2at the ipsilateral side of LBP,significantly lower than that at the contralateral side(862.5±228.1mm2,P<0.001).The T2signal intensity ratio of multifidus muscle was 2.02±0.21at the ipsilateral side of LBP,significantly higher than that at the contralateral side(1.75±0.15,P<0.001).Compared to contralateral multifidus muscle,the reduction of lean CSA was 15.3±4.9%,and the increase of T2signal intensity ratio was 13.3±6.8%at the LBP side,and both were significantly correlated with the medical history,VAS score and ODI value.Conclusion The length of medical history,VAS score and ODI were factors related to multifidus muscle atrophy in patients with LBP.
Low back pain Multifidus muscle Atrophy

2014-01-28)
(本文编辑:田云鹏)
321403 缙云县钭氏伤科医院骨科

