桩蛋白和踝蛋白在甲状腺癌中的表达及临床意义
尹英爱,赵树鹏,齐凤杰,高立香
1辽宁医学院病理学教研室,辽宁锦州 121000;2辽宁医学院附属第一医院 普外科,辽宁锦州 121001
甲状腺癌是一种常见的内分泌肿瘤,侵袭与转移是导致患者治疗失败和死亡的主要原因之一。多项研究表明细胞骨架蛋白有调节细胞移动、播散等的功能,而肿瘤的浸润和转移与细胞粘附力、移动力的改变直接相关,paxillin[1-3]、talin[4-5]作为重要的细胞骨架蛋白与肿瘤细胞的浸润和转移必定存在着一定的联系。本文着重研究paxillin和talin两种细胞骨架蛋白在甲状腺癌中的表达,探讨其应用于临床病理分析的可能性,以及两种细胞骨架蛋白的相关性,为临床诊断、治疗及监测患者预后提供参考。
材料和方法
1 标本来源 1)免疫组化标本:收集于2005 -2012年辽宁医学院附属第一医院病理科存档的甲状腺手术石蜡标本190例,其中甲状腺癌90例,甲状腺腺瘤35例,甲状腺良性病变45例,另取癌旁甲状腺组织20例作为对照。所有病例术前均未放、化疗,标本均经体积分数10%的福尔马林固定,石蜡包埋。2)Western Blotting标本:为辽宁医学院附属第一医院甲状腺外科2010年l月-2012年12月甲状腺全切或者部分切除手术标本,手术后切下的标本迅速放入-80℃液氮速冻,该标本共100例,50例甲状腺癌和癌旁组织(19例乳头状癌、髓样癌12例,滤泡癌10例,未分化癌9例),50例甲状腺腺瘤。
2 免疫组化染色及结果判定 4 μm厚切片常规脱蜡,水化,PBS缓冲液冲洗3次,每次3 min。柠檬酸高压修复2 min,滴加3% H2O2,室温下孵育10 min,清除内源性过氧化物酶的活性。滴加paxillin抗体或talin抗体(鼠抗人单克隆抗体购自美国R&CD公司,1∶100稀释)50 μl,4℃冰箱过夜,PBS缓冲液冲洗3次,每次5 min,滴加二抗(SP免疫组化试剂盒购自福州迈新公司),37℃孵育30 min。DAB显色,苏木素复染,常规脱水,透明,封片。以PBS代替一抗为阴性对照,以已知阳性切片为阳性对照。由两位医师采用双盲法观察每张切片,paxillin、talin的阳性表达位于细胞膜和或细胞浆,细胞外间质中也有少量表达,呈黄色、棕黄色或黄褐色。每张切片随机选5个视野(×400)计算阳性细胞数,以阳性细胞占全部肿瘤细胞的百分比分级:阳性细胞数<10%为(--),10% ~ 25%为(+),26% ~ 50%为(++),>50%为(+++)。
3 Western Blotting及结果判定 对于甲状腺癌、甲状腺腺瘤和癌旁组织三组,每组随机取10例(也就是10小块)分析paxillin或talin的表达。组织蛋白提取、浓度测定及定量、SDS-PAGE、电转膜以及Western Blotting参见《分子克隆》和试剂盒说明书进行;paxillin、talin抗体的稀释度为1:200。将胶片进行扫描Bio-rad Quantity One图象处理系统分析目标带的分子量和净光密度值(IOD)。选择β-actin(分子量43KD)作为内参,paxillin、talin蛋白分别在68KD和270KD处显示特异性条带。对目的条带在β-actin为内参下进行IOD分析,得出比值。
4 统计学处理 将实验数据用SPSS19.0统计软件进行统计分析,计数资料进行χ2检验,以P<0.05为差异有统计学意义。
结 果
1 免疫组织化学检测 paxillin、talin在甲状腺病变中的表达:paxillin、talin在癌旁甲状腺组织中呈弱阳性表达,甲状腺腺瘤中paxillin、talin的表达率分别为57.1%和54.2%,在甲状腺癌组织中阳性率为88.9%和84.4%。甲状腺癌中paxillin、talin的表达率与甲状腺腺瘤组、结节性甲状腺肿组和癌旁甲状腺组织组比较差异有统计学意义(P<0.05)。见表1。
2 甲状腺癌中paxillin、talin的表达与临床病理参数的关系 Paxillin表达于胞膜和胞质(图1),阳性表达率为88.9%(80/90)。talin也表达于细胞膜、胞质(图1),阳性表达率为84.4%(76/90)。二者的表达均与肿瘤浸润深度、淋巴结转移和肿瘤分期相关,但与年龄、性别和组织分型无关,见表2。
3 甲状腺癌组织中paxillin与talin表达间的关系随着病期进展,甲状腺癌组织中paxillin与talin表达明显升高,二者正相关,见表3。
4 Western检测 paxillin分子量为68kD,在甲状腺癌及癌旁组织中均可见paxillin的特异性条带出现(图2),但强度不等,在甲状腺癌中的强度明显高于癌旁组织,差异有统计学意义(P<0.05)。Talin的分子量为270 kD,在甲状腺癌及癌旁组织中均可见Talin的特异性条带出现(图3),但强度不等,甲状腺癌的强度显著高于癌旁组织,差异有统计学意义(P<0.05)。
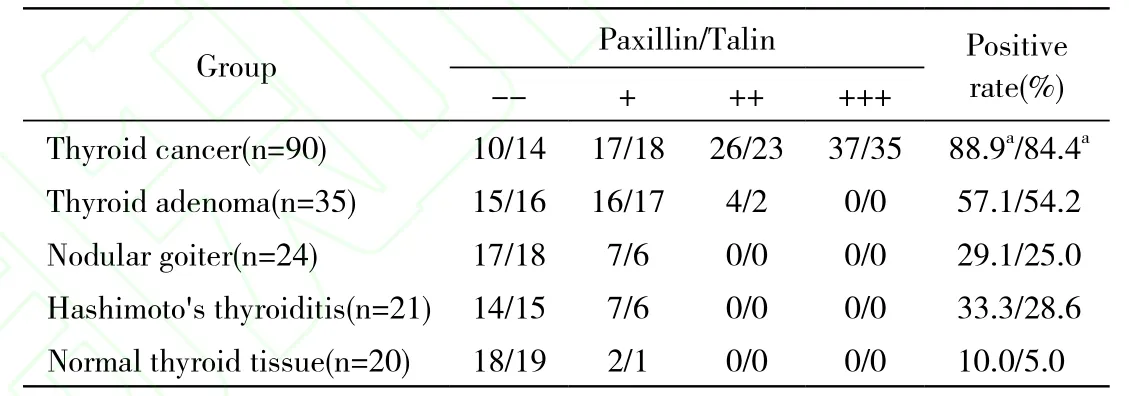
表1 Paxillin和talin在甲状腺各级病变中的表达Tab. 1 Expression of paxillin and talin in thyroid diseases
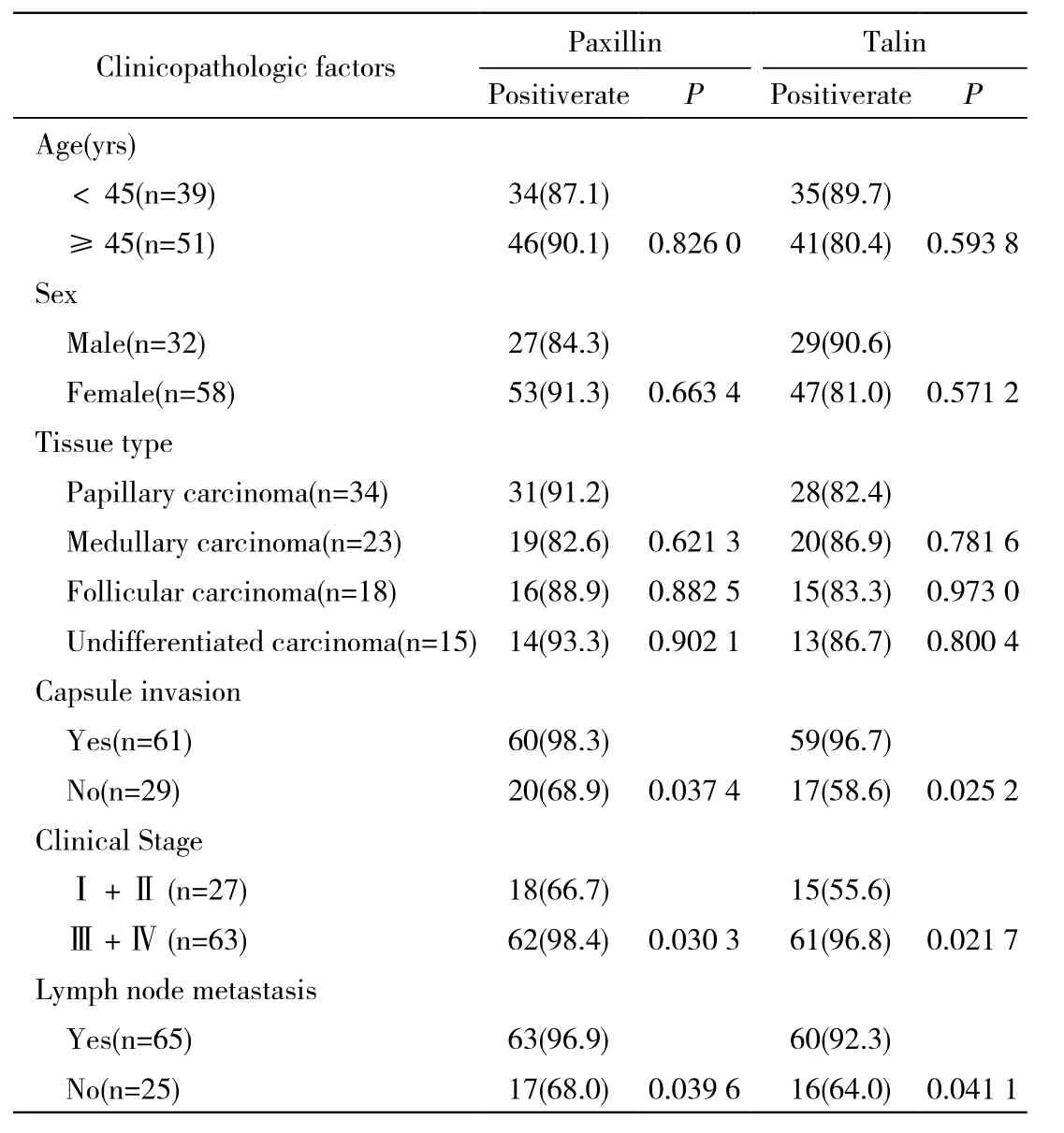
表2 Paxillin、talin表达与甲状腺癌临床病理参数的关系Tab. 2 Relation between paxillin and talin expression and clinicopathological parameters of thyroid cancer(n, %)
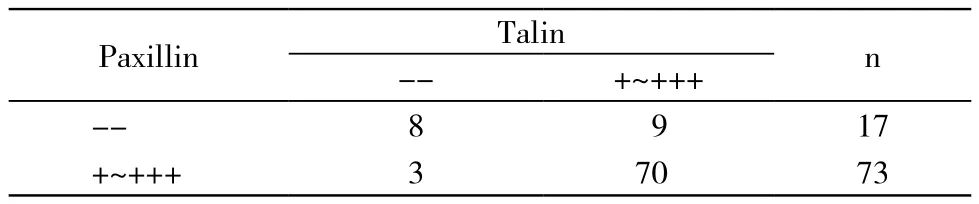
表3 甲状腺癌组织中paxillin与talin表达之间的关系Tab. 3 Relation between paxillin and talin expression in thyroid cancer tissue

图1 paxillin与talin在甲状腺良恶性疾病组织中的分布(SP×200) paxillin/talin在甲状腺癌(A/D)、甲状腺腺瘤(B/E)、桥本氏甲状腺炎(C/F)中的表达Fig. 1 Expression of paxillin and talin in thyroid cancer tissue (A/ D), thyroid adenoma tissue (B/E) and Hashimoto's thyroiditis tissue (C/F)

图2 paxillin蛋白在甲状腺良恶性疾病组织中表达水平A: 甲状腺癌; B: 甲状腺腺瘤; C: 癌旁组织Fig. 2 Expression of paxillin in thyroid cancer tissue (A), thyroid adenoma tissue (B), and normal thyroid tissue (C)
讨 论

图3 talin蛋白在甲状腺良恶性疾病组织中表达水平A: 甲状腺癌; B: 甲状腺腺瘤; C: 癌旁组织Fig. 3 Expression of talin in thyroid cancer tissue (A), thyroid adenoma tissue (B), and normal thyroid tissue (C)
甲状腺癌是发病率最高的内分泌系统恶性肿瘤之一,与甲状腺癌预后相关的主要指标包括肿瘤的浸润程度和转移范围。肿瘤的侵袭和转移是肿瘤发生和演进过程中最危险的阶段,因此检测肿瘤侵袭相关信号分子对于了解肿瘤侵袭和转移、估计病情预后具有重要意义[6-7]。Paxillin是一种与细胞侵袭和转移密切相关的信号分子,主要定位于黏着斑。paxillin分子量为68 kD[8],是迄今发现的唯一能与癌基因结合的含Tyr的黏附调节蛋白[9],含5个LD模体和4个LIM结构域[10],Paxillin的上述结构加上其分子中散在Tyr、丝氨酸和苏氨酸磷酸化位点使其在参与黏着斑的组装、细胞黏附和迁移过程中发挥重要作用[11]。
本研究结果显示,Paxillin在癌旁正常甲状腺组中已有表达,在甲状腺良性病变、甲状腺腺瘤中表达逐渐增强,在甲状腺癌组中表达最强。由于Paxillin可与病毒癌基因v-Src蛋白、v-Crk蛋白和BCR/ABL癌性融合蛋白等多种致瘤性蛋白结合,扰乱、甚至误导正常黏附和控制细胞增殖所需的生长因子信号级联反应[12],因此,Paxillin的表达上调可能是组织恶性转化的早期标志。本研究结果还发现,Paxillin在伴有淋巴结转移的甲状腺癌组中表达的阳性率显著高于不伴有淋巴结转移者,表明Paxillin可能对甲状腺癌细胞的移动起促进作用。研究已发现,在高转移潜能乳腺癌细胞中Paxillin在基因和蛋白水平的表达均高于低转移潜能乳腺癌细胞,高转移潜能乳腺癌细胞的黏附率高于低转移潜能乳腺癌细胞[13];肝细胞癌患者中Paxillin的阳性率在低分化组高于高分化组伴有门静脉癌栓形成组高于无癌栓形成组,伴有肝外转移组高于无肝外转移组[14],与本研究相符。提示癌组织中Paxillin表达升高与甲状腺癌的转移有关,可能使甲状腺癌细胞运动能力增强,与其周围的非肿瘤细胞之间的局部黏附作用加强,肿瘤细胞更容易发生侵袭和迁移,进而形成转移。
Talin是由两个270 KD的亚单位组成的反向平行的同源二聚体,它连接整合素和肌动蛋白,也是一种重要的细胞骨架蛋白。talin包含一保守的actin结合区ILWEQ,此外,还含有paxillin、vinculin、磷脂及跨膜蛋白layilin的结合位点[15]。Talin是第一个被发现的actin结合蛋白,研究发现它能够直接接结合整合素(β亚基的胞浆尾),并介导与actin细胞骨架的连接[16]。talin对整合素-细胞骨架间的早期机械连接起着至关重要的作用;并且paxillin、vinculin及tensin等其它细胞骨架蛋白募集到FAP也离不开talin的参与[17-18]。本研究结果发现talin在癌旁正常甲状腺组织、甲状腺良性病变、甲状腺癌中,其表达逐渐增加,在甲状腺癌中表达最强。本研究还发现有淋巴结转移组的甲状腺癌组织talin的表达水平显著高于无淋巴结转移组;随着甲状腺癌组织浸润程度的加深,talin表达水平增高;并且与肿瘤的临床分期显著相关。这表明talin可能参与甲状腺癌的癌变、侵袭及转移,可能是甲状腺癌淋巴结转移的预测指标,但具体的作用机制有待于进一步的深入研究。
通过采用spearman等级相关分析甲状腺癌组织中paxillin和talin的表达,证明二者具有相关性。本实验提示两种细胞骨架蛋白在甲状腺癌组织的表达有高度的一致性,这与paxillin基因的表达产物是一种细胞骨架上的磷酸蛋白,主要定位于黏着斑,并确定它与talin的结合蛋白相吻合。
综上所述,paxillin和talin可能参与了甲状腺癌的发生、发展、侵袭、转移等生物学行为,因此,paxillin和talin可考虑作为判断甲状腺癌生物学行为、预测肿瘤发展趋势的生物标志。
1 Chen DL, Wang ZQ, Ren C, et al. Abnormal expression of paxillin correlates with tumor progression and poor survival in patients with gastric Cancer[J]. J Transl Med, 2013, 11(1): 277.
2 St-Pierre J, Ostergaard HL. A role for the protein tyrosine phosphatase CD45 in macrophage adhesion through the regulation of paxillin degradation[J]. PLoS One, 2013, 8(7): e71531.
3 Wei W, Li H, Li N, et al. WNT5A/JNK signaling regulates pancreatic Cancer cells migration by Phosphorylating Paxillin[J]. Pancreatology, 2013, 13(4): 384-392.
4 Ellis SJ, Goult BT, Fairchild MJ, et al. Talin autoinhibition is required for morphogenesis[J]. Curr Biol, 2013, 23(18): 1825-1833.
5 Jevnikar Z, Rojnik M, Jamnik P, et al. Cathepsin H mediates the processing of talin and regulates migration of prostate Cancer cells[J]. J Biol Chem, 2013, 288(4): 2201-2209.
6 Zhang F, Saha S, Kashina A. Arginylation-dependent regulation of a proteolytic product of talin is essential for cell-cell adhesion[J]. J Cell Biol, 2012, 197(6): 819-836.
7 Denaro N, Nigro CL, Russi EG, et al. The role of chemotherapy and latest emerging target therapies in anaplastic thyroid Cancer[J]. Onco Targets Ther, 2013, 9: 1231-1241.
8 Feng L, Li M, Zhang QP, et al. Utility of BRAF protein overexpression in predicting the metastasis potential of papillary thyroid carcinoma[J]. Oncol Lett, 2011, 2(1): 59-63.
9 韩敬,张璟.人肾小管上皮细胞在转化生长因子β1诱导下桩蛋白表达研究[J].第三军医大学学报,2006,28(10):1066-1068.
10 杨红军,丁彦青,周军,等.paxillin在大肠癌中的表达及其生物学意义[J].实用肿瘤杂志,2007,22(5):412-415.
11 Brown MC, Turner CE. Paxillin: adapting to change[J]. Physiol Rev, 2004, 84(4): 1315-1339.
12 Smith MA, Blankman E, Deakin NO, et al. LIM domains target actin regulators paxillin and zyxin to sites of stress fiber strain[J]. PLoS One, 2013, 8(8): e69378.
13 Turner CE. Molecules in focus Paxillin[J]. Int J Biochem Cell Biol,1998, 30(9): 955-959.
14 蔡辉, 张涛, 汤为学, 等. Paxillin在高、低转移潜能乳腺癌中的表达及意义[J]. 四川大学学报(医学版), 2010, 41(1): 91-94.
15 Li HG, Xie DR, Shen XM, et al. Clinicopathological significance of expression of paxillin, syndecan-1 and EMMPRIN in hepatocellular carcinoma[J]. World J Gastroenterol, 2005, 11(10): 1445-1451.
16 Borowsky ML, Hynes RO. Layilin, a novel talin-binding transmembrane protein homologous with C-type lectins, is localized in membrane ruffles[J]. J Cell Biol, 1998, 143(2): 429-442.
17 Burridge K, Chrzanowska-Wodnicka M. Focal adhesions,contractility,and signaling[J]. Annu Rev Cell Dev Biol, 1996, 12:463-518.
18 Giannone G, Jiang G, Sutton DH, et al. Talin1 is critical for forcedependent reinforcement of initial integrin-cytoskeleton bonds but not tyrosine kinase activation[J]. J Cell Biol, 2003, 163(2): 409-419.

