HPLC-UV-ELSD法测定益肝乐颗粒中槲皮素、 山柰素、 柴胡皂苷 a 和柴胡皂苷d
谭雄斯
(肇庆医学高等专科学校, 广东 肇庆 526020)
[质 量]
HPLC-UV-ELSD法测定益肝乐颗粒中槲皮素、 山柰素、 柴胡皂苷 a 和柴胡皂苷d
谭雄斯
(肇庆医学高等专科学校, 广东 肇庆 526020)
目的 采用 HPLC-UV-ELSD法测定益肝乐颗粒 (垂盆草、 柴胡、 板蓝根等) 中槲皮素、 山柰素、 柴胡皂苷 a和柴胡皂苷 d 的量。 方法 Hypersil C18色谱柱 (4.6mm×150mm, 5 μm) ; 体积流量 0.8mL/min; 槲皮素和山柰素的检测流动相为甲醇-水-三氟乙酸 (40 ∶60 ∶0.05), 检测波长 360 nm。 柴胡皂苷 a和柴胡皂苷 d 的检测流动相为甲醇-乙腈-水 (25 ∶45 ∶30), ELSD漂移管温度 95 ℃, 载气 (N2) 体积流量 2.4 SLPM/m in。 结果 槲皮素和山柰素分别在0.071 3 ~1.426 μg(r=0.999 7)、 0.056 8 ~1.136 μg(r=0.999 3) 进样量与峰面积呈良好的线性关系, 平均加样回收率分别为 97.73%、 96.97%, RSD (n=6) 分别为 1.63%、 1.52%。 柴胡皂苷 a和柴胡皂苷 d 分别在 0.041 6 ~0.832 0μg(r=0.999 2)、 0.026 7 ~0.534 0 μg(r=0.999 5) 进样量的自然对数值与峰面积的自然对数值呈良好的线性关系, 平均加样回收率分别为 97.35%、 98.04%, RSD(n=6) 分别为 0.81%、 1.16%。 结论 该方法测定结果准确、灵敏、重复性好。
益肝乐颗粒; 槲皮素; 山柰素; 柴胡皂苷a; 柴胡皂苷d
益肝乐颗粒为中药复方制剂,源于卫生部药品标准中药成方制剂第四册,由垂盆草、柴胡、云芝提取物、郁金、板蓝根、五味子等六味药物组成。具有清热利湿,舒肝解郁,扶正固本之功效,可用于湿热蕴蒸,身目俱黄,或两胁痹满疼痛,体倦懒食,溲赤便溏,舌苔黄腻等,西医诊断为急性黄疸型和非黄疸型肝炎,慢性迁延型肝炎等症的治疗[1-2]。原质量标准仅对 该品种进行了显微 鉴别控制,未对方中的任何药味进行定性鉴别或定量测定。为保证产品质量,确保临床疗效,本实验采用高效液相色谱法对垂盆草中槲皮素、山柰素和柴胡中柴胡皂苷 a、 柴胡皂苷 d 进行定量测定方法研究,为完善该制剂质量标准提供依据,能有效控制产品的内在质量,确保人民用药安全有效。
1 材料
高效液相色谱仪 (日本岛津 LC-10ATVP型,岛津自动进样器 SIL-10ADVP); ANASTAR色谱数据工作站; 紫外可见检测器 (型号 SPD-1OAVP);Alltech 2000ES 型 蒸 发光 散 射 器; 槲 皮 素 对 照 品(批号为 100081-200406)、 山柰素对照品 (批号为110861-200405)、 柴 胡 皂 苷 a对 照 品 ( 批 号 为110777-200405) 和柴 胡皂苷 d 对 照品 ( 批号为110778-200404) 均购于中国食品药品检定研究院;益肝乐颗粒 (10 g/袋;批号为 130412, 130420,130424) 购于吉林益民堂制药有限公司; 甲醇、乙腈 (色谱纯, 安徽时联特种溶剂股份有限公司), 三氟乙酸 (色谱纯,科密欧化学国际有限公司)。
2 方法与结果
2.1 槲皮素和山柰素的测定[3-12]
2.1.1 色谱条件及系统适应性 Hypersil C18色谱柱 (4.6 mm×150 mm, 5 μm);流动相为甲醇-水-三氟乙酸 (40 ∶60 ∶0.05); 体积流量为 0.8 m L/min, 检测波长 360 nm。 在此条件下槲皮素和山柰素与其他组分基线分离良好,以槲皮素计理论塔板数应不低于 3 000。
2.1.2 检测波长的选择 分别取槲皮素和山柰素对照品适量, 加流动相溶解制成每 1 mL含 0.05 mg的溶液, 按紫外-可见分光光度法在 300 ~500 nm波长处进行紫外扫描, 结果槲皮素和山柰素对照品均在 360 nm处有最大吸收, 参照 《中国药典》 2010 年版一部垂盆草药材检验项下的检测波长 360 nm, 故检测波长定为 360 nm。
2.1.3 对照品混合溶液的制备 精密称取槲皮素和山柰素对照品适量, 置 100 m L量瓶中, 加甲醇-25%盐酸溶液 (4 ∶1) 混合溶液溶解并稀释至刻度,摇匀,即得对照品混合溶液 (槲皮素为0.071 3 mg/mL和山柰素 0.056 8 mg/mL)。
2.1.4 供试品溶液的制备 取本品适量, 研细,取约 5.0 g, 精密称定, 精密加入甲醇-25%盐酸溶液 (4 ∶1)混合溶液 50 mL, 称定质量,超声 (功率 250W, 频率 35 kHz)处理 20min,放冷, 再称定质量, 用甲醇-25%盐酸溶液 (4 ∶1) 混合溶液补足减失的质量,摇匀,滤过,取续滤液,即得供试品溶液。
2.1.5 阴性对照溶液的制备 按益肝乐颗粒处方比例称取适量除垂盆草的其余药味,按益肝乐颗粒的前处理和制剂生产工艺制成缺垂盆草的阴性样品,按照上述供试品溶液的配制方法制成缺垂盆草的阴性对照溶液。
2.1.6 线性关系考察 分别精密吸取对照品混合溶液 1、 5、 10、 15、 20 μL, 按 “2.1.1” 项下的色谱条件进行测定,以峰面积积分值为纵坐标,槲皮素、山柰素量为横坐标分别绘制标准曲线,槲皮素回归方程为 Y=3.763 1 ×106X-1 288.1, r= 0.999 7; 山柰素为 Y=4.010 8 ×106X+567.9, r= 0.999 3。结果表明槲皮素在 0.071 3 ~1.426 μg进样量与峰面积线性关系良好;山柰素在 0.056 8 ~1.136 μg进样量与峰面积线性关系良好。
2.1.7 专属性试验 分别精密吸取 10 μL的供试品溶液、对照品溶液及阴性对照溶液,按“2.1.1” 项的色谱条件进行色谱分析,结果供试品溶液色谱中,在与槲皮素和山柰素对照品相同保留时间处有吸收峰,而阴性对照溶液在相同保留时间处未显吸收峰, 见图1。
2.1.8 稳定性考察 取同一供试品溶液 (批号130412), 在放置0、 1、 2、 4、 6、 8 h 后精密吸取10 μL进样, 测定其峰面积值, 槲皮素 RSD为0.59%, 山柰素 RSD为 0.76%。结果表明, 供试品溶液8 h内基本稳定。
2.1.9 精密度试验 取对照品混合溶液重复进样6 次, 按 “2.1.1” 项的色谱条件测定槲皮素和山柰素的峰面积,结果表明,仪器精密度良好,槲皮素 RSD为 0.94%,山柰素 RSD为 0.81%。
2.1.10 重复性试验 取同一个批号样品 (批号130412), 按上述方法制备 6 份供试品溶液, 分别测定,结果槲皮素和山柰素 RSD分别为 0.53%、0.72%。 结果表明本方法具有良好的重复性。
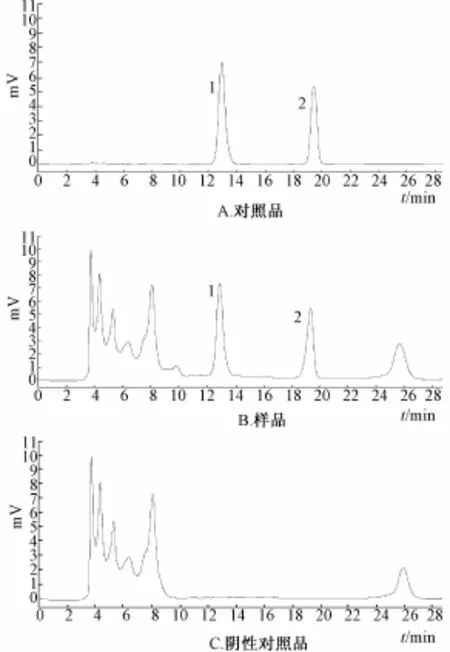
图1 槲皮素和山柰素的 HPLC图Fig.1 HPLC chromatgrams of quercetin and kaempferol
2.1.11 加样回收率试验 取已知含有量 (槲皮素0.69 mg/g、 山柰素0.57 mg/g) 的的同一批样品(批号 130412) 适量, 研细, 取约 2.5 g, 精密称定, 分别精密加入对照品混合溶液 25 mL、甲醇-25%盐酸溶液 (4 ∶1) 混合溶液 25 mL, 按照“2.1.4” 项制备加样供试液。 精密吸取加样供试液 10 μL, 按上述测定方法测定其峰面积, 计算回收率, 结果表明本方法回收率良好, 见表1。
2.2 柴胡皂苷 a和柴胡皂苷 d 的测定[13-23]
2.2.1 色谱条件及系统适应性 Hypersil C18色谱柱 ( 4.6 mm ×150 mm, 5 μm); 甲 醇-乙 腈-水(25 ∶45 ∶30) 为流动相, 柱温为室温; 体积流量0.8 mL/min; 进 样量 10μL。 ELSD检 测器检测参数: 漂移管温度 95 ℃, 载气 (N2) 体积流量 2.4 SLPM/min。 理论塔板数以柴胡皂苷 a计算应不低于 4 000。
2.2.2 对照品混合溶液的制备 精密称取柴胡皂苷a对照品和柴胡皂苷d对照品各适量, 加甲醇制成对 照 品 混 合 溶 液 ( 柴 胡 皂 苷 a为 0.041 6 mg/mL, 柴胡皂苷 d 为 0.026 7 mg/m L)。
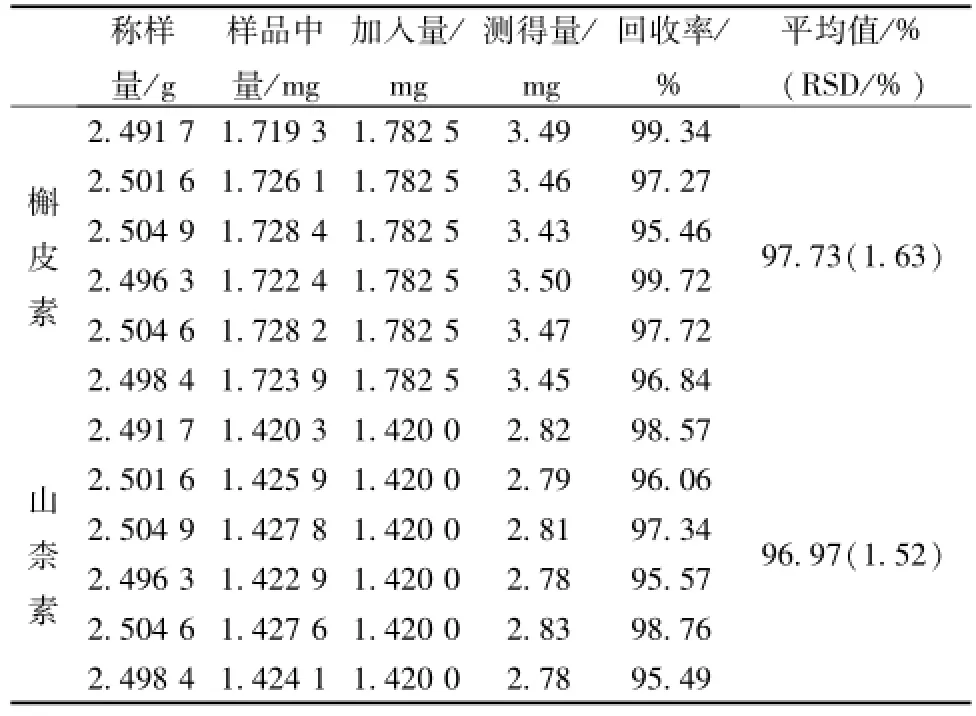
表1 槲皮素和山柰素回收率试验结果Tab.1 Results of recovery tests for quercetin and kaempferol
2.2.3 供试品溶液的配制 取本品适量, 研细,取约5.0 g, 精密称定, 置具塞锥形瓶中, 加甲醇50 mL, 超声处理 (250 W, 30 kHz) 20 min, 用甲醇补足减失的质量,摇匀,过滤,精密量取续滤液25 mL, 置水浴上蒸干, 残渣加水 15 mL溶解, 溶液加于 AB-8 大孔树脂柱 (120 mm×10 mm) 上,分别以100 mL的氨试液、水、 50%乙醇洗脱, 弃去洗脱液,再用乙醇洗脱,收集洗脱液,浓缩至干, 残渣用甲醇溶解, 移至10 mL量瓶中, 稀释至刻度,摇匀,用微孔滤膜滤过,取续滤液,即得。
2.2.4 阴性对照溶液的配制 按益肝乐颗粒处方比例称取适量除柴胡的其余药味,按益肝乐颗粒的前处理和制剂生产工艺制成缺柴胡的阴性样品,按照上述供试品溶液的配制方法制成缺柴胡的阴性对照溶液。
2.2.5 线性关系考察 精密吸取对照品混合溶液1、 5、 10、 15、 20 μL, 按上述色谱条件进行测定,以峰面积的自然对数值为纵坐标,柴胡皂苷a、 柴胡皂苷d量的自然对数值为横坐标分别绘制标准曲线, 得回归方程。柴胡皂苷 a为 Y=1.364 2X+ 7.614 7,r=0.999 2;柴胡皂苷 d 为 Y=1.069 1X+ 5.095 4, r=0.999 5。 结 果 表 明 柴 胡 皂 苷 a在0.041 6 ~0.832 0 μg进样量的自然对数值与峰面积的自然对数值呈良好的线性关系;柴胡皂苷d在0.026 7 ~0.534 0 μg进样量的自然对数值与峰面积的自然对数值呈良好的线性关系。
2.2.6 阴性对照试验 分别精密吸取10 μL的供试品溶液、对照品溶液及阴性对照溶液,按“2.2.1” 项的色谱条件进行色谱分析,结果供试品溶液色谱中,在与柴胡皂苷a对照品和柴胡皂苷d对照品相同保留时间处有吸收峰,而阴性对照溶液在相同保留时间处未显吸收峰,见图2。
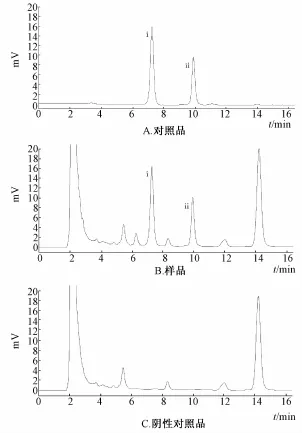
图2 柴胡皂苷 a 和柴胡皂苷 d的 ELSD图Fig.2 ELSD chromatogram s of saikosaponin a and saikosaponin d
2.2.7 精密度试验 取对照品混合溶液重复进样6 次, 按 “2.2.1” 项的色谱条件测定柴胡皂苷 a和柴胡皂苷d的峰面积,测试结果表明仪器精密度良 好, 柴 胡 皂 苷 a 和 d 的 RSD 分 别 为0.61%、 0.85%。
2.2.8 重 复 性 试 验 取 同 一 批 样 品 ( 批 号130412),按上述方法制备 6 份供试品溶液, 分别测定, 柴胡皂苷 a和柴胡皂苷 d 的 RSD分别为0.91%、 0.76%。 结果表明本方法具有良好的重复性。
2.2.9 稳定性考察 取同一供试品溶液 (批号130412),在放置0、 1、 2、 4、6、 8 h 后, 测定其峰面积值,柴胡皂苷 a的 RSD为 0.57%,柴胡皂苷 d 的 RSD为 0.68%, 供试品溶液 8 h 内基本稳定。
2.2.10 加样回收率试验 取已知含有量的同一批样品 (批号 130412, 柴胡皂苷 a为 0.17 mg/g、柴胡皂苷 d 为 0.11 mg/g) 适量, 研细, 取约 2.5 g,精密称定, 置锥形瓶中, 分别精密加入甲醇 40 mL, 加对照品混合溶液 10 mL,按 “2.2.3” 项下供试品溶液配制方法制成加样供试液,按上述测定方法测定其峰面积,计算回收率,结果表明本方法回收率良好,见表2。
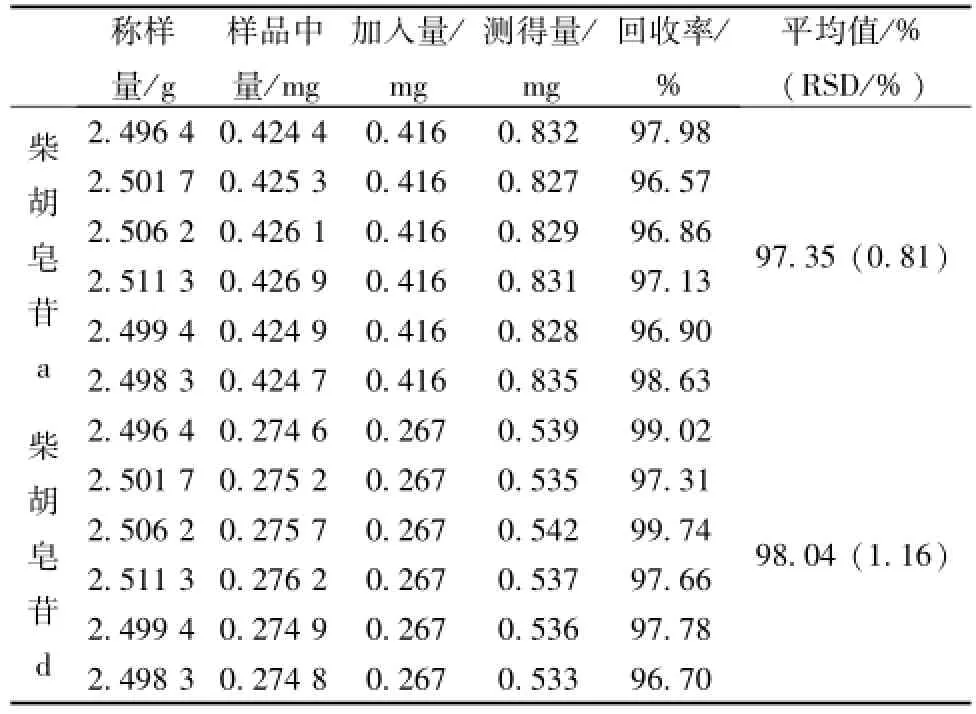
表2 柴胡皂苷 a和 d加样回收率结果Tab.2 Results of recovery tests for saikosaponin a and saikosaponin d
2.3 样品测定 取 3 批样品按 “2.1” 项下槲皮素和山柰素测定方法,分别精密吸取对照品混合溶液和供试品溶液各10 μL, 注入液相色谱仪, 测定槲皮素和山柰素的量, 结果见表3。
取3 批样品按 “2.2” 项下柴胡皂苷 a和柴胡皂苷d测定方法,分别精密吸取对照品混合溶液5 μL、 10 μL和供试品溶液 10 μL, 注入液相色谱仪,测定,用外标两点法对数方程分别测定本品中柴胡皂苷 a和柴胡皂苷d的量, 结果见表3。
表3 样品测定结果 (, n=3)Tab.3 Results of content determ ination(,n=3)
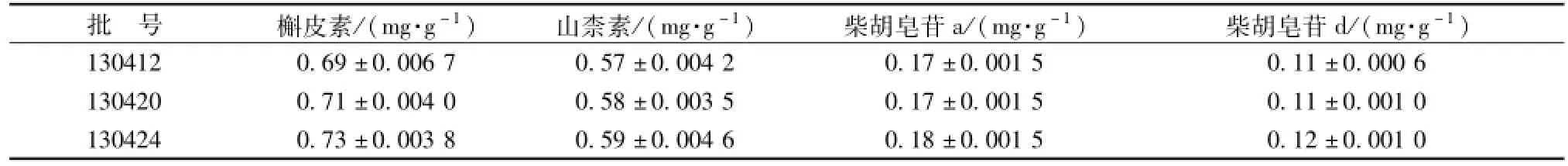
表3 样品测定结果 (, n=3)Tab.3 Results of content determ ination(,n=3)
批 号 槲皮素 /( mg·g-1) 山 柰素 /( mg·g-1) 柴 胡皂 苷 a/( mg·g-1) 柴胡皂 苷 d/( mg·g-1)130412 0.69 ±0.006 7 0.57 ±0.004 2 0.17 ±0.001 5 0.11 ±0.000 6 130420 0.71 ±0.004 0 0.58 ±0.003 5 0.17 ±0.001 5 0.11 ±0.001 0 130424 0.73 ±0.003 8 0.59 ±0.004 6 0.18 ±0.001 5 0.12 ±0.001 0
3 讨论
3.1 垂盆草为方中主要药物之一, 具有利湿退黄,清热解毒之功效,可用于湿热黄疸,小便不利,痈肿疮疡等症状的治疗;《中国药典》 2010 年版仅对垂盆草中的槲皮素、山柰素和异鼠李素的总量进行了控制,未分别对各成分进行定量分析,本实验中曾对益肝乐颗粒所含垂盆草中3种成分分别进行定量测定研究,但因该制剂中异鼠李素含有量偏低,所采用的色谱条件下异鼠李素与其他成分分离效果不佳,故本实验仅对垂盆草中槲皮素和山柰素进行了定量控制,未将异鼠李素作为该制剂定量控制指标。
3.2 ELSD是一种通用型检测器, 流动相由热气流使之热气化喷雾,再进入加热管,溶剂在此挥发。所得分析检测的物质颗粒通过一狭窄光束散射光, 由光电倍增管收集。 ELSD的响应取决于被分析物质颗粒的数量和大小。 由于 ELSD仅对不挥发被分析物质产生响应.即使是在梯度洗脱时也能提供平衡的基线。 ELSD已成功用于皂苷、 生物碱、萜类内酯、氨基酸和糖类等分析,是分析无紫外吸收及紫外吸收弱成分的有力工具。柴胡为方中主要药物之一,具有疏散退热,疏肝解郁,升举阳气之功效,可用于感冒发热,寒热往来,胸胁胀痛,月经不调,子宫脱垂,脱肛等症状的治疗;同时柴胡皂苷a和柴胡皂苷d为柴胡的主要成分。 本实验采用 HPLC-ELSD法对柴胡中柴胡皂苷 a、 柴胡皂苷 d进行测定方法研究,为完善该制剂质量标准提供重要依据。
[ 1 ] 国家药典委员会.中华人民共和国药典: 2010 年版一部[S].北京: 中国医药科技出版社, 2010: 198-199, 263-264, 附录 30, 附录36.
[2] 国家药典委员会.国家药品标准:中药成方制剂第四册[S].北京: 人民卫生出版社, 1998: 165.
[ 3 ] 梁 洁, 柳贤福, 孙正伊, 等.HPLC测定白花蛇舌草配方颗粒中槲皮素和山奈素含量[J].中国实验方剂学杂志,2012, 18(24): 149-151.
[ 4 ] 毛敏珏, 严国俊, 侯振山, 等.HPLC同时测定肝尔舒微丸中 3 种有效成分的含量[J].中国实验方剂学杂志,2012, 18(24): 107-109.
[ 5 ] 王增仙.高效液相色谱-质谱法测定血浆中槲皮素及其主要代谢产物[J].中成药, 2012, 34(3): 750-753.
[ 6 ] 黄俊忠, 曾小平.HPLC法同时测定田七痛经胶囊中异鼠李素、 槲皮素、 山柰素 [ J].中 成药, 2012, 34 (10):1912-1915.
[7] 季 波,夏爱军,廖厚知.高效液相色谱法测定复方消渴降糖胶囊中槲皮素含量 [ J].中国药业, 2013, 22 (4 ):44-45.
[ 8 ] 袁 杰, 程志清.HPLC法测定垂盆草颗粒中槲皮素的含量[ J].中国药事, 2009, 23(5) : 467-468, 471.
[ 9 ] 李锋涛, 潘金火.复方垂盆草胶囊的质量标准研究[J].中成药, 2006, 28(2): 197-200.
[10] 覃兰芳, 胡琦敏, 赖茂祥, 等.HPLC同时测定小蜡树叶中槲皮素与山奈素的含量[J].中国实验方剂学杂志,2013, 19(3): 107-109.
[11] 张思巨, 王跃生, 刘 丽, 等.高效液相色谱法测定垂盆草药材中小麦黄素苷的含量[J].中国实验方剂学杂志,2007, 13(4): 4-5.
[12] 郦宏岩, 朱惠芬, 耿秋霞, 等.HPLC法测定青钱柳中槲皮素和山柰素的含量[J].药学与临床研究, 2009: 17(04): 300-302.
[13] 栾韦伯.HPLC法测定柴胡片中柴胡皂苷 a的含量[J].黑龙江医药, 2012, 25(2): 190-192.
[14] 蔡 林, 吴 雪, 石姗平.HPLC法同时测定柴葛清热颗粒中柴胡 皂 苷 a、 d 和 葛 根 素 的 含 量 [ J].中 国 药 房,2012, 23(31): 2949-2950.
[15] 吴月国, 张 萍, 赵铮蓉, 等.HPLC法测定青川柴胡中柴胡皂苷 a、 d 的含量[ J].中华中医药学刊, 2012, 30(9): 2040-2041.
[16] 何晓梅.HPLC-ELSD法测定大柴胡颗粒中柴胡皂苷 a及柴胡皂 苷 d 的 含 量 [ J]. 健 康 必 读: 下 旬 刊, 2012(12): 433.
[17] 董传健.UPLC-PDA-TOFMS 法测定柴胡中柴胡皂苷 a定性定量分析[J].医药前沿, 2013, 1: 32-33.
[18] 白宗利, 王 岩, 贾天柱.柴胡不同醋制品皂苷类成分比较研究[J].中成药, 2008, 30(7): 1021-1023.
[19] 白宗利.醋柴胡炮制原理及工艺研究 [D].沈阳: 辽宁中医药大学, 2008.
[20] 马登斌.柴胡传统饮片及中药配方颗粒柴胡的质量分析研究 [C] //中华中医药学会: 2010 全国知名中医院院长暨道家文化与中医药养生论坛论文集, 2010.
[21] 杨瑶珺, 阎玉凝, 杨 洋, 等.阿尔泰柴胡中柴胡皂苷 a、c、 d 的含量测定[J].北京中医药大学学报, 2008, 31(11): 777-780.
[22] 唐进法, 王 星, 曹占霞.近红外光谱法测定柴胡药材中柴胡皂苷 A含量[ J].中国 实验 方剂学 杂志, 2012, 18(17): 138-141.
[23] 易为丹, 方应权.HPLC测定三峡库区紫花大叶柴胡中柴胡皂苷 a含量[ J].中国实验方剂学杂志, 2013, 19(2):71-73.
Determ ination of quercetin, kaemp ferol, saikosaponin a and saikosaponin d in Yiganle Granules by HPLC-UV-ELSD
TAN Xiong-si
(Zhaoqing Medical College, Zhaoqing 526020, China)
AIM To develop an HPLC-UV-ELSD method for determining the content of quercetin, kaempferol, saikosaponin a and saikosaponin d in Yiganle Granules(Sedi Herba, Bupleuri Radix,Isatidis Radix, etc.) . METHODS An Hypersil C18column was used as the chromatographic column,the flow rate was 0.8 mL/min. Themobile phase for quercetin and kaempferol consisted ofmethanol-water-trifluoroacetic acid (40 ∶60 ∶0.05 ) . The UV detection wavelength was set at360 nm.Themobile phase for saikosaponin a and saikosaponin d consisted ofmethanol-acetonitrile-water( 25 ∶45 ∶30 ),the temperature of drift tube was set at 95 ℃, and the gas flow( N2) at2.4 SLPM/min.RESULTS Therewas a good linear relationship between the concentration ofquercetin,kaempferol and peak area value at the concentrations of0.071 3-1.426 μg(r=0.999 7) , and 0.056 8-1.136 μg( r=0.999 3) .The average recovery were 97.73% ( RSD=1.63%) and 96.97% (RSD=1.52%), respectively.There was a good linear relationship in the concentrations of saikosaponin a and saikosaponin d at the concentration of0.041 6-0.832 0 μg(r=0.999 2), 0.026 7-0.534 0 μg(r=0.999 5).The average recoveries were 97.35% (RSD=0.81%) and 98.04% ( RSD=1.16%) , respectively.CONCLUSION The method is accurate, sensitive, reproducible and can be used in the determination of quercetin, kaempferol, saikosaponin a and saikosaponin d in Yiganle Granules.
Yiganle Granules;quercetin; kaempferol; saikosaponin a; saikosaponin d
R927.2
: A
: 1001-1528(2014)03-0531-05
10.3969/j.issn.1001-1528.2014.03.018
2013-06-08
谭雄斯 (1979—) , 男, 硕士, 药师, 主要从事药学教育和研究。 Tel: 13450185366, E-mail: tanxiongsi2013@163.com

