D-101 型大孔吸附树脂纯化黄蜀葵花总黄酮的工艺研究
于鹤云, 刘汉清*, 刘 嘉, 唐海涛, 张 平, 张 坚
(1.南京中医药大学, 江苏 南京 210046; 2.江苏建康职业学院, 江苏 南京 210029; 3.江苏苏中药业集团股份有限公司, 江苏 姜堰 225500)
D-101 型大孔吸附树脂纯化黄蜀葵花总黄酮的工艺研究
于鹤云1, 刘汉清1*, 刘 嘉2*, 唐海涛3, 张 平3, 张 坚1
(1.南京中医药大学, 江苏 南京 210046; 2.江苏建康职业学院, 江苏 南京 210029; 3.江苏苏中药业集团股份有限公司, 江苏 姜堰 225500)
目的 优选 D-101 型大孔吸附树脂纯化黄蜀葵花总黄酮的工艺参数。 方法 以总黄酮、 金丝桃苷、 异槲皮苷、杨梅素、芦丁和槲皮素的回收率、总黄酮纯度为指标,采用Z分综合评分法,通过正交试验优选黄蜀葵花总黄酮的纯化工艺。 结果 确定最优条件为药液总黄酮质量浓度 4.23 mg/mL, pH 4.17, 上样体积流量 2 BV/h (BV为柱体积),5 BV水和 3 BV5%乙醇除杂, 7 BV 70%乙醇洗脱, 洗脱体积流量 2 BV/h。 结论 该工艺条件对黄蜀葵花总黄酮的纯化效果较好。
大孔吸附树脂;黄蜀葵花;总黄酮;纯化工艺
黄蜀葵 Abelmoschusmanihot(L.) Medic是锦葵科秋葵属植物[1], 其花中主要含有黄酮类、鞣质类、 有机酸类和 长烃类等化合物[2], 黄酮类物质是目前所知的主要有效成分,黄葵胶囊即是从黄蜀葵花中提取有效成分制成的胶囊剂,临床主要用于治疗各类慢性肾脏病[3]。 工艺生产过程中发现黄葵干浸膏中间体易吸湿,并且胶囊服用剂量较大(一天3 次, 一次 5 粒), 为此本实验研究大孔吸附树脂纯化富集总黄酮部位,去除部分易吸湿的杂质,减小胶囊服用量。
1 仪器和材料
Ultimate 3000 高效 液相色谱仪 ( 美国 Dionex公司); Lambda 25 紫外可见分光光度计 (美国PerkinElmer公司) ;HH-4 型数显恒温水浴锅 ( 金坛富华仪器有限公司); RE-2000E型旋转蒸发器( 郑州亚荣仪器有限公司) ; Molelement 1710V超纯水机 ( 上海摩勒生物科技有限公司); GT10-1高速台式离心机 (北京时代北利离心机有限公司)。
金丝 桃 苷 ( 111521-201004, 纯 度 以 93.9%计)、 芦丁 (100080-200707,纯度以 90.5% 计)、槲皮素 (100081-200907, 纯度以 96.5%计) 均购于中国食品药品检定研究院;杨梅素 (上海同田生物技术 有 限 公司, 批 号 为 11012622, 纯度 ≥98%)、异槲皮苷 (四川维克奇生物科技有限公司, 批号为 201010, 纯度≥98%)。 D-101 型大孔吸附树脂 (天津市海光化工有限公司)。乙腈, 色谱纯;其余试剂均为分析纯。黄蜀葵花 (产地为兴化)经南京中医药大学谈献和教授鉴定为锦葵科的黄蜀葵。
2 方法和结果
2.1 紫外分光光度法测定总黄酮的标准曲线绘制精密称取减压干燥 12 h以上的 金 丝 桃苷对照品适量, 用无水乙醇定容配制成质量浓度为0.128 4 mg/mL的对照品溶液, 精密移取对照品溶液 1、 2、3、 4、 5、 6 mL于 25 mL量 瓶 中, 加 蒸 馏 水 至 6 mL, 分 别 准 确 加 入 5 mL醋 酸 盐 缓 冲 液 (2 mol/L醋酸液∶2 mol/L醋酸钠溶 液 =3 ∶1) 和 0.1 mol/L的三氯 化 铝 溶 液 3 m L, 用 蒸 馏 水 定 容 到 刻 度, 混匀, 放置 30 min, 另取 6 mL蒸 馏 水 同 法 制 备 空 白对照溶液, 在 402 nm波长处测定吸光度, 以 吸光度值为纵坐标,质量浓度为横坐标,绘制标准曲线[4], 得线 性 方 程 为 A=0.029 9C+0.015 3, r= 0.999 9, 金 丝 桃苷在 5.136 ~30.816 μg/mL范 围内与吸光度呈良好的线性关系。
2.2 HPLC法同时测定 5 种成分的标准曲线绘制
2.2.1 色 谱 条件 Thermo scientific Hypersil GOLD色谱柱 (250 mm×4.6 mm, 5 μm) , 检 测 波 长 为360 nm,柱温 30 ℃, 体 积 流 量 为 0.8 mL/min,流动相为乙腈 -0.2%磷酸水, 按表 1 进行梯度洗脱,此条件下对照品与样品均达到较好的分离效果[5],见图1。
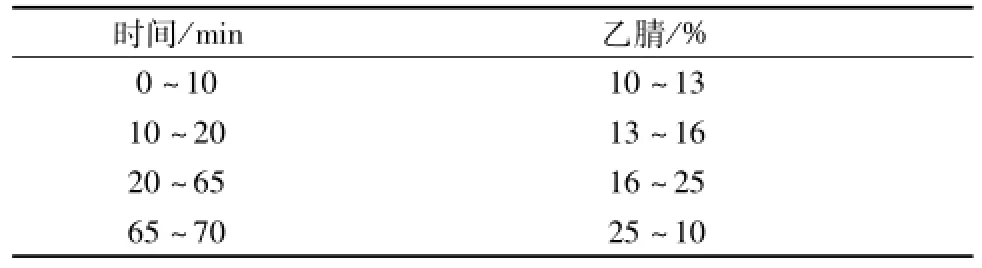
表1 梯度洗脱程序Tab.1 Gradient elution p rogram
2.2.2 标准曲线绘制 精密称取减压干燥 12 h 以上的金丝桃苷、异槲皮苷、杨梅素、芦丁和槲皮素对照品适量,用甲醇定容配制成质量浓度分别为1.615、 1.227、 0.543、 0.091、 0.178 mg/mL的对照品溶液, 精密移取上述对照品溶液各1 mL于10 m L量瓶中, 用甲醇定容即得金丝桃苷 0.161 5 mg/mL、 异槲皮苷0.122 7 mg/mL、 杨梅素0.054 3 mg/mL、芦 丁 0.009 1 mg/mL、槲 皮 素 0.017 8 mg/mL的混合对照溶液。 取混合对照溶液分别稀释成初始质量浓度的 1、 1/2、 1/4、 1/8、 1/16、 1/32的系列混合对照溶液, 分别进样 10 μL, 以峰面积为纵坐标,质量浓度为横坐标,绘制标准曲线,得线性方程为: 金丝桃苷 Y1=0.325 15X1+0.117 66,r1=0.999 99; 异槲皮苷 Y2=0.297 47X2+0.070 86,r2=0.999 99; 杨梅素 Y3=0.523 25X3-0.098 16, r3=0.999 97;芦丁 Y4=0.238 01X4-0.003 64,r4=0.999 98; 槲皮素 Y5=0.680 8X5-0.108 3,r5=0.999 9。 金丝桃苷在 5.048 ~161.528 μg/mL范围内、 异槲皮苷在 3.833 ~122.655 μg/mL范围内、 杨梅素在1.697 ~54.292 μg/mL范围内、 芦丁在 0.283 ~9.050 μg/mL范围内、 槲皮素在0.556 ~17.795 μg/m L范围内与峰面积均呈良好的线性关系。

图1 混合对照品 (A) 与样品 (B) 的 HPLC图谱Fig.1 HPLC chromatogram s ofm ixed reference substances(A) and sample(B)
2.3 样品溶液的配制方法 称取黄蜀葵花适量,加入20 倍量 70%乙醇提取 3 次, 每次 1 h, 合并提取液后浓缩至无醇味,加适量蒸馏水稀释,离心去除水不溶性杂质, 制得含总黄酮为 12.10 mg/mL的样品溶液。
2.4 大孔吸附树脂的预处理 取 D-101 大孔吸附树脂适量, 用 95%乙醇浸泡 24 h 后, 湿法装柱,用 95%乙醇冲洗至流出液加水无浑浊现象, 再用蒸馏水冲洗至无醇味,备用。
2.5 Z分综合评价法 本实验选取总黄酮、 金丝桃苷、异槲皮苷、杨梅素、芦丁、槲皮素回收率以及总黄酮纯度为指标,采用Z分综合评价法将多指标进行归一化处理[6], 计算公式如下:
Zi=/Si其中:Xi为指标值为指标值的平均值,Si为指标值的标准差[7]。

2.6 分离纯化实验的单因素考察
2.6.1 上样质量浓度的考察 量取 350 mL总黄酮质量浓度为 12.10 mg/mL样品溶液 5 份,分别稀释成 1.13、4.23、 6.72、 8.63、12.10mg/mL的样品溶液。 量取 100 m L经过预处理的 D-101 型树脂,湿法装柱,将上述5份样液分别湿法上样,上样体积流量为4 BV/h, 用 5 BV蒸馏水冲洗, 再用 5 BV 70%乙醇以 4 BV/h 的体积流量进行解吸附, 收集乙醇洗脱液, 按 “2.1”、 “2.2” 项下方法分别测定总黄酮和5种成分的回收率,另取乙醇洗脱液50 mL于蒸发皿中, 105 ℃干燥至恒定质量, 利用差量法测定含固量,计算总黄酮纯度,实验重复3次取其平均值, 结果见表2。
黄酮回收率%=洗脱液中黄酮量/样品溶液中黄酮量 ×100%
总黄酮纯度%=洗脱液中黄酮量/洗脱液的总含固量 ×100%
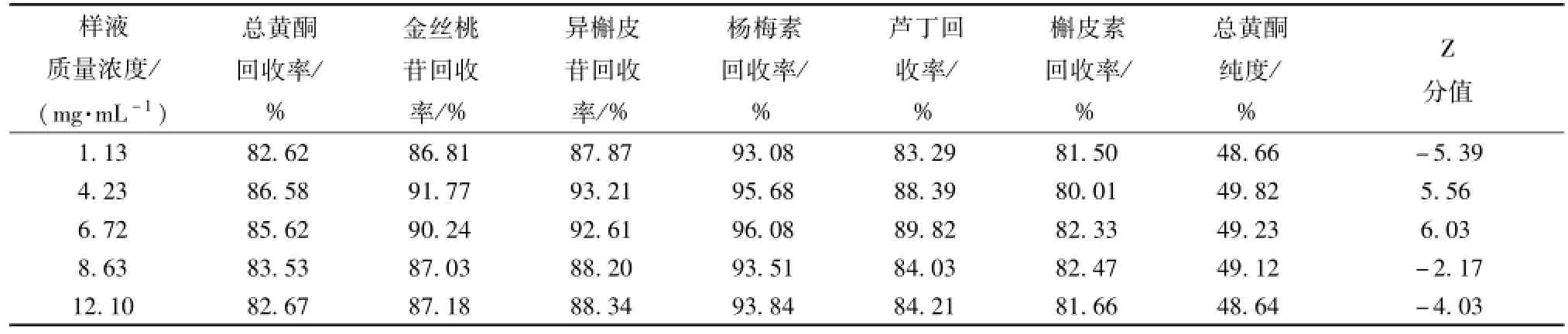
表2 不同上样质量浓度的考察结果Tab.2 Resu lts of different concentrations of sam p le solution
由表 2 可知, 药液的总黄酮质量浓度在4.23 ~6.72 mg/mL范围内纯化效果较好。
2.6.2 上样药液 pH的考察 量取 5 份总黄酮质量浓度为 4.23 mg/mL样品溶液各 1L, 分别调 pH值为 2.18、 4.17、 6.01、 8.00、 9.98, 同法上样、洗脱、 检测,其结果见表3。

表3 不同药液 pH的考察结果Tab.3 Results of different pH values of sample solution
由表 3 可知, 药液 pH在2.18 ~4.17 范围内纯化效果较好。
2.6.3 上样体积流量的考察 量取 4 份总黄酮质量浓度为 4.23 mg/mL样品溶液各 1 L分别以 2 BV/h、 4 BV/h、 6 BV/h、 8 BV/h 的体积流量上样, 同法洗脱、 检测, 其结果见表4。
由表 4 可知, 上样体积流量为 2 BV/h、 4 BV/h时纯化效果较好。

表4 不同上样体积流量的考察结果Tab.4 Resu lts of different flow rates of sam p le solution
2.6.4 不同体积分数乙醇洗脱的考察 量取 5 份总黄酮质量浓度为 4.23 mg/mL样品溶液各 1 L依法上样、 水洗, 再分别用 5 BV 的 30%、 50%、70%、80%、95%乙醇进行解吸附,收集洗脱液依法检测, 其结果见表5。
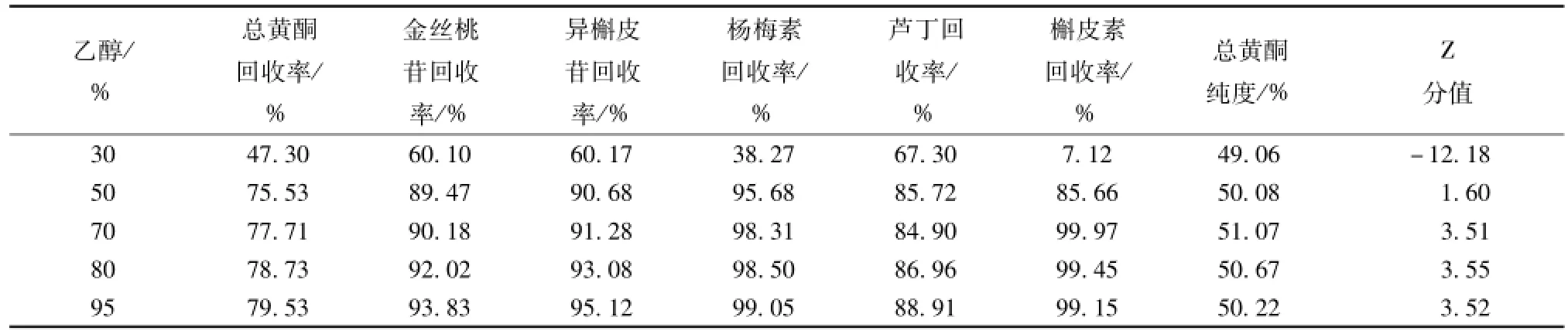
表5 不同体积分数乙醇的考察结果Tab.5 Results of different con tents of ethanol
由表 5 可知, 乙醇洗脱体积分数在 70% ~95%范围内纯化效果较好。
2.6.5 乙醇洗脱体积的考察 量取 4 份总黄酮质量浓度为4.23mg/mL样品溶液各1L依法上样、水洗,分别用 1BV、 3BV、 5BV、 7BV的 70%乙醇进行解吸附, 收集洗脱液依法检测, 其结果见表6。
由表6可知, 当乙醇用量达到 5 BV以后,各指标值均较高。
2.6.6 乙醇洗脱体积流量的考察 量取 4 份总黄酮质量浓度为 4.23 mg/mL样品溶液各 1 L同法上样、 水洗,再用 5 BV 70%乙醇分别以 2、 4、 6、 8 BV/h 的体积流量进行解吸附, 收集洗脱液依法检测, 其结果见表7。 由表7可知, 乙醇洗脱体积流量为 2、 4 BV/h 时纯化效果较好。
2.6.7 除杂洗脱条件的考察 量取 4 份总黄酮质量浓度为 4.23 mg/mL样品溶液各 1 L同法上样,分别用 5 BV蒸馏水、 8 BV蒸馏水、 5 BV蒸馏水 +3 BV5%乙醇、 5 BV蒸馏水 +5 BV10%乙醇进行冲洗后, 再用 70%乙醇解吸附, 收集洗脱液依法检测, 其结果见表8。
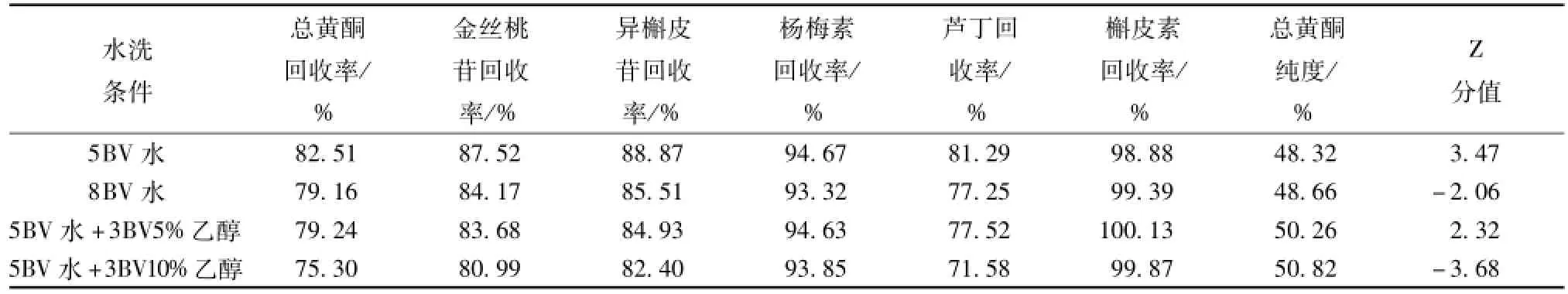
表8 不同除杂洗脱条件的考察结果Tab.8 Results of different parameters of washing p rogram
由表 8 可知, 用 5BV水和 5BV水 +3BV5%乙醇冲洗杂质,纯化效果较好。
2.7 正交试验 以单因素实验结果确定的各因素较优范围, 按 L8(27) 正交表进行实验, 因素水平见表 9, 实验结果见表 10, 其直观分析见表 11,方差分析见表 12。

表9 因素水平Tab.9 Factors and levels
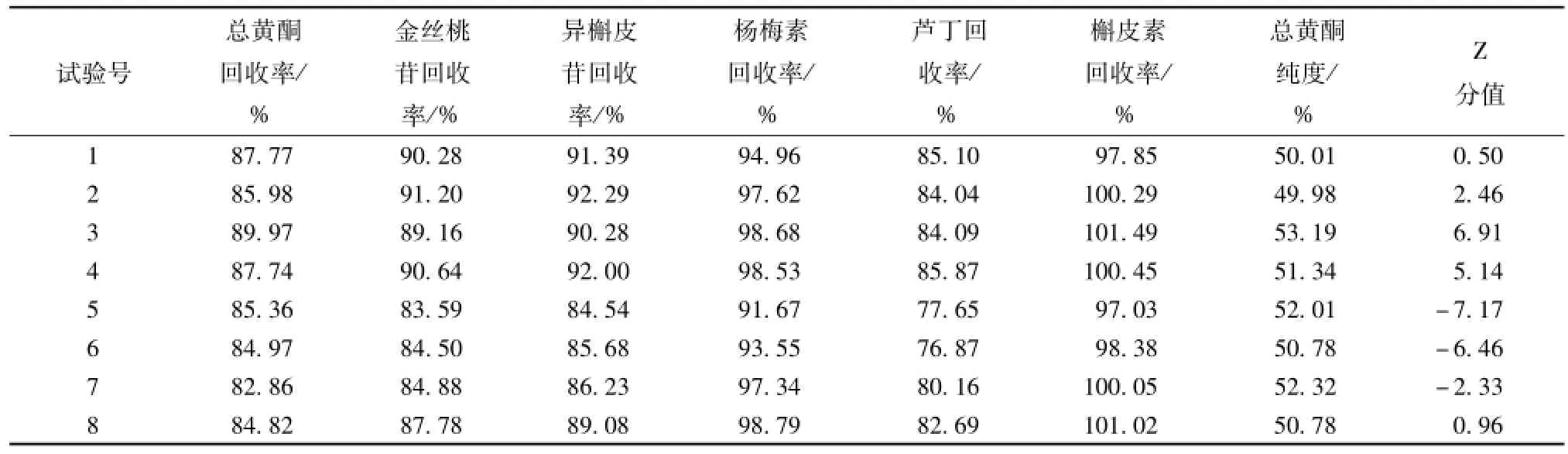
表 10 正交试验结果Tab.10 Results of orthogonal experiment

表 11 正交试验结果的直观分析Tab.11 Intuitive analysis table
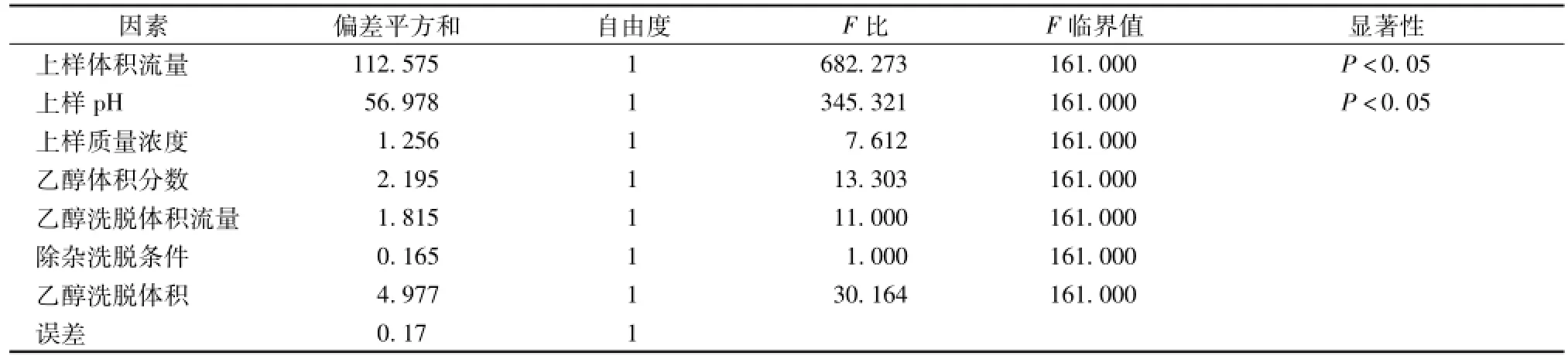
表 12 正交试验结果的方差分析Tab.12 Analysis of variance table
由表 11、 12 可知,上样流量和上样 pH具有显著性差异 (P<0.05), 因素影响大小为: A> B>G > D > E > C > F, 最 佳 工 艺 为A1B2C1D2E1F2G2, 即上样体积流量为 2 BV/h, 上样 pH为 4.17, 上样质量浓度为 4.23 mg/m L, 乙醇体积分数 70%, 乙醇洗脱体积流量为 2 BV/h,除杂洗脱条件为 5 BV+3 BV5%乙醇,乙醇洗脱体积为7 BV。
2.8 验证试验 量取 3 份已经过预处理的 D-101树脂300 mL, 湿法装柱, 取 3 份总黄酮质量浓度为 4.23 mg/mL的样品溶液 3 L均调节 pH至 4.17,湿法上样, 上样流量为 2 BV/h, 用 5 BV水和 3 BV5%乙醇除去杂质,再用 5 BV的 70%乙醇进行洗脱,收集洗脱液,与正交试验同法检测,结果见表 13。
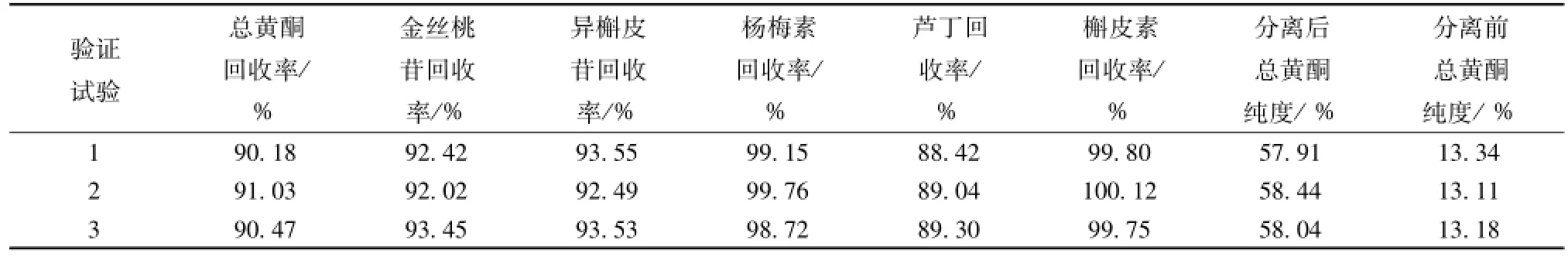
表 13 验证试验结果Tab.13 Results of verification tests
由结果可知,按优选出的方案纯化黄蜀葵花总黄酮能达到很好的效果。
3 讨论
3.1 本 实 验 考 察 了 AB-8、 D-101、 HPD-100、NKA-9 四种不同型号的树脂对黄蜀葵花总黄酮的纯化效果,以静态吸附率、静态解吸率、动态吸附率和动态解吸率为指标优选出 D-101 型树脂, 其纯化效果较好。3.2 黄葵胶囊中活性成分为总黄酮, 药典中以金丝桃苷的量为指标,本实验以总黄酮、异槲皮苷、杨梅素、芦丁和槲皮素的回收率为综合指标,能更全面客观的说明 D-101 型大孔吸附树脂纯化黄蜀葵花总黄酮方法的可行性和科学性。3.3 根据实验结果发现杨梅素和槲皮素的回收率很高, 甚至大于 100%, 一方面原因是 D-101 对杨梅素和槲皮素的吸附和解吸附效果很好,另一方面可能的原因是部分金丝桃苷、槲皮苷等类似母核的黄酮类成分在酸性条件下水解成槲皮素等[8], 具体原因有待进一步研究。
[ 1 ] 居文政.黄蜀葵的本草考证[J].时珍国药研究, 1994, 5(2): 6-7.
[2] 刘 爽,江蔚新,吴 斌.黄蜀葵化学成分及药理活性研究进展[ J] .中国现代中药, 2010, 12(8) : 5-9.
[3] 赵 青,万毅刚,孙 伟,等.黄葵胶囊对阿霉素肾病肾组织炎症信号通路 p38MAPK的干预作用[J].中国中药杂志, 2012, 37(19): 2926-2934.
[4] 周正华,杜安全,王先荣.黄蜀葵花中总黄酮含量测定方法的比较研究[ J] .中药材, 2006, 29(11) : 1192-1194.
[5] 刘 霖,唐海涛,刘汉清,等.黄葵胶囊中5种黄酮类成分的含量测定及其特征图谱研究[J].中药材, 2013, 36(1): 132-136.
[6] 靳 浩,吴 诚,梅兴国.多指标综合评价优选阿霉素微球的制备工艺及体内的初步考察[J].中国药学杂志,2006, 41(22): 1723-1725.
[7] 赵应征,鲁翠涛,梅兴国.常用多指标综合评价法在优选实验中的应用[ J].医学研究生学报, 2004, 17 (7):624-626.
[ 8 ] 王艳芳, 王新华, 朱宇同.槲皮素药理作用研究进展[J].天然产物研究与开发, 2003, 15(2): 171-173.
Purification of total flavonoids from Abelmoschusmanihot( L.) M edic by D-101 m icroporous resin
YU He-yun1, LIU Han-qing1*, LIU Jia2*, TANG Hai-tao3, ZHANG Ping3, ZHANG Jian1
(1.Nanjing University of Traditional ChineseMedicine, Nanjing 210046, China; 2.Jiangsu Jiankang Vocational College, Nanjing 210029, China;3.Jiangsu Suzhong Pharmaceutical Group Co., Ltd, Taizhou 225500, China)
microporous resin; abelmoschusmanihot( L.) Medic; total flavonoids; purification process
R284.2
: A
: 1001-1528(2014)03-0520-06
10.3969/j.issn.1001-1528.2014.03.016
2013-05-16
江苏省科技成果转化专项资金项目 (BA2012131)
于鹤云 (1989—) , 女, 硕士生, 研究方向: 中药药剂学。 Tel: 18362315623, E-mail: 517193174@qq.com
*通信作者: 刘汉清 (1947—) , 男, 教授, 研究方向: 药物新剂型与新工艺。 Tel:(025)85811517, E-mail: nzyhqliu@126.com刘 嘉 (1983—), 男, 讲师, 研究方向: 药物剂型与信息。 Tel: 13770704461

