葛根素联用氯沙坦对肾性高血压大鼠心肌 MMP-1/TIMP-1 比值的影响
黄帧桧, 陈 莉, 柏 松, 汪江涛, 丁伯平
(皖南医学院药理学教研室及中药药理国家三级实验室,安徽 芜湖 241002)
葛根素联用氯沙坦对肾性高血压大鼠心肌 MMP-1/TIMP-1 比值的影响
黄帧桧, 陈 莉, 柏 松, 汪江涛, 丁伯平
(皖南医学院药理学教研室及中药药理国家三级实验室,安徽 芜湖 241002)
目的 观察葛根素联用氯沙坦对肾性高血压大鼠心肌 MMP-1/TIMP-1 mRNA及蛋白表达比值的影响。 方法 SD大鼠65只, 雄性, 随机抽取8只为假手术组, 其余采用两肾一夹法造成肾性高血压大鼠模型。 造模成功的大鼠随机分成葛根素高、 中、 低剂量组, 氯沙坦组, 联用组以及模型组 (n=8)。 连续给药 8 周后计算左心室质量指数(LVWI), Masson 染色观察胶原纤维改变, 并计算心肌胶原容积分数; 测心肌羟脯氨酸 (HYP)、 血管紧张素Ⅱ (AngⅡ) 水平, RT-PCR及 Western blot测心肌基质金属蛋白酶-1 ( MMP-1) 及基质金属蛋白酶抑制剂-1 ( TIMP-1) mRNA及蛋白表达。 结果 与模型组相比, 各用药组心肌胶原容积分数、 HYP水平降低 (P<0.01 或 P<0.05), 联用组效果最好 (P<0.05); 葛根素高、 中剂量组和联用组心肌 AngⅡ水平显著降低 (P<0.01 或 P<0.05), 联用组效果最好 ( P<0.05); 除葛根素低剂量组外其他用药 LVW I显著降低 ( P<0.01 或 P<0.05) , MMP-1 与 TIMP-1 mRNA及蛋白表达的比值显著降低 (P<0.05), 联用组效果最好 (P<0.05)。 结论 葛根素联用氯沙坦能显著下调心肌局部MMP-1/TIMP-1mRNA及蛋白比值, 改善肾性高血压大鼠心肌纤维化。
肾性高血压大鼠; 葛根素联用氯沙坦; 心肌纤维化; MMP-1/TIMP-1 mRNA及蛋白表达比值
高血压患者中有三分之一会并发高血压性左室重构,其被认为是加重冠心病、充血性心力衰竭等心血管疾病的独立危险因素。治疗高血压不应仅局限于降压,更重要的是防止和减少心脏并发症。传统的西药降压药,降压虽较快捷,但可出现诸多方面的不良反应, 如血管紧张素Ⅱ (AngⅡ) 受体 1型 (AT1R) 抑制剂可通过抑制 AngⅡ与其 AT1R结合降低血压,逆转高血压靶器官重构,但长期应用会出现 AngⅡ升高, 引起不良反应。
葛根素 ( puerarin) 是从中药葛根中分离出的一种异黄酮类化合物,具有降低血压、减慢心率,扩张冠状动脉、改善心肌缺血再灌注引起的心功能损害[1]等作用。 研究发现葛根素可改善异丙肾上腺素所致的小鼠心肌纤维化,减少心肌胶原沉积[2]。本课题组前期研究也证实其能够逆转自发性高血压大鼠的左室肥厚[3]。 氯沙坦是第 1 个用于临床的 AT1R抑制剂, 能在受体水平上阻断 AngⅡ的作用, 逆转高血压心肌重构。 黄成晋等[4]的研究发现葛根素联用氯沙坦在治疗高血压的同时,能够逆转左室肥厚,且二者联合应用效果更佳,但具体机制并不清楚。 MMPs是一组能降解细胞外基质的重要酶类。 金属蛋白酶-1 (MMP-1) 的主要底物是Ⅰ型、Ⅲ型胶原。在心脏中,Ⅰ型和Ⅲ型胶原约占总胶原的 90%以上, 是构成心肌间质的主要成分。本研究以两肾一夹高血压大鼠为模型,选择与心肌 胶 原 降 解 密 切 相 关 的 MMP-1 及 其 抑 制 物TIMP-1 为主要研究对象, 旨在探讨葛根素联用氯沙坦对肾性高血压大鼠心肌局部两者 mRNA和蛋白表达的影响。
1 材料和方法
1.1 动物 65 只雄性 SD大鼠,体质量 160 ~180 g, 南京青龙山动物实验中心提供, 许可证号码:SCXK (沪) 2008-0016,SPF级。 分笼饲养, 每笼1 只, 保持温度 22 ~24 ℃, 相对湿度60% ~65%,自由进食饮水。
1.2 药品与试剂 戊巴比妥钠, 国药集团化学试剂有限公司,批号为 WS20051129; 葛根素注射液,山东方明药业股份有限公司,批号为 H20033292;氯沙坦,商品名缓宁,扬子江药业股份有限公司,批号为 11050502; MASSON染色试剂盒, 南京建成生物工程研究所, 批号为 20120327; AngⅡ放免试剂盒,北京北方生物科技研究所,批号为120220; 羟脯氨酸 (HYP) 试剂盒, 南京建成生物工程研究所, 批号为 20120224。 以下试剂均为天根 生 化 科 技 (北京) 有 限 公 司 产 品:TRNzol-A+, 批号为#J9117; Oligo(dt), 批号为 L0301;PCR master mix, 批 号 为 L0228; RNase-free ddH2O, 批号为 L0517; Super pure dNTP, 批号为L0314;Script RT kit, 批号为 L0228; TIAN Script M-MLV, 批号为 ER104-03。 以下试剂均为武汉博士德生物工程有限公司产品:哺乳动物总蛋白提取试剂, 批号为 07E07A01; 蛋白酶抑制剂, 批号为07E07A23; Commassie改良增强蛋白定量试剂盒,批号 为 07B27C45; SDS-PAGE蛋 白 上 样 缓 冲 液2 ×, 批号为 07B27C31; 硝酸纤维素薄膜, 批号为07B09A35-04; Marker, 批 号 为 07D18814; WB专用 DAB显色,批号为 06G15B21; 二抗羊抗兔 lgGHRP, 批号为 ST11G12H11H11F;MMP-1 一抗 原液, 批号为 Y-B3-02G30C; TIMP-1 一抗原 液, 批号为97101。
1.3 仪器 ALC-NIBP无创尾动脉血压测定系统(上海奥尔科特生物科技有限公司); 电泳仪 (BGPower 600i, Baygene Biotech Co.LTD.) ; 水平摇床(ZD-9556, 金坛市盛蓝仪器制造有限公司); 高速低温离心机 22R (Beckman Coulter)。
1.4 实验方案
1.4.1 实验动物分组与标本收集 随机选取 8 只为假手术组, 其余 57 只造两肾一夹模型, 以 3%戊巴比妥钠 (30 mg/kg) 麻醉动物, 分离左肾动脉、 放置内径为 0.2 mm的银夹并打结固定。 假手术组操作方法同上,但不放置银夹。术后4周收缩压≥160 mmHg(1 mmHg=0.133 kPa) 者为造模成功[5]。 术后有 48 只入选肾性高血压大鼠组。 将造模成功大鼠随机分为6组,葛根素给药剂量根据本课题组前期研究结果[6], 氯沙坦给药剂量根据临床等效剂量,其中联用组剂量根据预实验结果:葛根素高、中、 低[100、 50、 25 mg/(kg·d), 腹腔注 射, n =8] 剂 量 组, 氯 沙 坦 组 [30 mg/(kg·d), 0.5%羧甲基纤维素灌胃, n=8],联用组[葛根素 25 mg/(kg·d), 腹腔注射 +氯沙坦 15 mg/(kg·d),0.5%羧甲基纤维素, n=8]以及模型组 (给予生理盐水)。 术后第 5 周开始给药,连续给药8周。8周后,所有实验动物在深度麻醉下 (3%戊巴比妥钠, 150 mg/kg), 腹主动脉取血后,迅速取出心脏,用冰生理盐水冲洗,滤纸拭干, 准 确 称 取 全 心 湿 质 量 ( heart wet weight,HWW), 去除血管残根、 心房、 右室游离壁, 保留室间隔及左心室, 称量左心室湿质量 ( left ventricularwetweight, LVWW)。 取部分用 10%中性甲醛固定, 部分制备心肌组织匀浆, 剩余放入 -80℃冰箱中保存备用。
1.4.2 生化指标测定 取心肌组织匀浆, 分别按试剂盒说明书操作方法, 测定心肌 HYP、 AngⅡ水平。
1.4.3 心肌组织胶原纤维观察 将 10%中性甲醛固定后的心肌组织石蜡包埋, 行 MASSON染色,光镜下观察胶原纤维改变。每张切片使用 IPP图像分析软件 (北京中晟天成科技有限公司),测量选定区染色组织的面积 (蓝色代表胶原纤维); 计算方法: 心肌胶原容积分数 (%) =心肌胶原面积/总面积 (其中胶原面积不包括血管周围胶原面积), 每张切片随即抽取 10 个视野 (×400), 计算每个视野中胶原面积占总面积的百分比,取平均值。
1.4.4 半定量逆转录聚合酶链反应 (RT-PCR) 分析 心 肌 MMP-1 及 TIMP-1 mRNA 的 表 达 用TRNzol-A+ 从 心 肌 组 织 中 提 取 总 RNA ( 100 mg/mL), 提取方法严格按照说明书操作。 随后,在逆转录反应体系中加入 RNA 2 μg, 10 ×RTMix 2 μL, dNTP混合液 2 μL, Oligo-dT152 μL,Quant Reverse Transcriptase 1 μL, 最 后 加 入 RNase-free水, 使反应总体积达到 20 μL。 逆转录反应体系在37 ℃下反应 60 min, 在 70 ℃下 15 min 使产物变性。 合成的 cDNA于-20 ℃下保存。 PCR模板 (南京金斯瑞生物科技有限公司) 如下: MMP-1 上游引物 5 ’-CTTCAGTGGTGATGTTCAGC-3 ’, 下 游 引物 5’-CATCGATATGCTTCAACGTTC-3’, 产物长度412 bp; TIMP-1 上游引物 5’-TTCCACAGGTCCCACAAC-3’, 下游引物 5’-GCATTCCTCACAGCCAAC-3’, 产 物 长 度 165 bp; β-actin 上 游 引 物: 5 ’-AGAACATCATCCCTGCATCC-3’, 下 游 引 物 5 ’-ACCCTGTTGCTGTAGCCATA-3’,产 物 长 度 230 bp。 PCR反应体系如下[7]: 1 μL模板 cDNA, 1 μL上游引物, 1 μL下游引物, 2 ×Taq PCR Master Mix 12.5 μL, 加入双蒸水使反应总体积达到 25 μL。每个 PCR反应如下,预变性: 94 ℃预变性 3 min、94 ℃变性 50 s, 54 ℃退火 50 s、 72 ℃延伸 90 s、扩增循环后 72 ℃ 继续 延伸 5 min; 其 中 MMP-1、TIMP-1、 β-actin 的扩增循环数依次为 35、25、 24,退火温度依次为 53 ℃、50 ℃、 54 ℃。 取 PCR产物 8 μL加 5 ×Loading Buffer 2 μL于 2%琼脂糖凝胶电泳, 随后用溴化乙啶染色, 利用 JD801 系列凝胶成像系统 (江苏省捷达科技发展有限公司) 半定量分析心肌 MMP-1 及 TIMP-1 mRNA表达, 结果以目的条带的积分光密度与相关 β-actin 积分光密度的比值表示。
1.4.5 Western-Blot分析心肌 MMP-1 及 TIMP-1 蛋白的表达 从心肌中提取蛋白样本, 加入 SDSPAGE上样缓冲液, 沸水煮 10 min, 然后 3 000 r/min离心 1 min 混匀。 变性后的蛋白在 12.5%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳中分离(SDS-PAGE)。电泳后的条带用转印缓冲液转移到硝酸纤维素膜上。然后,硝酸纤维素膜用封闭液(5%脱脂牛奶) 在室温下孵育以阻断反应, 用TBS-T(TBS 1 000mL∶Tween20 500 μL)洗 4 次。硝酸纤维素膜用 一 抗 ( MMP-1,1 ∶300 稀 释;TIMP-1, 1 ∶300 稀释) 和 β-actin (1 ∶1 000 稀释)在 4 ℃下孵育过夜并用 PBS-T洗 3 次。 该膜在室温下二抗孵育 (1 ∶1 000 稀释) 2 h。 参照 DAB试剂盒说明书取膜显色, 条带以目的蛋白与相关 β-actin 积分光密度 ( IOD) 的比值表示, 结果以 JD801系列凝胶成像系统 (江苏省捷达科技发展有限公司)半定量分析。
1.5 数据分析 采 用 SPSS 13.0 软件, 组 间 比 较用单因素方差分析。所有的结果用均值±标准差() 表示。 P<0.05 为差异有统计学意义。
2 结果
2.1 左室质量指数 (LVWI)的改变 与假手术组相比, 模型组大鼠 LVWI显著增加 (P<0.01)。与模型组相比,除葛根素低剂量组外其他各给药组LVWI显著降低 (P<0.01 或 P<0.05),其中联用组 LVWI效果最好 (P<0.05) (表 1)。
表1 各用药组心肌胶原容积分数、 左心室质量指数、 心肌羟脯氨酸及血管紧张素Ⅱ水平的变化 (, n=8)Tab.1 Collagen volume fraction, LVW I and levels of HYP and AngⅡ in m yocardium in all groups(, n=8)
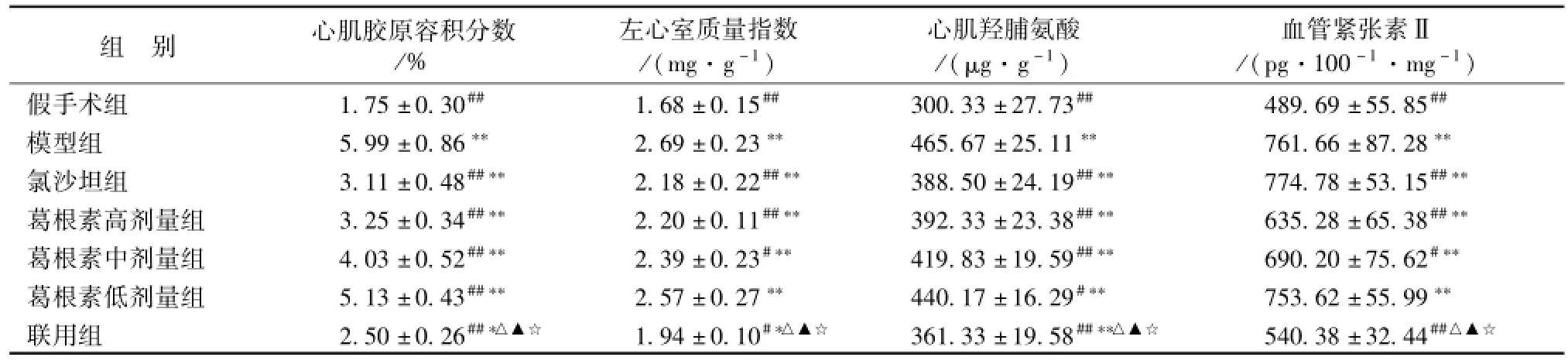
表1 各用药组心肌胶原容积分数、 左心室质量指数、 心肌羟脯氨酸及血管紧张素Ⅱ水平的变化 (, n=8)Tab.1 Collagen volume fraction, LVW I and levels of HYP and AngⅡ in m yocardium in all groups(, n=8)
注:与假手术组比较,*P<0.05,**P<0.01; 与模型组比较,#P<0.05,##P<0.01; 与葛根素高剂量组比较,△P<0.05; 葛根素中剂量组比较,☆P<0.05; 与氯沙坦组比较,▲P<0.05
组 别 心肌胶原容积分数/%左心室质量指数/(mg·g-1)心肌羟脯氨酸/(μg·g-1)血管紧张素Ⅱ/(pg·100-1·mg-1)假手术组 1.75 ±0.30## 1.68 ±0.15## 300.33 ±27.73## 489.69 ±55.85##模型组 5.99 ±0.86** 2.69 ±0.23** 465.67 ±25.11** 761.66 ±87.28**氯沙坦组 3.11 ±0.48##** 2.18 ±0.22##** 388.50 ±24.19##** 774.78 ±53.15##**葛根素高剂量组 3.25 ±0.34##** 2.20 ±0.11##** 392.33 ±23.38##** 635.28 ±65.38##**葛根素中剂量组 4.03 ±0.52##** 2.39 ±0.23#** 419.83 ±19.59##** 690.20 ±75.62#**葛根素低剂量组 5.13 ±0.43##** 2.57 ±0.27** 440.17 ±16.29#** 753.62 ±55.99**联用组 2.50 ±0.26##*△▲☆ 1.94 ±0.10#*△▲☆ 361.33 ±19.58##**△▲☆ 540.38 ±32.44##△▲☆
2.2 左室心肌组织胶原纤维的改变及心肌胶原容积分数的改变
2.2.1 左室心肌组织胶原纤维的改变 光镜下发现胶原纤维呈蓝色,心肌细胞呈红色。与假手术组相比,模型组大鼠心肌细胞间隙增大,心肌纤维排列紊乱,胞核深染、增大,蓝色胶原纤维沉积明显。给予葛根素与氯沙坦治疗后,各组心肌纤维化程度均减轻, 联用组效果最好 (图1)。
2.2.2 左室心肌胶原容积分数的改变 与假手术组相比,模型组大鼠心肌胶原容积分数明显升高(P<0.01)。与模型组相比, 各用药组大鼠心肌胶原容积分数明显降低 (P<0.01 或 P<0.05), 且葛根素各剂量组间呈剂量依赖性 (P<0.01)。 与葛根素高、中剂量组及氯沙坦组相比,联用组大鼠心肌胶原容积分数显著降低 (P<0.05)(表 1)。
3 生化指标测定结果
3.1 左室心肌 HYP水平的变化 与假手术组相比,模型组大鼠左室心肌羟脯氨酸 (HYP) 水平明显升高 (P<0.01)。 与模型组相比, 各用药组大鼠左室心肌 HYP水平明显降低 (P<0.01 或 P<0.05), 其中联用组效果最好 (P<0.05), 且葛根素各剂量组间呈剂量依赖性 (P<0.05) (表 1)。
3.2 左室心肌 AngⅡ水平的变化 与假手术组相比, 模型组大鼠心肌局部 AngⅡ 水平明显升高(P<0.01)。 与模型组相比, 葛根素高、 中剂量组及联用组心肌 AngⅡ水平明显降低 (P<0.01 或P<0.05), 其中联用组效果最好 (P<0.05)。 氯沙坦组心肌 AngⅡ水平有升高趋势 (P>0.05)(表1)。
4 左室心肌 MMP-1、 TIMP-1 mRNA与蛋白表达的变化
4.1 左室心肌 MMP-1、 TIMP-1mRNA表达的变化与假手术组相比, 模型组大鼠左室心肌 MMP-1及 TIMP-1 mRNA表达及两者比值显著升高 ( P<0.01)。 与模型组比较, 葛根素高剂量组、 氯沙坦组和联用组左室心肌 MMP-1 与 TIMP-1 mRNA表达以及两者比值显著降低 (P<0.01 或 P<0.05),其中联用组效果最好 (P<0.05) (图 2)。
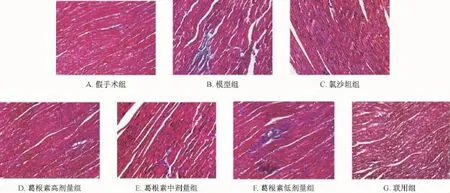
图 1 各组大鼠心肌 M asson染色 ( ×400) 变化Fig.1 Typical slices stained by Masson stain( ×400) for levels ofmyocardial fibrosis in all groups
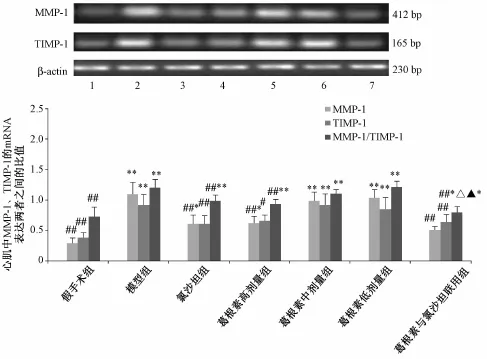
图 2 各组大鼠左室心肌 MMP-1 与 TIM P-1 基因 RT-PCR产物电泳图及其与 β-actin的光密度比值Fig.2 Expressions of MMP-1 and TIMP-1 gene product electrophoresis figure for RT-PCR and the ratios of optical density values of their to β-actin in the righ t kidney in all groups
4.2 各用药组大鼠左室心肌组织 MMP-1、TIMP-1蛋白表达的变化 与假手术组相比,模型组大鼠左室心肌 MMP-1 及 TIMP-1 蛋白表达及两者比值显著升高 (P<0.01)。 与模型组比较, 葛根素高剂量组、 氯沙坦组和联用组心肌 MMP-1 与 TIMP-1 蛋白表达以及两者比值显著降低 (P<0.01 或 P<0.05), 联用组效果更好 (P<0.05) (图 3)。

图 3 各组大鼠左室心肌 MM P-1 与 TIMP-1 蛋白的表达Fig.3 Expression of MMP-1 and TIMP-1 protein in the left ventricle in all groups
5 讨论
两肾一夹大鼠模型中肾组织的缺血可激活循环和局部肾素-血管紧张素系统 (RAS)。 业已证实,心肌局部 RAS的过度激活会引起心肌纤维化, 导致心肌重构[8]。 RAS 中 AngⅡ是心肌重构早期的重要调节因子,能促进心脏成纤维细胞中Ⅰ型、Ⅲ型胶原的基因表达[9],抑制细胞外基质 (EMC) 降解的关键酶 MMPs, 减少胶原的降解[10]。研究表明[11], 心肌纤维化时 MMP-1 与 TIMP-1 表达增加,两者比值增大,且两者的比值增大会促进心肌纤维化的发展。在异丙肾上腺素诱导的心衰大鼠模型中, IL-7 能通过升高心肌 MMP-1/TIMP-1 比值,促进心肌纤维化的发生[12]。 本实验观察到, 肾性高血压大鼠模型组大鼠心 肌 MMP-1、 TIMP-1 mRNA表达增加,这与王先梅等[13]在心肌肥厚患者心肌组织中发现的一致。但有一些研究测得不同动物疾病模型心肌 MMP-1 与 TIMP-1 的表达及活性差异很大,这可能与两者在各种疾病发展中的作用、两者间相互的调节以及研究者测定的时期、所采用的测定方法有关。心肌发生病变初期,炎症因子促使心肌 MMP-1 表达增加, 同时引起心肌 TIMP-1 的表达也增加, 但随着病程的发展, MMP-1 表达逐渐减少, 可能是由于 TIMP-1 抑制其活性, 胶原的降解减少, 心肌 EMC沉积,导致心肌重构。
本实验发现, 肾性高血压大鼠模型组心肌 AngⅡ水平、 MMP-1 及 TIMP-1 mRNA、 蛋白表达水平及其比值显著升高。 心肌局部 AngⅡ水平升高,促使心肌胶原沉积。病程早期心肌可代偿性增加MMP-1 的表达及活性, 抑制 TIMP-1 活性, 抑制胶原沉积。但随着病程进展,心肌胶原沉积加重,组织中 MMP-1 及 TIMP-1 平衡失调, 纤维化进行性加重。葛根素及氯沙坦治疗8周后,除氯沙坦组外其他各给药组心肌 AngⅡ水平出现不同程度降低,MMP-1 与 TIMP-1 mRNA及蛋白表达的比值不同程度降低,而这些变化均以联用组效果最好。氯沙坦组 AngⅡ水平较模型组有升高趋势, 这与刘守钾等[14]的研究结果一致。 以上结果提示葛根素联用氯沙坦对肾性高血压大鼠心肌重构的改善具有协同作用, 其机制可能与降低心肌 AngⅡ水平、 下调心肌 MMP-1/TIMP-1 mRNA及蛋白表达的比值有关。
[1] 赵国安,陈 丹,丁明伟.灯盏花素联合预适应对家兔缺血再灌注心肌保护作用的影响[J].临床心血管病杂志,2009, 25(2): 135-136.
[ 2 ] Chen R, Xue J, Xie M L, et al.Puerarin prevents isoprenaline-induced myocardial fibrosis inmice by reduction ofmyocardial TGF-β1expression [ J] .JNutr Biochem, 2012, 23 ( 9 ):1080-1085.
[ 3 ] 黄帧桧, 程慧珍, 张年宝, 等.葛根素对左室局部 AngⅡ水平的影响及对左室肥厚的逆转作用[J].实用药物与临床, 2010, 13(3): 161-163.
[4] 黄成晋,张龙生.葛根素联用氯沙坦对原发性高血压疗效研究[ J] .国际医药卫生导报, 2005, 11(16) : 82-84.
[ 5 ] Duke L M, Widdop R E, Kett M M, et al.AT2 receptorsmediate tonic renal medullary vasoconstriction in renovascular hypertension[ J] .Br JPharmacol, 2005, 144(4) : 486-492.
[6] 张年宝,程慧珍,崔卫东,等.葛根素对肾性高血压大鼠的降压作用及对肾组织 ANGⅡ的影响[J].中药药理与临床, 2010, 26 (2): 26-29.
[ 7 ] Zhang N B, Huang ZG, CuiW D, et al.Effects of puerarin on expression of cardiac Smad3 and Smad7mRNA in spontaneously hypertensive rat[ J] .J Ethnopharmacol, 2011, 138 ( 3 ):737-740.
[ 8 ] Crowley SD, Gurley SB, Herrera M J, et al.Ang causes hypertension and cardiac hypertrophy through its receptors in the kidney[ J].Proc Natl Acad SciUSA, 2006, 103(47) : 17985-17990.
[ 9 ] Kobori H, Lchihara A, Miyashits Y, et al.Local rennin-angiotensin system contributes to hyperthyroidism-induced cardialhypertrophy[ J].JEndocrinol, 1999, 160 (1) : 43-47.
[10 ] Brilla CG.Aldosterone and myocardial fibrosis in heart failure[J] .Herz, 2000, 25(3) : 299-306.
[11 ] Sivasubramanian N, Coker M L, Kurrelmeyer K M, et al.Left ventricular remodeling in transgenic mice with cardiac restricted overexpression of tumor necrosis factor[ J] .Circulation, 2001,104(7): 826-831.
[12 ] Feng W W, LiW, Liu W, et al.IL-17 inducesmyocardial fibrosis and enhances RANKL/OPG and MMP/TIMP signaling in isoproterenol-induced heart failure[ J] .Exp Mol Pathol, 2009,87(3): 212-218.
[13] 王先梅, 严 睿, 杨丽霞, 等.心肌组织基质金属蛋白酶-1, 2, 9 及其抑制物-2 基因表达变化在心肌肥厚患者心肌纤维化中的意义 [J].中国循环杂志, 2006, 21 (5):382-385.
[14] 刘守钾, 刘 苑, 张 兴.毛茛总苷对肾性高血压大鼠血压、 NO、 AngⅡ及 A7r5 细 胞内 钙的影 响 [ J].中药 材,2012, 35(6): 953-955.
Effect of puerarin combined w ith losartan on ratio of MMP-1/TIMP-1 in m yocardium in renovascular hypertensive rats
HUANG Zhen-gui, CHEN Li, BAISong, WANG Jiang-tao, DING Bo-ping
(Department of Pharmacology&Pharmacology of TCM Grade Three Laboratory, State Administration of Traditional Chinese Medicine of P.R.China,Wannan Medical College, Wuhu 241002, China)
AIM To study the effect of puerarin combined with losartan on the ratio ofMMP-1/TIMP-1 mRNA and protein expression inmyocardium in renovascular hypertensive rats.M ETHODS Sixty-fivemale SD ratswere used.Eight ratswere randomly selected as sham operation group,and the restwere used tomake two-kidney-oneclip Goldblattmodel.The rats thatmet the criterion for Goldblatt hypertensive ratwere randomly assigned into six groups, high-, middle-and low-dose puerarin groups, losartan group, combination group and model group.After being administered for eightweeks, LVWI(left ventricular weight index)wasmeasured.Myocardial collagen fibers were evaluated through Masson trichromestaining; CVF ( collagen volume fraction ) ofmyocardium was also measured.The contents of HYP(hydroxyproline) and AngⅡ ( angiopoietin-Ⅱ) in myocardium were measured. ThemRNA and protein expression of MMP-1 and TIMP-1 in myocardium weremeasured by RT-PCR and Western blot.RESULTS Compared with themodel group, CVF and the contentof HYP inmyocardium in all drug-treated groups significantly decreased ( P<0.01 or P<0.05) , and the above-mentioned effects were the best in the combination group ( P<0.05).The contents of AngⅡ inmyocardium in puerarin high-, middle-dose groups and the combination groupmarkedly decreased ( P<0.01 or P<0.05 ) , and those in the combination group were the lowest.LVWI significantly decreased ( P<0.01 or P<0.05 ) in all drug-treated groups except low-dose puerarin.The ratio ofMMP-1/TIMP-1 mRNA and protein expressionmarkedly decreased (P<0.05), and those of the combination group ( P<0.05 ) decreased the most.CONCLUSION A combination of puerarin with losartan can down-regulate the ratio ofMMP-1/TIMP-1 mRNA and protein expression in myocardium,and improvemyocardial fibrosis in renovascular hypertensive rats.
renal hypertensive rats; puerarin combined with losartan; myocardial fibrosis; ratio of MMP-1/ TIMP-1 mRNA and protein
R285.5
: A
: 1001-1528(2014)03-0462-06
10.3969/j.issn.1001-1528.2014.03.005
2013-06-16
安徽省自然科学基金资助项目 (070413124); 皖南医学院博士启动基金资助项目 (BK00010804)
黄帧桧 (1965—) , 男, 博 士, 副 教 授, 硕 士 生 导 师, 研 究 方 向: 中 药 药 理 与 临 床 药 理。 Tel: ( 0553 ) 3932464, E-mail:huangzhenggui2006@aliyun.com

