斑马鱼nr1d4a和nr1d4b基因的表达及其对不同环境刺激的响应
杨 玲严军军龙 勇崔宗斌鲍传和
(1. 安徽农业大学生命科学院, 合肥 230000; 2. 中国科学院水生生物研究所, 武汉 430072)
斑马鱼nr1d4a和nr1d4b基因的表达及其对不同环境刺激的响应
杨 玲1严军军2龙 勇2崔宗斌2鲍传和1
(1. 安徽农业大学生命科学院, 合肥 230000; 2. 中国科学院水生生物研究所, 武汉 430072)
研究获得了斑马鱼nr1d4a和nr1d4b基因的cDNA, 进行了序列比对和系统进化分析, 并采用实时定量RT-PCR (qPCR)方法研究了其表达模式及对不同环境刺激的转录反应。研究发现, 斑马鱼nr1d4a和nr1d4b是由基因复制产生的旁系同源基因, 具有高度保守的DNA结合结构域和配体结合结构域。斑马鱼nr1d4a和nr1d4b的表达模式具有明显的差别。nr1d4a在胚胎发育早期的表达量很低, 72 hpf时开始显著升高; 而nr1d4b具有较高水平的母源性表达, 6 hpf时的表达量明显降低, 但也在72 hpf显著回升。nr1d4a在脑和肾脏中表达量最高, 其次是鳃、卵巢、精巢和眼, 在肝脏中的表达量最低; nr1d4b在卵巢中表达量最高, 其次是精巢和脑, 在肠道和心脏中表达量最低。斑马鱼nr1d4a和nr1d4b都能被多种环境刺激瞬时诱导表达。16℃低温处理0.5h就能显著诱导斑马鱼nr1d4a和nr1d4b基因的表达, 但处理6h后其诱导效应开始下降并逐渐消失。除低温外, 重金属(2 μmol/L镉)、缺氧(5%氧气)和盐度(5‰)处理均能瞬时诱导nr1d4a和nr1d4b的表达,说明nr1d4a和nr1d4b基因可能参与斑马鱼对多种环境刺激的适应性反应。研究为深入揭示鱼类nr1d4a和nr1d4b基因的生物学功能及其表达调控机制奠定了基础。
斑马鱼; 细胞核受体; 环境刺激; 基因表达
斑马鱼 nr1d4a和 nr1d4b基因是细胞核受体(Nuclear receptor)家族的成员[1]。细胞核受体是一类能与类固醇激素、甲状腺激素、亲脂性维生素和小分子代谢产物等配体相结合的转录因子[2]。细胞核受体与相应的配体结合后产生变构效应而被激活,激活的受体与特定 DNA序列结合, 并募集其他通用转录因子和共激活因子(Coactivator)或共抑制因子(Corepressor), 从而激活或抑制下游基因的表达[3]。除了已知的能与配体结合的细胞核受体外, 大约有50%的细胞核受体因缺乏已知的配体而被称为“孤儿受体”[2]。细胞核受体家族成员众多, 在胚胎发育、体内稳态维持、代谢调控、疾病发生等生物学过程中发挥着重要功能[1]。
长期以来, NR1D亚类细胞核受体(Rev-reb)都被认为是孤儿受体。近期研究发现, 血红素是NR1D1、NR1D2和 E75(NR1D3)等的配体[4—6]。 NR1D1和 NR1D2主要起抑制基因表达的作用, 在脊椎动物中主要参与生物钟节律(Circadian rhythm)、代谢调控和炎症反应[7—10]。在果蝇等无脊椎动物中, E75参与蜕皮激素信号传导、蜕皮激素合成、胚胎发育等重要的生物学过程[6]。虽然该亚类其他几个受体的研究较多, 但鱼类 Nr1d4的研究还未见报道, 尚不清楚其配体和生物学功能。
前期研究发现, 在暴露于16℃低温2h后, 斑马鱼96hpf出膜仔鱼中nr1d4a和nr1d4b的表达量都显著上调; 暴露 48h后诱导效应消失, 而 34℃高温处理2h和48h都不能诱导其表达[11]。据此推测这两个基因都是低温刺激条件下的即刻早期基因(Immediate early gene, IEG), 可能对低温适应性表型的建立起着重要的调控作用。为研究斑马鱼nr1d4a和nr1d4b基因的表达特征, 验证其是否具有低温特异性, 本研究克隆获得了这两个基因的cDNA, 研究其在胚胎和仔鱼阶段及成体不同组织中的表达模式; 同时将斑马鱼96hpf仔鱼分别暴露于低温、高温、重金属、盐度和缺氧等环境刺激, 检测不同处理对其转录表达的诱导效应, 为深入研究斑马鱼nr1d4a和nr1d4b基因的生物学功能奠定基础。
1 材料与方法
1.1 cDNA克隆
根据 GenBank中预测的斑马鱼 nr1d4a(XM_ 686515)和nr1d4b(XM_695595)mRNA序列分别设计PCR引物(表1), 用成体斑马鱼脑cDNA作模板扩增其编码区序列。切胶回收扩增片段后用 BamHⅠ和XbaⅠ双酶切, 并与经相同酶切的 pCMV-N-HA(碧云天)载体连接。连接产物转化 Top10大肠杆菌后,挑取阳性克隆测序。
1.2 序列比对和系统进化分析
用Vector NTI 8.0软件进行序列比对, 分析不同NR1D受体氨基酸序列之间的保守位点和同源性。为构建 NR1D亚类细胞核受体的系统进化树, 先用Clustalx 2.1[12]软件对不同受体的氨基酸序列进行多重序列比对, 序列比对结果用 MEGA 4.0[13]中的最大简约法(Maximum parsimony)构建系统进化树。
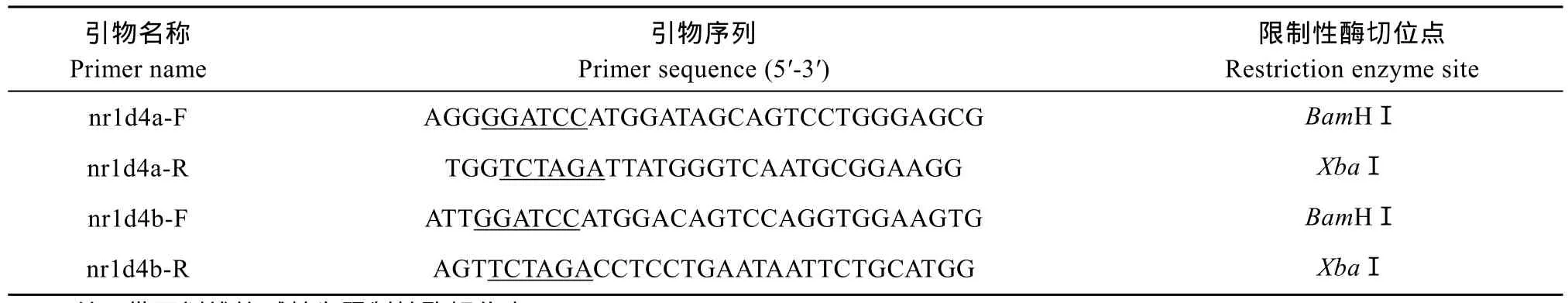
表1 用于cDNA克隆的引物Tab. 1 Primers used for cDNA cloning
1.3 斑马鱼胚胎和组织样品的收集
按照文献[14]的方法收集和培养 AB品系斑马鱼胚胎。分别在受精后0.75(2细胞期), 6、12、24、48、72、96和 120h收集胚胎或仔鱼。收集的样品保存在1.5 mL塑料离心管中, 并将培养液吸干。每个时间点各取3个生物学平行, 其中2细胞期时每管收100粒胚胎, 其他时期每管各取60粒(尾)胚胎(仔鱼)。取出膜仔鱼时先将培养皿放冰上, 待其麻醉后再吸入离心管。1龄斑马鱼成鱼[体重(0.55±0.12) g]用0.016% MS-222麻醉后解剖, 取脑、鳃、心脏、眼、肾脏、肝脏、肠道、肌肉、精巢和卵巢等组织置于离心管中。除卵巢取自雌鱼外, 其他组织都来自雄鱼。收集的样品置液氮中速冻后于–80℃保存。
1.4 斑马鱼仔鱼的处理
将胚胎培养到48 hpf时取表型正常的胚胎, 按60粒/培养皿的密度随机分配到盛6 mL胚胎培养液的60 mm塑料培养皿中。96 hpf时开始环境因子暴露, 包括对照、低温(16℃)、高温(34℃)、重金属(2 μmol/L 氯化镉)、盐度(5‰)和缺氧等6个处理组,每个处理组设3个生物学平行。低温和高温处理方法参照文献[11, 15]。除温度刺激外, 其他处理都在28℃条件下进行。重金属和盐度处理时分别将氯化镉(国药集团)和海水晶(广东盐业集团)用胚胎培养液(30% Danieau溶液)配制成所需浓度。缺氧处理在Eppendorf Galaxy®48R CO2培养箱中进行, 氧气含量为5%。斑马鱼胚胎的培养和除缺氧以外的处理都在生化培养箱(上海精宏 SHP-150型)中进行。处理后未发现实验鱼死亡情况。对照和低温处理组分别在暴露后0.5、2、6、12和24h收集样品, 其他处理组则分别在暴露后2、12和24h收集样品。
1.5 总RNA的提取和逆转录
收集的样品用TRIZOL试剂(Invitrogen)提取总RNA。用NanoDrop 8000 (Thermo Scientific)测定总RNA浓度。琼脂糖凝胶电泳检测RNA样品完整性, 28S 和18S 核糖体RNA 条带清晰, 两者的光密度比值都在2.0 左右。逆转录前用无RNA酶的DNA酶Ⅰ(Promega)处理总RNA样品以去除基因组DNA污染。用Fermentas RevertAidTM第一链cDNA合成试剂盒中的6碱基随机引物从4 μg总RNA合成第一链cDNA。
1.6 qPCR
qPCR引物用Primer Premier 6.0软件设计, 由上海生物工程有限公司合成。qPCR反应在Bio-rad CFX96实时定量 PCR仪中进行。每个反应重复 3次。qPCR反应体系和程序、Cq值的确定、标准曲线的绘制及引物扩增效率的计算参考文献[11]。qPCR检测的基因名称、GenBank登录号、引物的序列和扩增效率见表2。文献[16]的研究结果表明, 常用内参基因中18S (18S ribosomal RNA)的表达在不同发育阶段和不同组织中最稳定, 而 actb1 (actin beta1)的表达在不同环境刺激处理后最稳定。因此,本研究以18S作内参检测目的基因在胚胎发育过程中和不同成体组织中的表达, 以 actb1作内参检测不同处理条件下目的基因的表达。用Q-Gene方法[17]计算目的基因的相对表达量。
1.7 统计分析
处理组和对照组之间目的基因的表达差异用SPSS 15.0软件中的独立样本t检验方法进行显著性分析(P<0.05)。
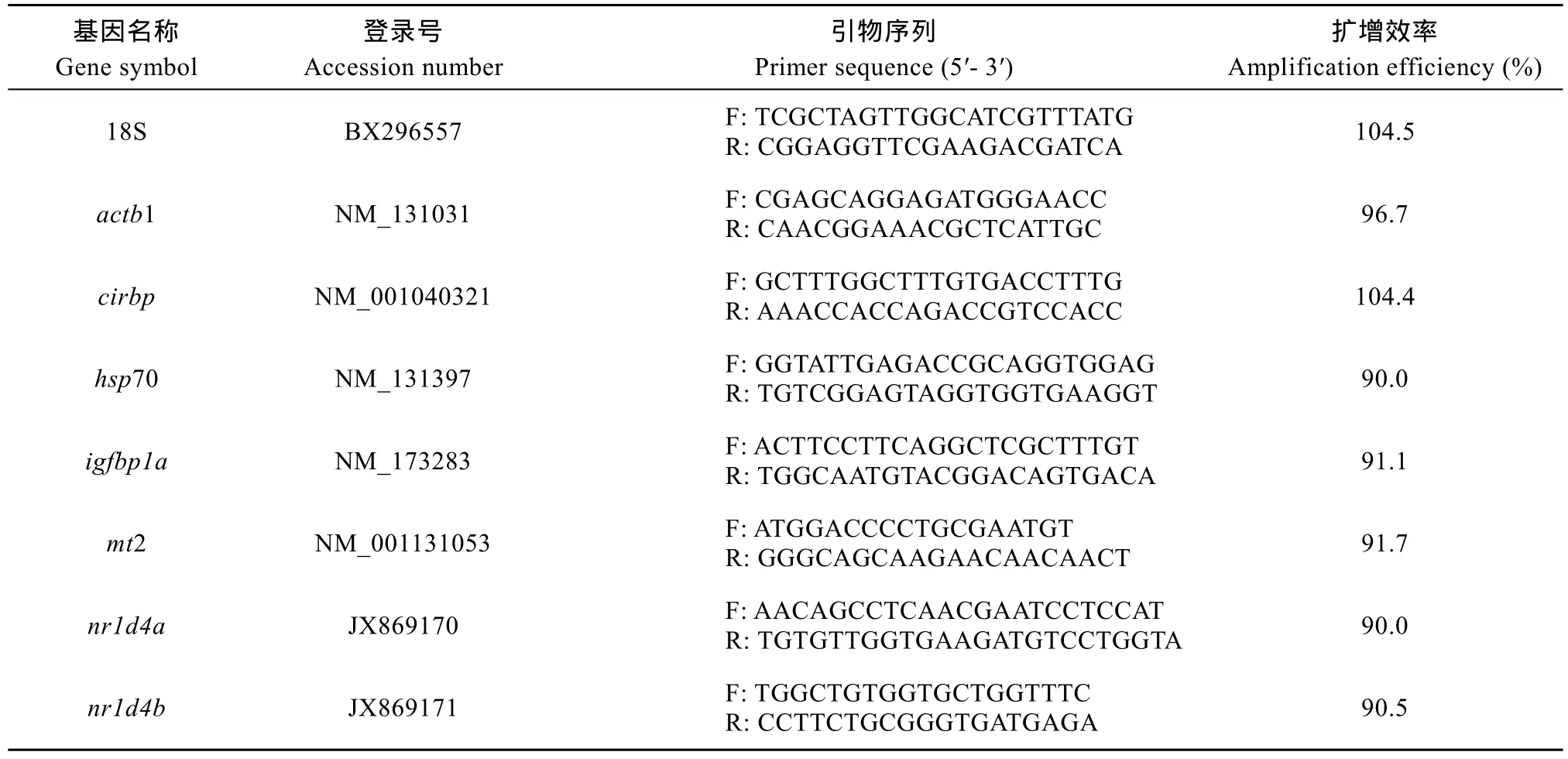
表2 定量PCR引物序列及扩增效率Tab. 2 Sequences and amplification efficiency of qPCR primers
2 结果
2.1 斑马鱼nr1d4a和nr1d4b是旁系同源基因
本研究采用RT-PCR方法获得斑马鱼nr1d4a和nr1d4b基因的编码区, 并提交到 GenBank数据库,登录号为JX869170和JX869171。这两个序列与预测序列(XM_686515和XM_695595)的相应编码区长度相同, 核苷酸序列仅存在细微差别, 分别相差 12和5个碱基, 编码的肽链分别相差7和3个氨基酸,说明本研究成功获得斑马鱼nr1d4a和nr1d4b基因的编码序列。
斑马鱼nr1d4a和nr1d4b基因分别位于23号和11号染色体(图 1A)。基因同线性分析(Syntenic analysis)结果表明, 虽然斑马鱼nr1d4a和nr1d4b上游的基因各不相同, 但其下游的基因具有较为严格的同线性, 如 raraga/b、hoxc13a/b、hoxc12a/b和hoxc11a/b等(图1A)。斑马鱼nr1d4a和nr1d4b基因的结构也相当保守, 都包含 8个外显子, 各个外显子的长度也非常接近(图 1B)。这些结果表明, 斑马鱼nr1d4a和nr1d4b是进化过程中由基因组复制产生的旁系同源基因。
2.2Nr1d细胞核受体的系统进化和序列比对分析
NR1D亚类细胞核受体共有 4个, 包括NR1D1(Rev-erbα)、NR1D2(Rev-erbβ)、NR1D3(E75)和NR1D4, 其中哺乳动物中只有NR1D1和NR1D2, NR1D3只在果蝇等无脊椎动物中存在, 而 NR1D4则为硬骨鱼类所特有[1,6]。NR1D2和NR1D4在斑马鱼中发生了加倍, 各有两个旁系同源基因[1]。用斑马鱼Nr1d4a和Nr1d4b氨基酸序列Blast搜寻Ensembl数据库中的青 鳉 (Oryzias latipes)基因组序列, 都能找到高度保守的同源基因(图 2 A), 说明nr1d4基因在其他硬骨鱼类中也发生了复制。系统进化分析结果表明, 斑马鱼的Nr1d1、Nr1d2a和Nr1d2b分别与人(Homo sapiens)和小鼠(Mus musculus)的NR1D1与NR1D2聚为一类, 斑马鱼的Nr1d4a和Nr1d4b与青鳉的 ENSORLP00000009821和 ENSORLP000000 19274聚为一类(NR1D4), 家蚕(Bombyx mori)和旋毛虫(Trichinella spiralis)的 E75亲缘关系最近(NR1D3)(图 2A)。这些研究结果进一步明确了斑马鱼Nr1d亚类细胞核受体的分类关系。
斑马鱼nr1d4a和nr1d4b分别编码570和576个氨基酸, 其核苷酸和蛋白质序列的同源性分别为68%和67%。为分析斑马鱼Nr1d4a和Nr1d4b重要功能域的保守性, 将其与研究较为详细的人NR1D1和NR1D2的DNA结合结构域和配体结合结构域序列进行了比对分析。结果表明, 这些蛋白的DNA结合结构域高度保守, 同源性高达 90%以上, 配体结合结构域也非常保守, 但同源性比 DNA结合结构域低(图2B)。因此, 斑马鱼Nr1d4a和Nr1d4b与人NR1D1和NR1D2可能具有相似的DNA结合位点和结合相同的配体。
2.3 斑马鱼nr1d4a和nr1d4b基因的表达谱
基因在发育过程及成体组织中的表达数据对探讨其功能具有重要作用。收集不同发育阶段的斑马鱼胚胎及仔鱼进行 qPCR分析, 检测 nr1d4a和nr1d4b在早期发育过程中的转录表达。结果表明, nr1d4a在早期(0.75—48 hpf)的表达量很低, 出膜后其表达量迅速升高, 72 hpf时的表达量是48 hpf的13.40倍, 96 hpf时表达量在72 hpf的基础上进一步升高, 而从96 hpf到120 hpf其表达量保持不变(图3A)。nr1d4b在2细胞期(0.75 hpf)具有较高水平的母源性表达, 6 hpf开始其表达量明显下降并维持在较低水平(6—48 hpf), 72 hpf时表达量显著升高, 约为 48 hpf表达量的7.89倍, 96 hpf的表达量与 72 hpf相同, 120 hpf时表达量进一步升高(图3B)。胚胎发育过程中nr1d4b的表达量高于 nr1d4a,但随着发育的进行其差距逐渐缩小, 如在 0.75、6、12、24和48 hpf时nr1d4b的表达量分别为nr1d4a表达量的40.28、26.63、10.77、3.36和3.51倍。另外, 这两个基因的表达量都在出膜后(72 hpf)显著升高(图3), 说明其存在是仔鱼的正常生命活动所必需的。
在成体组织中, 斑马鱼nr1d4a在脑和肾脏中的表达量最高, 其次是鳃、卵巢、精巢和眼, 而在肝脏中的表达量最低; nr1d4b在卵巢中表达量最高, 其次是精巢和脑, 而在肠道和心脏中表达量最低(图4)。在肠道、肝脏、肌肉、心脏和眼中nr1d4a与nr1d4b的表达量非常接近, 而在脑、肾脏和鳃中nr1d4a的表达量高于nr1d4b, 在精巢和卵巢中nr1d4b的表达量高于nr1d4a (图4)。这些结果表明, 斑马鱼nr1d4a和nr1d4b的组织分布存在较大差别; 由于其氨基酸序列高度保守, 可能这两个受体在成体的不同组织中发挥相同的功能。
2.4 斑马鱼nr1d4a和nr1d4b基因对不同环境刺激的响应
为研究不同环境刺激对斑马鱼 nr1d4a和nr1d4b基因转录表达的诱导效应, 将96 hpf斑马鱼仔鱼分别暴露于低温、盐度、高温、缺氧和重金属(Cd)等环境刺激。首先根据文献报道选择不同环境刺激条件下显著上调表达的标记基因, 包括 cirbp (低温)[15]、hsp70(高温和盐度)[11,18]、igfbp1a(缺氧)[19]和mt2(重金属)[20]。通过检测标记基因的表达来验证本研究中环境刺激的有效性。结果表明不同环境刺激都能显著诱导相应标记基因的表达(图5), 说明了本研究所用刺激条件的有效性。
由图6A可知, 暴露于低温处理0.5h后nr1d4a的表达量就显著上调, 处理 2—6h后诱导倍数进一步升高, 而处理 12h后诱导效应开始下降, 到 24h时处理组的表达量已降低到与对照组相同的水平。对于其他环境刺激, 暴露2h后缺氧和盐度处理能显著诱导nr1d4a的表达, 暴露12h后重金属、高温和盐度能显著诱导nr1d4a的表达, 而处理24h后只有高温能显著诱导nr1d4a的表达(图6B)。以上结果表明, 不同环境刺激都能在暴露后瞬时诱导nr1d4a的表达, 其中低温处理的诱导效应最强; 不同环境刺激的作用时间也有差别, 低温、缺氧和盐度处理2h后即可显著诱导其表达, 而镉和高温则在处理 12h后才表现出诱导效应(图6)。
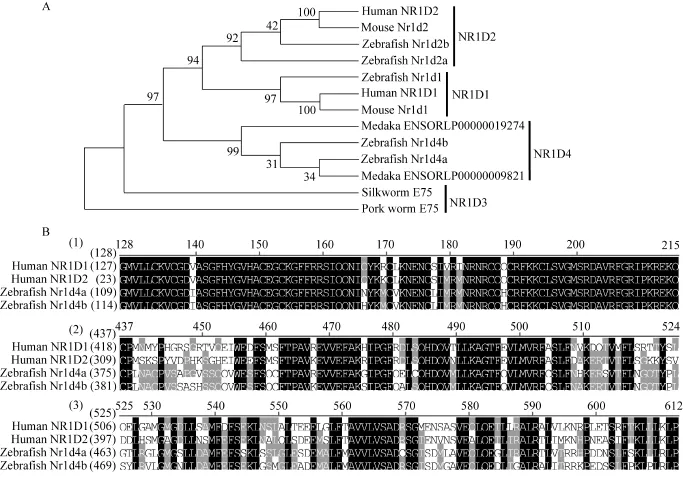
图2 NR1D细胞核受体的系统进化分析和序列比对Fig. 2 Phynogenetic analysis and sequence alignment of NR1D nuclear receptors
与 nr1d4a相似, 低温处理0.5h也能显著诱导nr1d4b的表达, 处理2和6h后诱导效应进一步增强, 而处理12和24h后则没有诱导效应(图7A)。对于其他环境刺激, 暴露 2h后只有缺氧能显著诱导nr1d4b的表达, 暴露12h后镉和盐度能显著诱导其表达, 而暴露 24h后则都不能诱导其表达(图7B)。对比 nr1d4a和 nr1d4b对不同环境刺激的转录反应可以发现, nr1d4a和nr1d4b的表达具有相同的变化方式, 都是在暴露后早期瞬时上调表达, 而且都能对不同环境刺激发生反应; 但也有不同之处, 首先是 nr1d4a发生反应的时间范围比 nr1d4b宽, 如低温暴露后 0.5—12h对 nr1d4a都有诱导效应, 而只在暴露后 0.5—6h对 nr1d4b有诱导效应,另外, 高温处理能诱导nr1d4a的表达, 但不能诱导nr1d4b的表达(图6、图7)。这些结果表明, 斑马鱼nr1d4a和nr1d4b都是能被多种环境刺激诱导表达的早期反应基因。
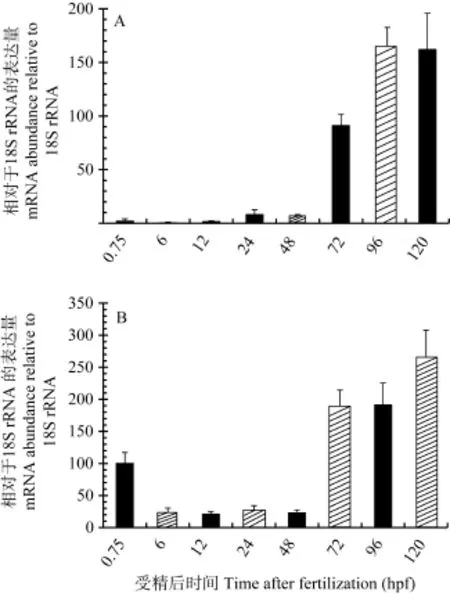
图3 斑马鱼nr1d4a (A)和nr1d4b (B)在胚胎期和仔鱼期的表达Fig. 3 Expression patterns of zebrafish nr1d4a (A) and nr1d4b (B) at embryonic and larval stages
3 讨论
Nr1d4是硬骨鱼类所特有的细胞核受体, 属于NR1D亚类[1]。虽然对该亚类中的NR1D1、NR1D2和 E75进行了较多的研究, 其配体和生物学功能已有一定的认识, 但 Nr1d4的研究还未见报道。本研究克隆获得了斑马鱼nr1d4a和nr1d4b基因的cDNA,并进行了序列比对和系统进化分析, 发现其核酸结合结构域和配体结合结构域均与人 NR1D1和NR1D2的相应结构域高度保守; 另外, 虽然E75是果蝇等无脊椎动物中所特有的 NR1D亚类成员, 但其与哺乳动物的NR1D1和NR1D2一样都识别血红素作为配体[4—6]。因此, 斑马鱼Nr1d4a和Nr1d4b可能结合与其他同亚族成员相同的配体和 DNA序列,但还需要进一步实验验证。

图4 斑马鱼nr1d4a和nr1d4b在不同组织中的表达Fig. 4 Tissue-specific expression of zebrafish nr1d4a and nr1d4b
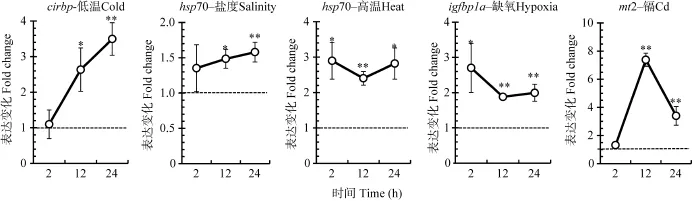
图5 不同环境刺激对标记基因的诱导表达Fig. 5 Induced expression of maker genes by their corresponding environmental stresses
本研究结果表明, 斑马鱼nr1d4a和nr1d4b是由基因复制产生的旁系同源基因, 虽然其编码的氨基酸序列具有很高的同源性, 但其表达模式具有明显的差别, 如 nr1d4a在胚胎发育早期表达量很低, 而nr1d4b具有较高水平的母源性表达; nr1d4a在脑和肾脏中表达量最高, 而nr1d4b则在卵巢中表达量最高, 说明在进化过程中不仅基因序列发生了改变,表达模式也发生了明显变化, 这与 Bertrand等的研究结果相一致[1]。虽然人的NR1D1和NR1D2并不是由基因复制产生的旁系同源基因, 但其调控的下游基因却有很大比例的重叠[8]。因此, 斑马鱼nr1d4a和nr1d4b这两个旁系同源基因可能在鱼体的不同发育阶段和不同组织中发挥着相似的作用; 但其具体生物学功能, 以及对所调控的下游基因究竟是起激活还是抑制作用都有待进一步研究。另外, 斑马鱼nr1d4a和 nr1d4b基因对低温等各种环境刺激都能产生相似的转录反应, 说明其表达调控机制也具有很大程度的相似性。
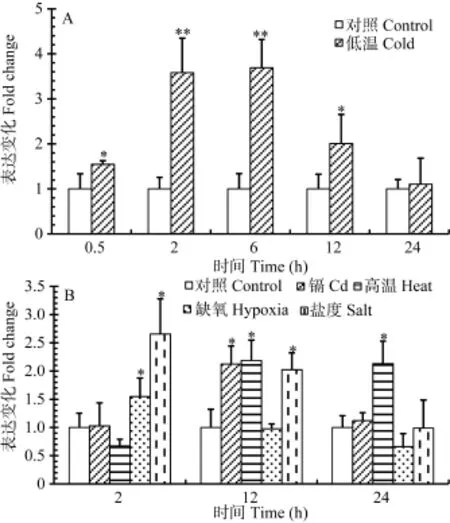
图6 不同环境刺激对斑马鱼nr1d4a转录表达的诱导效应Fig. 6 Inductive effect of different environmental stresses on the transcriptional expression of zebrafish nr1d4a
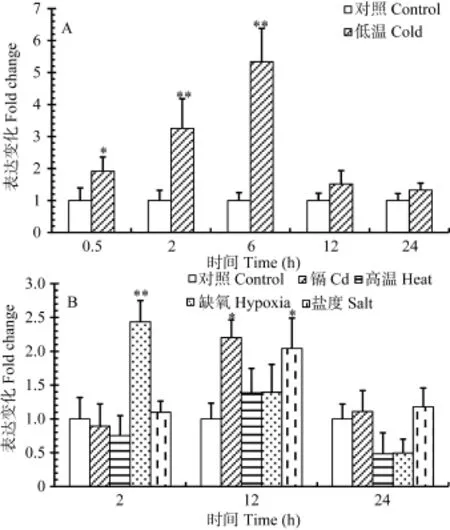
图7 不同环境刺激对斑马鱼nr1d4b转录表达的诱导效应Fig. 7 Inductive effect of different environmental stresses on the transcriptional expression of zebrafish nr1d4b
虽然斑马鱼nr1d4a和nr1d4b最初是由基因芯片研究发现的低温刺激诱导表达的即刻早期基因[11],但本研究结果表明, 除低温以外, 重金属、缺氧和盐度等环境刺激都能在暴露的早期阶段瞬时诱导其表达, 说明斑马鱼nr1d4a和nr1d4b是机体应对多种环境刺激的一般性即刻早期基因。这类基因的突出代表还包括fos (v-fos FBJ murine osteosarcoma viral oncogene homolog)和atf 3 (activating transcription factor 3)等, 这两个基因既能被低温处理显著诱导,又能被高温处理诱导表达[11]。深入研究这些基因的表达调控, 鉴定受其调控的下游基因, 将揭示环境刺激条件下细胞的基因表达调控网络以及机体应对不同环境刺激的适应性机制。
[1] Bertrand S, Thisse B, Tavares R, et al. Unexpected novel relational links uncovered by extensive developmental profiling of nuclear receptor expression [J]. PLoS Genetics, 2007, 3(11): e188
[2] Germain P, Staels B, Dacquet C, et al. Overview of nomenclature of nuclear receptors [J]. Pharmacological Reviews, 2006, 58(4): 685—704
[3] Chambon P. The nuclear receptor superfamily: a personal retrospect on the first two decades [J]. Molecular Endocrinology, 2005, 19(6): 1418—1428
[4] Gupta N, Ragsdale S W. Thiol-disulfide redox dependence of heme binding and heme ligand switching in nuclear hormone receptor rev-erb{beta} [J]. Journal of Biological Chemistry, 2011, 286(6): 4392—4403
[5] Cruz J, Mane-Padros D, Zou Z, et al. Distinct roles of isoforms of the heme-liganded nuclear receptor E75, an insect ortholog of the vertebrate Rev-erb, in mosquito reproduction [J]. Molecular and Cellular Endocrinology, 2012, 349(2): 262—271
[6] Reinking J, Lam M M S, Pardee K, et al. The Drosophila nuclear receptor E75 contains heme and is gas responsive [J]. Cell, 2005, 122(2): 195—207
[7] Teboul M, Delaunay F. The orphan nuclear receptor Rev-erb alpha is a major component of the circadian clock [J]. Medical Science (Paris), 2003, 19(4): 411—413
[8] Cho H, Zhao X, Hatori M, et al. Regulation of circadian behaviour and metabolism by REV-ERB-alpha and REV-ERB-beta [J]. Nature, 2012, 485(7396): 123—127
[9] Duez H, Staels B. Rev-erb alpha gives a time cue tometabolism [J]. FEBS Letters, 2008, 582(1): 19—25
[10] Ramakrishnan S N, Muscat G E. The orphan Rev-erb nuclear receptors: a link between metabolism, circadian rhythm and inflammation [J]? Nuclear Receptor Signaling, 2006, 4: e009
[11] Long Y, Li L, Li Q, et al. Transcriptomic characterization of temperature stress responses in larval zebrafish [J]. PLoS One, 2012, 7(5): e37209
[12] Larkin M A, Blackshields G, Brown N P, et al. Clustal W and Clustal X version 2.0 [J]. Bioinformatics, 2007, 23(21): 2947—2948
[13] Kumar S, Nei M, Dudley J, et al. MEGA: a biologist-centric software for evolutionary analysis of DNA and protein sequences [J]. Briefings in Bioinformatics, 2008, 9(4): 299—306 [14] Long Y, Li Q, Zhong S, et al. Molecular characterization and functions of zebrafish ABCC2 in cellular efflux of heavy metals [J]. Comparative Biochemistry and Physiology. Toxicology and Pharmacology, 2011, 153(4): 381—391
[15] Li L C, Li Q, Long Y, et al. Microarray analysis of temperature stress effects on transcriptional expression in zebrafish larvae [J]. Acta Hydrobiologica Sinica, 2012, 36(5): 882—891 [李林春, 李青, 龙勇, 等. 温度刺激对斑马鱼仔鱼基因转录表达的影响. 水生生物学报, 2012, 36(5): 882—891]
[16] McCurley A T, Callard G V. Characterization of housekeeping genes in zebrafish: male-female differences and effects of tissue type, developmental stage and chemical treatment [J]. BMC Molecular Biology, 2008, 9: 102
[17] Muller P Y, Janovjak H, Miserez A R, et al. Processing of gene expression data generated by quantitative real-time RT-PCR [J]. BioTechniques, 2002, 32(6): 1372—1374, 1376, 1378—1379
[18] Tine M, Bonhomme F, McKenzie D J, et al. Differential expression of the heat shock protein Hsp70 in natural populations of the tilapia, Sarotherodon melanotheron, acclimatised to a range of environmental salinities [J]. BMC Ecology, 2010, 10: 11
[19] Kajimura S, Aida K, Duan C. Understanding hypoxia- induced gene expression in early development: in vitro and in vivo analysis of hypoxia-inducible factor 1-regulated zebra fish insulin-like growth factor binding protein 1 gene expression [J]. Molecular and Cellular Biology, 2006, 26(3): 1142—1155
[20] Long Y, Li Q, Wang Y H, et al. MRP proteins as potential mediators of heavy metal resistance in zebrafish cells [J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 2011, 153(3): 310—317
EXPRESSION PATTERNS OF ZEBRAFISH NR1D4A AND NR1D4B AND THEIR TRANSCRIPTIONAL RESPONSES TO DIFFERENT ENVIRONMENTAL STRESSES
YANG Ling1, YAN Jun-Jun2, LONG Yong2, CUI Zong-Bin2and BAO Chuan-He1
(1. School of Life Sciences, Anhui Agricultural University, Hefei 230000, China; 2. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
We cloned the cDNAs of zebrafish nr1d4a and nr1d4b, performed sequence alignment and phynogenetic analyses, and characterized the expression patterns and their transcriptional responses to several environmental stresses by using real time quantitative RT-PCR (qPCR). The results indicated that zebrafish nr1d4a and nr1d4b genes are paralogs generated by genomic duplication. The DNA binding domain and ligand binding domain of these two paralogs are highly conserved, but these genes possess distinct expression patterns. The abundance of nr1d4a mRNA was quite low during the early stages of embryogenesis and markedly increased at 72hpf; however, nr1d4b was found to be maternally expressed and the mRNA abundance decreased at 6hpf and significantly increased at 72hpf as well. As for tissue-specific expression, the highest expression of zebrafish nr1d4a was found in brain and kidney, followed by gill, ovary, testis and eye, and liver was the organ with the lowest expression. The highest abundance of nr1d4b mRNA was found in ovary, followed by testis and brain, and the lowest expression was found in intestine and heart. The expression of both nr1d4a and nr1d4b could be induced by multiple environmental stresses. The up-regulation of zebrafish nr1d4a and nr1d4b could be detected at as early as 0.5h after exposed to cold stress (16℃). However, the inductive effect of cold stress decreased and gradually disappeared after 6h of exposure. In addition to cold stress, the expression of zebrafish nr1d4a and nr1d4b was also induced by heavy metal (2 μmol/L cadmium), hypoxia (5% oxygen) and salinity (5‰), indicating the involvement of these genes in the acclimation to various environmental stresses. Thus, these findings have laid the foundation for further investigation of nr1d4a and nr1d4b functions and mechanisms underlying the regulation of their expression in fish.
Zebrafish; Nuclear receptor; Environmental stresses; Gene expression
Q78
A
1000-3207(2014)01-0100-08
10.7541/2014.13
2012-10-16;
2013-09-12
国家自然科学基金项目(31101892)资助
杨玲(1986—), 女, 河南信阳人;硕士研究生; 研究方向为遗传学。E-mail: yangling_19860105@126.com
鲍传和, E-mail: baochh1202@ahau.edu.cn; 崔宗斌, E-mail: zbcui@ihb.ac.cn

