太平洋鳕染色体核型及银染分析
范 瑞 姜志强 李雅娟 高小强 钱 聪 高 敏
(大连海洋大学农业部北方海水增养殖重点实验室, 大连 116023)
近年来, 由于我国海水鱼类资源过度利用以及环境污染等问题, 加快了海水鱼类资源的衰退,再加上近亲繁殖严重, 遗传多样性降低, 造成了一系列种质退化现象, 因此, 鱼类种质资源的开发及改良尤为重要。太平洋鳕(Gadus macrocephalus)又名大头鳕, 隶属鳕形目、鳕科、鳕属(Gadus), 属冷水性底层鱼类, 分布于太平洋北部沿岸海域, 从北太平洋西南部的黄海, 经韩国至白令海峡和阿留申群岛一带沿海, 我国太平洋鳕主要产于黄海, 最高年产量达到2.6×107kg, 是我国北方乃至世界的重要海洋经济鱼类之一。太平洋鳕具有很高的经济价值, 它的蛋白质含量高, 脂肪含量低, 其肉质白细鲜嫩, 清口不腻, 世界上不少国家把鳕鱼作为主要食用鱼类[1]。除鲜食外, 还加工成各种水产食品,此外鳕鱼肝大而且含油量高, 含丰富的维生素 A和 D, 是提取鱼肝油的原料。另外, 太平洋鳕生长温度低, 耐严寒, 生长耗能少, 对于弥补我国北方冬季深水网箱养殖种类缺乏及室内工厂化养殖品种的选择提供了新的思路, 但是由于近年来太平洋鳕过度捕捞、环境污染严重、产卵地的破坏等使其产量大幅度降低, 严重威胁了其种群资源。因此,积极开展太平洋鳕的人工育苗与养殖对太平洋鳕种质资源的恢复及北方深水网箱的有效利用具有重大意义。目前, 国外对同属大西洋鳕研究的较多,Ghigliotti, et al.[2]研究表明大西洋鳕核型为16m/sm+30st/t, 且通过荧光免疫杂交技术对染色体上18S和5S rDNA进行了定位研究, 为大西洋鳕遗传图谱的建立奠定了基础。Ghigliotti, et al.[3]通过静水压方法成功诱导了大西洋鳕雌核发育二倍体, 并进一步完善了大西洋鳕全雌化理论和性别决定机制。而有关太平洋鳕的研究主要集中在种群分布[4,5]、繁殖生物学[6,7]、早期发育[8]以及遗传多样性[9]等方面, 在细胞遗传学特别是染色体核型研究还较少, 而在国内关于太平洋鳕的研究也只是在繁殖及早期胁迫研究等方面, 如姜志强等[10]对大连海域太平洋鳕的繁殖力、卵径分布、性腺指数和肝指数进行周年调查, 充分阐述了太平洋鳕不同发育阶段性腺发育特点和营养来源; 王伟等[11]对不同温度胁迫下太平洋鳕仔稚鱼成活率及生理生化进行了研究, 结果表明培育温度为 8℃时, 仔稚鱼成活率最高, 15℃时最低, 且体内抗氧化还原酶系在温度胁迫下最先表现出变化, 其他方面几乎为空白。因此, 在本研究中, 作者对大连海域的太平洋鳕染色体核型进行了比较分析, 以期了解其遗传背景, 为开展太平洋鳕的人工育苗提供细胞遗传学参数, 也为其种群恢复、种质资源的开发、遗传育种及演化地位提供理论依据。
1 材料与方法
1.1 实验材料
实验用鱼采自辽宁省大连市黑石礁海区, 为性腺发育成熟的野生太平洋鳕, 共5尾(3♂, 2♀), 体质量为(520—990) g。活体运至实验室放置于 14℃海水充气暂养。
1.2 染色体的制备
样本前处理 参照林义浩[12]PHA直接注射法制备染色体标本。实验前一天注射PHA(6 μg/g鱼体重), 18h后, 第二次注射PHA剂量同上, 5h后活体腹腔注射0.1%秋水仙素(6 µg/g鱼体重)。
肾悬浮液的制备 注射秋水仙素2.5h后实验鱼断尾放血15min, 取头肾置于生理盐水中多次冲洗, 弃去组织碎块并剪碎, 用纱布过滤细胞悬液至离心管中, 1500 r/min离心5min, 用生理盐水洗涤细胞2次, 再用0.075 mol/L 的KCl溶液于低渗处理30min, 最后用新鲜配制的卡诺氏液(甲醇︰冰醋酸=3︰1 v/v)固定3次, 每次15min。
制片 采用冷滴片法制片, 空气干燥过夜。完全干燥的染色体玻片用pH为6.8的磷酸缓冲液配置的体积分数为10%的Giemsa染色液染色45min,自然干燥后显微镜观察拍照。
核型分析 选取图像清晰、染色体分散较好的中期分裂相计数以确定染色体数目, 并选出10个染色体分散良好、形态清晰、长度适中的中期分裂相在油镜下进行显微照相、放大、测量、统计, 根据 Levan, et al.[13]的标准进行分类、配对和核型分析。染色体相对长度计算公式: 染色体相对长度=(实测长度/全部染色体长度总和)×100。
1.3 Ag-NORs显带
参照Howell, et al.[14]的快速银染法略加修改。将 50% AgNO3溶液与 2% 明胶溶液(内含 1%甲酸)以2︰1比例混合后, 立即均匀滴加到染色体标本上,加盖玻片; 70 ℃处理2—5min。当整张玻片呈棕黄色时取出, 用70℃蒸馏水冲去盖玻片, 干燥后镜检。
2 结果
2.1 太平洋鳕体细胞染色体数目
本实验对137个分散良好、染色体形态清晰的中期分裂相进行计数。结果表明, 染色体数目为 46的分裂相最多, 有94个, 占68.61%(表1), 由此可确定太平洋鳕二倍体染色体众数为46, 即2n=46。
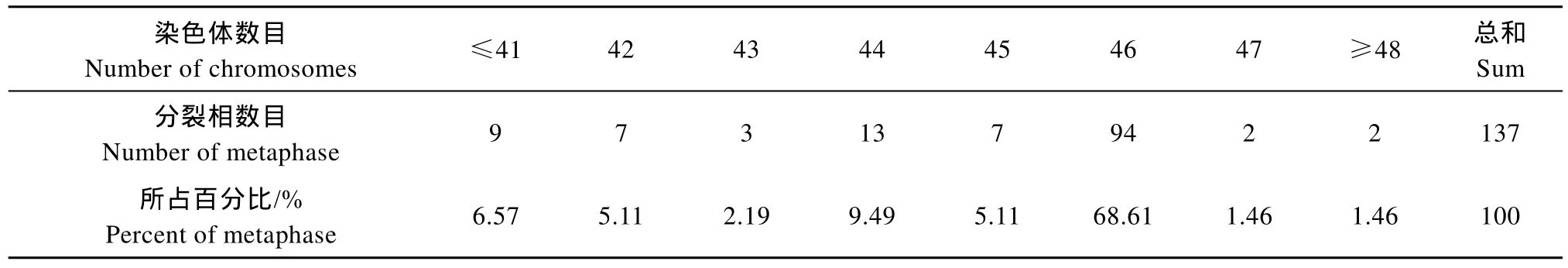
表1 太平洋鳕染色体中期分裂相的统计结果Tab. 1 Chromosome numbers of Gadus macrocephalus
2.2 染色体核型
选择分散良好, 形态清晰, 数目完整的染色体中期分裂相进行显微拍照, 测量其染色体臂长, 计算出染色体相对长度, 臂比并统计染色体类型。结果分析表明, 太平洋鳕染色体核型公式为:2n=8m+6sm+20st+12t, NF=60, 即有 4对中部着丝点染色体(m)、3对亚中部着丝点染色体(sm)、10对亚端部着丝点染色体(st)和 6对端部着丝点染色体(t), 染色体臂数(NF)为60 (图 1、图2)。在进行了显微拍照的染色体中期分裂相中, 太平洋鳕染色体的大小差异较大, 最大染色体相对长度为6.53±0.11, 最小染色体相对长度为 2.37±0.03, 在第 12对染色体中有 l个亚端部着丝点染色体带有明显的次缢痕。雌鱼与雄鱼的染色体核型无明显差异, 未发现与性别相关的异型染色体。染色体核型分析数据见表2。
2.2 Ag-NORs带型
太平洋鳕银染位点清晰可见, 对中期分裂相 85个, 间期核 50个进行了统计分析, 太平洋鳕Ag-NORs的数目为1—3, 在不同细胞中表现出多态性且各种数目的 Ag-NORs出现的频率差异性较大;在间期核中, 具有 2个银染位点的比列最高, 占总个数的82%, 1个银染位点其次, 占总个数的12%, 3个银染位点的最少为6%。在分裂期, 具有1个银染位点的占87.1%, 具有2个银染位点的占12.9%。在多数中期分裂相中, 第12对同源染色体的一条近着丝粒次缢痕区具有明显的银染位点, 并没有发现Ag-NORs联合现象。
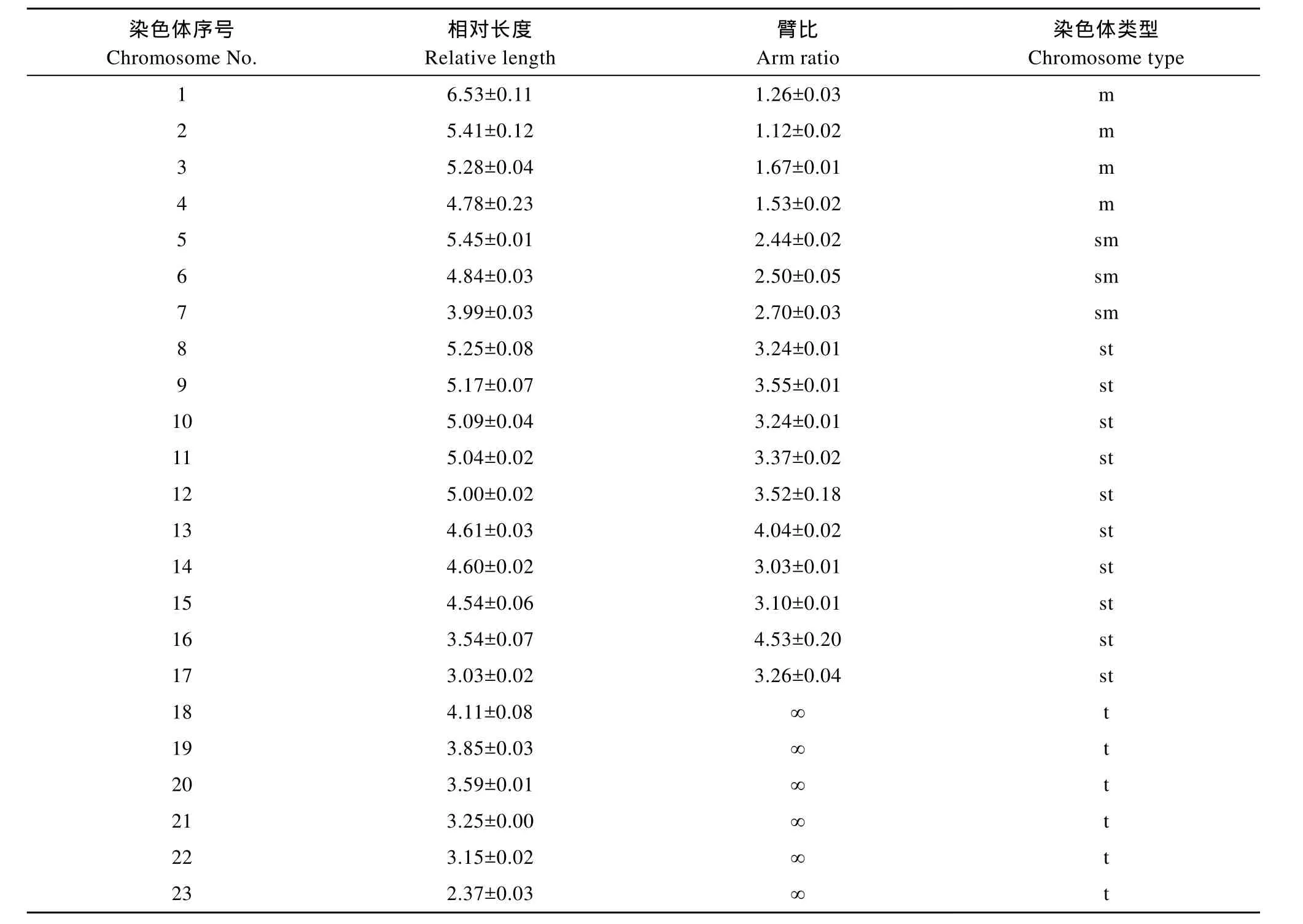
表2 太平洋鳕各染色体的相对长度和臂比值Tab. 2 The relative length and arm ratio of chromosomes of Gadus macrocephalus
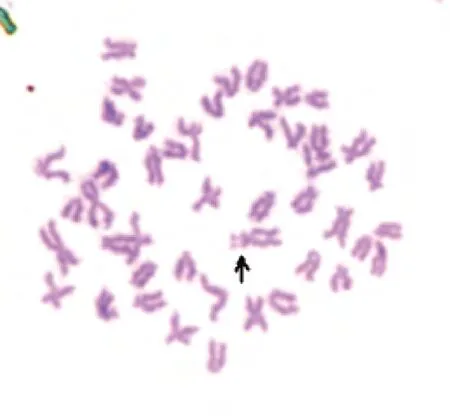
图1 太平洋鳕染色体中期分裂相(箭头示次缢痕)Fig. 1 Metaphase chromosomes of Gadus macrocephalus

图2 太平洋鳕染色体核型分析Fig. 2 Karyotype of Gadus macrocephalus
3 讨论
染色体作为遗传信息的载体, 对生物的进化、变异和生存都至关重要。在脊椎动物中, 开展鱼类染色体的研究不仅仅对认识和探索鱼类的分类系统、进化关系及染色体演化过程具有重要意义, 还可为鱼类遗传育种提供细胞遗传学依据[6,16]。到目前为止, 已报道染色体核型的鳕科鱼类8种(包括本研究在内), 隶属于5个属。由表3可知, 鳕形目鳕科鱼类二倍体染色体数差异性较大(2n=26-48), 核型组成中中部和亚中部染色体相对较多, 核型变化呈现多态性, 且不具与性别相关的异型染色体。Klinkhardt对鳕科鱼类的研究表明, 鳕科各属之间核型的高度多变性, 这暗示了染色体臂间倒位和罗伯逊易位可能是该类群鱼类核型进化的主要机制[17]。Caputo, et al.[18]研究表明形目鱼类染色体数目及臂数的减少与染色体串联融合具有直接关系。由此可知, 鳕科各属鱼类二倍体染色体数目差异及核型的多样性主要是染色体发生了不同程度的变异所导致的, 即染色体结构在进化上发生了较大变化, 表现出不保守性。
很多研究表明鱼类的进化程度与染色体有一定的关系。周暾[19]、小岛吉雄[20]等均认为在鱼类系统进化上越是处于上位, 染色体越收敛, 端部着丝点染色体多, 中部和亚中部染色体少或缺。如石斑鱼亚科种类染色体大多数为端位着丝点染色体, 染色体臂数少, 典型的高位类鱼类[21]。宽突鳕属和平头鳕属鱼类具有较多的中部或亚中部着丝粒染色体,端部着丝粒染色体少, 因此, 在鱼类系统演化上应属于低位类群, 而其他鳕属鱼类均正好相反, 则属于中高位类群; 也有研究表明[22], 在特定的分类类群中, 具有较多端部或亚端部着丝粒染色体的种类为原始类群, 而具有较多中部或亚中部着丝粒染色体的是特化类群, 即染色体臂数多的类群比染色体臂数少的类群更为特化。鳕属中太平洋鳕和大西洋鳕具有相同的染色体数目, 但太平洋鳕具有相对较多端部或亚端部着丝粒染色体, 且染色体臂数相对少, 属于鳕属的原始类型, 应该是鳕属鱼类演化过程中较早出现的鱼类。 宽突鳕属的细身宽突鳕和宽突鳕在核型和染色体数目相一致, 说明了种间进化的保守性和分类地位的一致性; 青鳕和绿青鳕虽然属于同一属, 但染色体数目、核型及臂数均不相同,主要是两个种群在进化过程中染色体发生了易位、倒位等重组现象, 表现出了染色体的多态性。

表3 十种鳕科鱼类的染色体特征Tab. 3 Chromosome characteristics of 10 species in genus Gadidae
本实验中太平洋鳕核型为 2n=46, 8m+6ms+20st+12t, NF=60, Ghigliotti, et al.[2]研究的同属种大西洋鳕 2n=46, 16m/sm+30st/t, NF=62, 两者具有相同的染色体数目, 1对较大的中部着丝点染色体, 且均未发现有性别相关的异染色体, 核型组成上存在一定的差异。毛连菊等[25]研究表明, 鱼类染色体臂间倒位可以使端部或亚端部着丝点染色体变为中部或亚中部着丝点染色体, 只改变染色体形态及总臂数, 不改变染色体数目。因此, 太平洋鳕和大西洋鳕核型的差异可能是发生了染色体臂间倒位。王祖熊等研究表明, 鱼类杂交育种中核型越相近, 杂交越能成功[26], 可见, 此研究对太平洋鳕与同属的大西洋鳕的杂交育种提供了理论依据, 为种质资源的开发提供了新的方向。
Ag-NORs的数目、分布及形态特征是物种亲缘关系和染色体进化的指标, 且Ag-NORs通常分布在染色体次缢痕和随体区域[27,28], 有研究也指出, 核仁组织区是染色体上与核仁形成有关的区域, 位于染色体的次缢痕部位, 次缢痕是染色体上的一个缢缩的部位, 是核仁组织区所在的位置, 每种生物的染色体组中一般至少有一条或一对染色体上有次缢痕, 它可作为鉴定某条染色体的标志[29,30]。在本实验中, 太平洋鳕第12对同源染色体中有l个亚端部着丝点染色体带有明显的次缢痕, 且次缢痕的大小、形态及位置与Ag-NORs的分析结果相吻合, 可见, 次缢痕所在的位置即为核仁组织区。有些鱼类在中期分裂相中, Ag-NORs仅出现在同源染色体之中的一条上, 称之为NORs的活性异形(NOR activity heteromorphism)[31,32]。在本实验中, 太平洋鳕大多数分裂期的同源染色体仅一条短臂末端发现了银染位点, 与上述结论相一致, 可见太平洋鳕的同源染色体表现出了 NORs活性异形现象, 这也说明了在细胞有丝分裂过程中, 太平洋鳕染色体上的rRNA基因转录活性存在着差异性。
本实验也经过不断地摸索最终解决了太平洋鳕染色体制备过程中剂量和时间等问题, 得出最佳PHA处理剂量为6 µg/g, 作用时间两次, 一共 23h,秋水仙素剂量为6 µg/g, 作用时间为2.5h时能获得大量的中期分裂相。
迄今, 对于鳕形目鱼类细胞遗传学研究仍旧相当匮乏, 对鳕鱼资源的开发仍有很大空间, 本文结果的提出为其他鳕科鱼的核型分析及系统进化提供了理论依据, 也为太平洋鳕人工繁育、遗传育种及种质资源的保护开发奠定了基础。

