鸭绿江唇仔、稚鱼形态发育与早期生长
杨培民 骆小年 金广海 刘义新 李敬伟 李 军
(辽宁省淡水水产科学研究院, 辽宁省水生动物病害防治重点实验室, 辽阳 111000)
杨培民 骆小年 金广海 刘义新 李敬伟 李 军
(辽宁省淡水水产科学研究院, 辽宁省水生动物病害防治重点实验室, 辽阳 111000)
通过观察、拍照和测量的方法对鸭绿江唇(Hemibarbus labeo)仔、稚鱼的形态发育和早期生长进行了研究。结果表明: 在19.6—25.8℃的试验条件下, 唇初孵化仔鱼全长为(7.92±0.29) mm, 2日龄头部两侧出现感觉芽; 3日龄鳔一室原基形成, 5日龄红色的脾出现, 且仔鱼开口; 7日龄卵黄囊吸收完毕, 9日龄脊索末端开始向上弯曲; 10日龄鳔二室形成, 14日龄脊索弯曲完成, 尾鳍边缘开始内凹; 32日龄鳞片开始出现在鳃盖后缘的体表, 同时各鳍发育完全, 个体发育进入稚鱼期, 43日龄全身被鳞, 个体发育进入幼鱼期。根据卵黄囊、脊索和鳞片的变化, 唇胚后发育可细分为卵黄囊期(0—6日龄)、弯曲前期(7—9日龄)、弯曲期(10—14日龄)、弯曲后期(15—32日龄)和稚鱼期(33—43日龄)。试验期间, 全长和体质量的特定生长率分别为3.32%和12.16%; 卵黄囊体积(V)与日龄(d)的关系为V=0.0048d3–0.0309d2–0.1240d+0.8453 (R2=0.8933); 全长(LT)、体质量(W)与日龄均为指数函数关系, 相关方程分别为: LT=8.3821e0.0329d(R2=0.9586), W= 0.0048e0.0969d(R2=0.9463); 头长(LH)、体高(HB)的生长方程分别为: LH= –6E–05d3+ 0.002d2+ 0.1733d + 0.7862 (R2= 0.9577), HB= –5E–05d3+ 0.0039d2+ 0.017d + 0.9389 (R2= 0.9621)。
鸭绿江唇; 仔鱼; 稚鱼; 形态发育; 早期生长
1 材料与方法
1.1 受精卵的来源、孵化与仔鱼饲养
亲鱼来源于鸭绿江, 全长 31—44 cm;体重620—1208 g。试验受精卵置于塑料箱(50 cm×35 cm× 40 cm)内, 微充气孵化。仔鱼5日龄时投以轮虫作为开口饵料, 6日龄时另添加枝角类和桡足类, 10日龄时饵料完全过渡为枝角类和桡足类, 饵料密度控制在3—10 ind./mL; 22日龄时开始以水丝蚓替代部分枝角类和桡足类, 25日龄时饵料完全过渡为水丝蚓,水丝蚓每天投喂一次, 投喂量以第二次投喂时仍有少量剩余为标准(饵料转化见图1)。试验期间及时清理粪便、残饵, 且每天换水一次, 每次 1/3, 孵化和饲养期间的水温保持在19.6—25.8℃范围内。
1.2 实验方法
仔鱼孵出后, 每天 8:00取不少于 20尾仔稚鱼于培养皿中, 置于显微镜(SMART-TR, 重庆奥特)和体视显微镜(SZ66, 重庆奥特)下进行活体观察和拍照。以台微尺为参照物配合图像处理软件(Adobe Photoshop 7.0)测量全长(LT)、头长(LH)和体高(HB), 各形态性状的定义参照马境等[13]。体质量(W)用分析天平(FA2004, 上海上平)每两天测量一次, 精确至0.0001g。仔、稚鱼形态发育参照Kendall, et al.[14]划分为不同的阶段, 以60%以上的观察个体出现阶段性特征时作为该发育阶段的起始时间。
1.3 数据处理
采用SPSS 13.0计算各测量参数的平均值和标准差; 体质量、全长的生长曲线以及卵黄囊体积变化采用 Origin 7.5拟合并作图; 头长和体高的生长曲线采用 EXCEL2003拟合及作图, 以决定系数 R2最大或残差平方和最小为拟合标准。卵黄囊体积(mm3)计算公式为V=πRr2/6(R为卵黄囊长径, r为卵黄囊短径); 其他参数计算公式为:
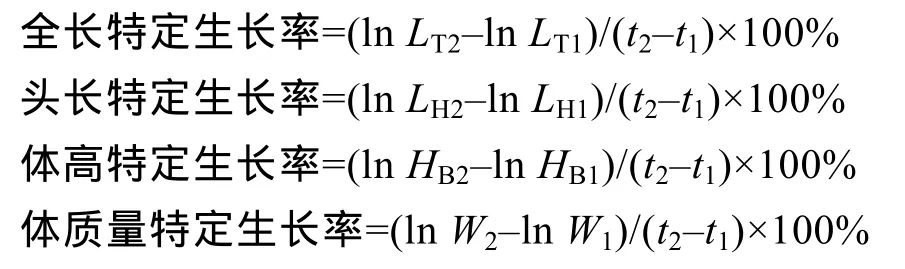
式中: t1、t2为日龄; LT1、LT2分别为t1、t2时的全长; LH1、LH2分别为t1、t2时的头长; HB1、HB2分别为t1、t2时的体高; W1、W2分别为t1、t2时的体质量。
2 结果
2.1 形态发育
试验期间水温为(23.26±1.84)℃。根据外部形态、器官的发育变化, 唇的早期发育过程可以分为仔鱼期(0—32d)和稚鱼期(33—43d)。仔鱼期根据卵黄囊的存在与否和脊索的弯曲程度又可分为卵黄囊期仔鱼(0—6d)、弯曲前期(7—9d)、弯曲期 (10—14d)、 弯 曲 后 期(15—32d)4个时期(图1)。
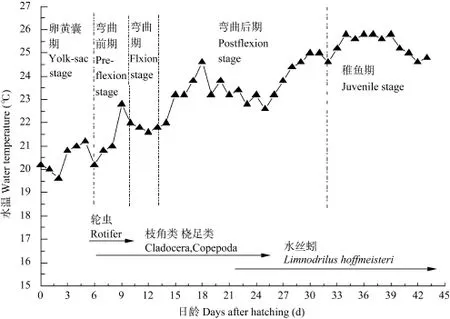
图1 试验期间的水温变化和投喂策略Fig. 1 Daily change on water temperature and feeding method from hatching until day 43
卵黄囊期(从孵化出膜至卵黄囊消失, 0—6 d) 0d: 全长(7.92±0.29) mm。变幅为 7.64— 8.28 mm; 头长 (1.06±0.08) mm, 变幅为 0.97—1.15 mm; 体高 (1.22±0.10) mm, 变幅为1.11—1.35 mm。躯体半透明, 大部分由透明膜状鳍褶包裹; 卵黄囊前端膨大钝圆, 后端细长呈棒状, 有枝状黑色色素分布, 长径 (4.14±0.09) mm, 短径 (0.62±0.05) mm;肌节 42对左右, 呈“V”形(图版Ⅰ-1); 心脏呈囊状,红色血细胞流动明显, 口凹可见, 但上下颌未分离;耳石、肛凹和胸鳍原基明显(图版Ⅱ-1)。初孵仔鱼侧卧水底, 无明显运动。
2d: 全长 (8.37±0.19) mm, 变幅为7.96—8.60 mm;头长 (1.20±0.07) mm, 变幅为1.12—1.26 mm; 体高(1.09±0.13) mm, 变幅为1.07—1.36 mm。卵黄囊颜色变淡, 其形状变为棒状, 长径为 (4.03±0.08) mm,短径为 (0.52±0.06) mm; 尾柄的腹侧可见有小而密的黑色放射状色素; 卵黄囊与脊索交接处的血液流动明显; 上下颌分离, 鳃盖形成, 鳃弧可见(图版Ⅰ-2); 靠头部端的消化道开始膨大分化, 略呈黄色(图版Ⅱ-2), 头部有少量感觉芽出现(图版Ⅱ-3)。此时, 仔鱼常匍匐于背光区域, 受刺激时可以做短促快速游动。
3d: 全长 (8.76±0.13) mm, 变幅为8.54—8.89 mm;头长 (1.42±0.07) mm, 变幅为1.30—1.50 mm; 体高(1.03±0.06) mm, 变幅为1.00—1.09 mm。卵黄囊呈长梨状, 长径减至(3.97±0.10) mm, 短径减至(0.38±0.05) mm, 颜色变淡, 其腹侧的黑色放射状色素增多; 鳔一室原基形成, 尾鳍上分化出辐射状弹性丝(图版Ⅰ-3); 头部感觉芽增多(图版Ⅱ-4), 体侧开始出现感觉芽(图版Ⅱ-5)。
5d: 全长 (9.18±0.61) mm, 变幅为8.81—9.85 mm;头长 (1.73±0.12) mm, 变幅为1.54—1.91 mm; 体高(1.12±0.09) mm, 变幅为1.00—1.29 mm。卵黄囊的形状变得不规则, 长径为 (3.33±0.53) mm, 短径为(0.16±0.05) mm; 鳔一室充气膨大呈椭圆形, 背部鳍褶分化形成背鳍原基; 仔鱼开口摄食, 肠道蠕动明显其内可见未消化完的轮虫卵(图版Ⅰ-4); 鳔斜下方出现一红色的脾, 消化道出现褶皱(图版Ⅱ-6)。此时, 仔鱼可进行平游活动。
6d: 全长(9.30±0.32) mm, 变幅为8.20—9.99 mm;头长 (1.78±0.12) mm, 变幅为1.58—2.09 mm; 体高(1.11±0.08) mm, 变幅为1.00—1.25 mm。卵黄囊吸收 80%左右, 颜色近透明, 仅在腹部有少量剩余,长短径分别为 (2.37±0.79) mm和 (0.13±0.04) mm;头部黑色色素和黄色色素增多, 躯体两侧的脊椎区域有点状黑色色素呈线状分布, 尾柄腹侧的黑色素扩散延伸成带状(图版Ⅰ-5)。仔鱼游动和摄食能力增强, 部分仔鱼可捕食个体相对较大的晶囊轮虫。
弯曲前期(卵黄囊消失至脊索末端呈直线形, 7—9d) 7d: 全长 (9.54±0.25) mm, 变幅为 9.11—9.88 mm; 头长 (1.98±0.05) mm, 变幅为1.87—2.03 mm;体高 (1.15±0.07) mm, 变幅为1.02—1.22 mm。卵黄囊吸收完毕, 眼后缘的头部点状黑色素变大呈斑状;鳃盖将鳃耙完全覆盖, 肠道内食物量增加; 背鳍与尾鳍间的鳍褶收缩变小, 胸鳍和尾鳍有少量鳍条出现(图版Ⅰ-6)。
9d: 全长(10.26±0.65) mm, 变幅为 9.52—11.18 mm; 头长(2.25±0.16) mm, 变幅为2.03—2.44 mm;体高(1.27±0.13) mm, 变幅为1.06—1.44 mm。眼后缘的头部稍向上隆起, 鳔一室呈长椭圆形, 脊索末端稍向上弯曲(图版Ⅰ-7); 尾鳍脊索末端的基部可见3—4枚尾下骨(图版Ⅱ-7)。
弯曲期(脊索末端开始向上弯曲, 尾下骨出现, 后缘与脊索倾斜, 10—14d) 10d: 全长(10.90±0.56) mm,变幅为9.52—11.55 mm; 头长 (2.41±0.21) mm, 变幅为1.94—2.80 mm; 体高 (1.38±0.14) mm, 变幅为1.02—1.53 mm。鳔二室开始出现, 脾位于两鳔之间;尾鳍鳍条数18条左右, 脊索末端明显向上弯曲, 臀鳍鳍芽形成, 背鳍出现4—6条鳍条(图版Ⅰ-8)。
14d: 全长(13.07±0.53) mm, 变幅为 12.26—13.77 mm; 头长 (3.45±0.21) mm, 变幅为 3.03—3.70 mm; 体高 (1.78±0.07) mm, 变幅为1.66—1.90 mm。鳔二室充气膨大; 尾鳍鳍条开始分节, 其边缘形成内凹。脊索末端与尾下骨垂直, 脾变得模糊而不宜观察, 肌节由“V”形变为“W”形(图版Ⅰ-9)。
弯曲后期 (尾下骨与脊索末端垂直, 15—31d) 18d: 全长 (15.93±0.66) mm, 变幅为14.73—16.75 mm;头长 (4.36±0.25) mm, 变幅为3.85—4.67mm; 体高(2.40±0.14) mm, 变幅为2.19—2.60 mm。仔鱼头部呈黄色, 晶体外周的虹膜开始有白色色素形成; 腹部鳍褶缩小, 腹鳍鳍条出现; 臀鳍发育完成, 胸鳍后缘的体表有银色反光物质生成(图版Ⅰ-10); 此时, 90% 仔鱼伏底躲避在水底的遮蔽物下, 白天少有活动, 夜间觅食旺盛。
22d: 全长(19.15±0.96) mm, 变幅为 17.94—20.45 mm; 头长 (5.21±0.46) mm, 变幅为4.77—5.94 mm;体高 (2.91±0.23) mm, 变幅为2.65—3.18 mm。各鳍条全部长出, 背鳍、臀鳍和腹鳍软条数分别为9、8和7; 银色反光物质覆盖整个体腔, 鳔仅能观察到轮廓;各鳍基部和尾柄腹侧均有点状的黑色素分布(图版Ⅰ-11); 此时, 仔鱼口裂变大, 可以摄食水丝蚓。
31d: 全长 (24.41±1.65) mm, 变幅为 21.13—27.48 mm; 头长 (6.06±0.41) mm, 变幅为5.64—6.70 mm;体高 (3.67±0.23) mm, 变幅为3.33—4.17 mm。仔鱼躯体肌肉增加明显, 腹部鳍褶完全消失; 银色反光物质覆盖范围开始向尾部延伸, 脏器、脊椎和肋骨不宜识别(图版Ⅰ-12); 背部具黑色斑点, 分布在背鳍左右两侧(图版Ⅱ-8)。
稚鱼期(各鳍条初步形成, 鳞片开始出现至全身被鳞 32—43 d) 32d: 全长(24.47±1.52) mm, 变幅为22.07—27.09 mm; 头长(6.42±0.47) mm, 变幅为 5.68—7.11 mm; 体高 (3.89±0.23) mm, 变幅为3.47—4.18 mm。鳃盖后缘和胸鳍基部的体表开始出现少量鳞片(图版1-13)。刚形成的鳞片钝圆形, 分前后区: 前区为2—3道不闭合的鳞纹, 后区边缘呈波纹状, 鳞焦尚未形成, 辐射沟3条左右(图版Ⅱ-9)。
34d: 全长(24.50±1.42) mm, 变幅为 22.61—26.81 mm; 头长 (6.53±0.29) mm, 变幅为 5.57—6.41 mm; 体高 (3.87±0.25) mm, 变幅为3.66—4.36 mm。脊椎骨以下区域的体表均具有金属光泽, 鳞被向腹部扩散, 同时尾柄两侧开始出现鳞片; 头部、背部、各鳍基部及尾柄腹的黑色素聚集形成黑色斑点(图版Ⅰ-14)。
43d: 全长 (33.08±1.58) mm, 变幅为 32.11—35.88 mm; 头长 (7.80±0.49) mm, 变幅为 7.16—8.40 mm; 体高 (5.64±0.19) mm, 变幅为5.40—5.86 mm。稚鱼除头部外全身被鳞, 肌肉部分呈沙棕色(图版Ⅰ-15)。体侧和头部感觉芽仍可见, 大小有所变短(图版Ⅱ-10、11), 由顶面观, 眼后缘的头部略带红色,躯体颜色变深且透明度降低(图版Ⅱ-12)。个体发育由此进入幼鱼阶段。
2.2 卵黄囊的吸收
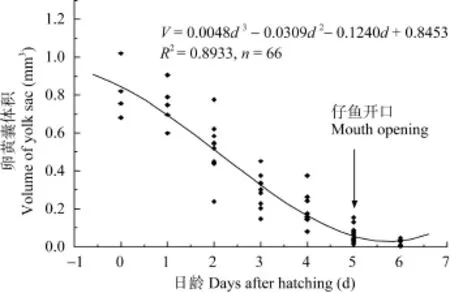
图2 唇仔鱼卵黄囊吸收过程Fig. 2 Exhaustion of yolk sac of H. labeo
2.3 早期生长
通过计算可知, 试验期间仔稚鱼全长和体质量特定生长率分别3.32%和12.16%。各参数的特定生长率整体呈先增后减的趋势, 其中全长、头长和体高的特定生长率最高值出现在弯曲期, 体重特定生长律最高值出现在弯曲后期; 仔鱼期各测量参数的特定生长律均大于稚鱼期的对应值(表1)。唇仔稚鱼全长、体质量随日龄的变化规律分别如图3所示,全长、体质量随日龄的变化均呈指数函数增长, 关系 式 分 别 为 : LT=8.3821e0.0329d(R2=0.9586), W= 0.0048e0.0969d(R2=0.9463)。头长、体高与日龄的相关方程分别为: LH= –6E–05d3+ 0.002d2+ 0.1733d + 0.7862(R2= 0.9577), HB= –5E–05d3+ 0.0039d2+ 0.017d + 0.9389 (R2= 0.9621)(图4)。
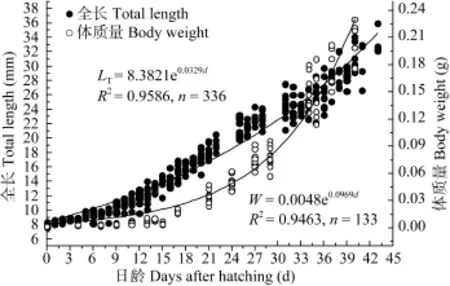
图3 唇仔稚鱼全长和体质量的早期生长Fig. 3 Growth in total length and body weight of H. labeo from hatching until day 43
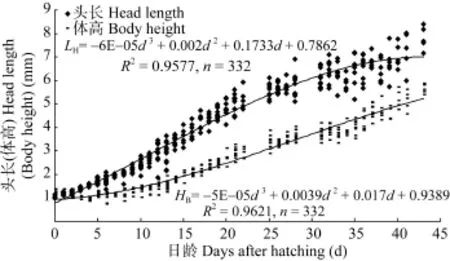
图4 唇仔稚鱼头长和体高的生长Fig. 4 Growth in head length and body height of H. labeo from hatching until day 43
表1 鸭绿江唇仔、稚鱼期不同发育阶段的特定生长率Tab. 1 Special growth rate at different development stage of larval and juvenile H. labeo collected from Yalü River
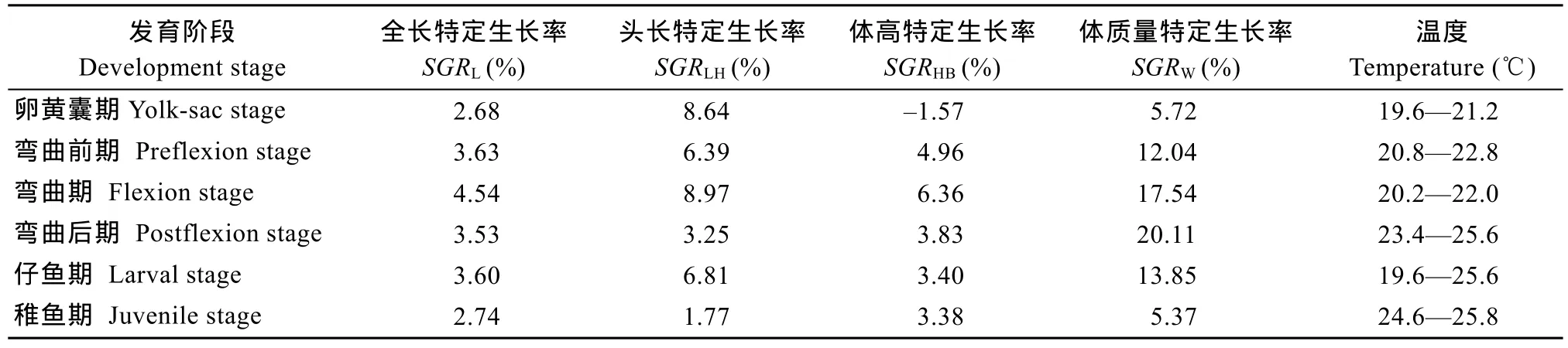
表1 鸭绿江唇仔、稚鱼期不同发育阶段的特定生长率Tab. 1 Special growth rate at different development stage of larval and juvenile H. labeo collected from Yalü River
发育阶段Development stage全长特定生长率SGRL(%)头长特定生长率SGRLH(%)体高特定生长率SGRHB(%)体质量特定生长率SGRW(%)温度Temperature ( )℃卵黄囊期Yolk-sac stage 2.68 8.64 –1.57 5.72 19.6—21.2弯曲前期 Preflexion stage 3.63 6.39 4.96 12.04 20.8—22.8弯曲期 Flexion stage 4.54 8.97 6.36 17.54 20.2—22.0弯曲后期 Postflexion stage 3.53 3.25 3.83 20.11 23.4—25.6仔鱼期 Larval stage 3.60 6.81 3.40 13.85 19.6—25.6稚鱼期 Juvenile stage 2.74 1.77 3.38 5.37 24.6—25.8
3 讨论
研究表明, 鳔的充气通常是在卵黄即将吸收完毕和外源摄食开始的时候进行[15]。鸭绿江唇仔鱼5日龄时鳔一室充气, 同时开口摄食, 开口时间与吕伟志和李东占[6]报道的一致, 但比花(H.maculatus)仔鱼 52h破膜[16]、3d开口[17]的报道要晚。唇鳔充气和开口几乎同时出现, 有利于减少摄食时的运动耗能, 是鱼类在长期进化过程中适应自然环境提高后代成活率的一种生存策略;鸭绿江唇仔鱼的卵黄囊在7日龄时完全吸收, 比瓯江唇[10](H. labeo)(6d, 19—23 ℃ )、 日本(H. barbus)(5d)和长吻(H. longirostris)(5d)[18]要晚,而与花[16](H. maculatus)(7d, 20 ℃ )卵 黄囊吸收时间一致, 这表明同属鱼类卵黄囊吸收的快慢存在种间差异, 同种间也因孵化因子的不同而有所不同。在本研究中唇从开口摄食至卵黄囊完全消失的混合营养期仅有 2d, 比花(H. maculatus)[17](4d, 20 ℃ )要 短, 鸭绿江唇在自然条件下繁殖温度要低于本研究的试验温度, 因此其在自然环境下混合营养期可能略长。混合营养期是鱼类早期发育阶段一个重大的临界期, 仔鱼成活率的高低与仔鱼能否顺利开口摄食密切相关, 因此苗种培育须在仔鱼开口时及时投喂合适的饵料, 以免发生仔鱼消瘦甚至死亡现象。
3.2 感觉芽和脾
鱼类早期生活阶段的感觉芽 (Sensor bud)又被称为游离神经丘 (Free neuromasts), 主要用于感知水流和与视觉协同用于捕食[20]。乔晔[21]研究表明, 唇仔鱼全长9.4 mm时头部及体表出现感觉芽, 全长19.8 mm时感觉芽消失。与上述研究结果不同, 本研究发现仔鱼2日龄即全长 (8.37±0.19) mm时, 头部出现少量的感觉芽, 3日龄时除头部外, 体侧开始长有感觉芽; 43日龄时全长 (33.08±1.58) mm, 鱼体的头部及体侧仍有感觉芽分布, 但感觉芽大小变短, 数量变少。Kawamura[22]认为硬骨鱼类仔鱼随生长的延续, 一部分感觉芽掩埋于皮肤下面形成带孔的侧线管(Lateral line canals), 一部分存在于表皮上形成陷器(Pit organ)。因此, 笔者推测唇的感觉芽应在侧线系统发育完全之后消失。此外, 在解剖镜下唇仔稚鱼的感觉芽比较明显; 自然光下唇体修长, 眼球外突, 体侧具有蓝色光泽; 苗种培育过程中可依此形态特征与同期繁殖的麦穗鱼(Pseudorasbora parva)进行区别。
鱼类的脾是存储和生成红细胞的器官[23]。在本研究中唇仔鱼的脾呈红色团状, 5日龄时出现在鳔前端的斜下方, 唇脾在形态上与青 鳉 (Oryzias latipes)[24]和葛氏鲈塘鳢(Perccottus glenii)[25]相近, 在位置上则与后两种鱼有所不同。在脾出现时间上, 唇比青 鳉 (O. latipes) (8d, 25—27℃)[24]和塞内加尔鳎(Solea senegalensis) (6d)[26]要晚, 但是早于葛氏鲈塘鳢(P. glenii) (1d, 12—26℃)[25], 这可能与种属特异性和培育温度有关。Voskoboinikova 和 Pavlov[25]在葛氏鲈塘鳢(P. glenii)上研究发现, 脾与鳔的充气有关,就唇而言是否也有相似功能还有待研究。
[1] Xie Y H, Li W K, Xie H. Freshwater Fisheries in Northeast Region of China [M]. Shenyang: Liaoning Science and Technology Press. 2007, 148 [解玉浩, 李文宽, 解涵. 东北地区淡水鱼类. 沈阳: 辽宁科学技术出版社. 2007, 148]
[2] Gan G M, Zhang S G, Zhang X F, et al. Cytological studies on fertilization in Hemibarbus labeo [J]. Acta Hydrobiological Sinica, 2006, 30(3): 284—291 [甘光明, 张耀光,张贤芳, 等. 唇受精的细胞学研究. 水生生物学报, 2006, 30(3): 284—291]
[3] Li J, Luo X N, Li J W, et al. Evaluation of nutritive quality and nutrient components in the muscle of Hemibarbus labeo Pallas [J]. Journal of Shenyang Agricultural University, 2011, 42(1): 59—64 [李军, 骆小年, 李敬伟, 等. 鸭绿江水系唇肌肉营养成分与品质的评价. 沈阳农业大学学报, 2011, 42(1): 59—64]
[4] Xu W, Li C T, Geng L W, et al. Growth and reproduction of reared Hemibarbus labeo in Wusuli River [J]. Journal of Fishery Science of China, 2009, 16(4): 550—555 [徐伟, 李池陶, 耿龙武, 等. 乌苏里江唇的全人工繁育. 中国水产科学, 2009, 16(4): 550—555]
[5] Feng X Y, Yang Z J, Guo S R, et al. Artificial reproduction and fry culture of Hemibarbus labeo [J]. Freshwater Fisheries, 2006, 24(2): 225—231 [冯晓宇, 杨仲景, 郭水荣, 等.唇人工繁殖和鱼苗培育初步, 淡水渔业, 2006, 24(2): 225—231]
[6] Lü W Z, Li D Z. Artificial reproduction technology of Hemibarbus labeo in Yalu River [J]. Hebei Fisheries, 2009, 8: 36—37 [吕伟志, 李东占. 鸭绿江流域重唇鱼人工繁殖技术. 河北渔业, 2009, 8: 36—37]
[7] Luo X N, Li J, Xia D M, et al. The artificial propagation of skin carp Hemibarbus labeo [J]. Chinese Journal of Fisheries, 2011, 2: 9—12 [骆小年, 李军, 夏大明, 等. 唇人工繁殖试验. 水产学杂志, 2011, 2: 9—12]
[8] He J S, He X F, Yan T M. Observation on the embryonic development of Hemibarbus labeo (Pallas) in lower reaches of Fujiang River [J]. Journal of Southwest China Normal University (Natural Science), 1999, 24(2): 225—231 [贺吉胜, 何学福, 严太明. 涪江下游唇胚胎发育研究. 西南师范大学学报, 1999, 24(2): 225—231]
[9] Luo X N, Li J, Liu G, et al. Embryonic development, experimental starvation, and the point of no return of Hemibarbus labeo in Yalü River [J]. Journal of Fishery Science of China, 2011, 18(6): 1278—1285 [骆小年, 李军,刘刚, 等. 鸭绿江水系唇胚胎发育、仔鱼饥饿及其不可逆点. 中国水产科学, 2011, 18(6): 1278—1285]
[10] Yao Z L, Li L, Mi G Q, et al. The early morphological development of Hemibarbus labeo in Oujiang River [J]. Fisheries Science, 2008, 27(3): 121—124 [姚子亮, 李黎,宓国强, 等. 瓯江产唇的早期形态发育研究. 水产科学, 2008, 27(3): 121—124]
[11] Lü Y P, Hu Z H, Ye L P. Application of RAPD makers in stock identification of Hemibarbus labeo and Hemibarbus maculates [J]. Journal of Zhejiang University (Science Edition), 2008, 35(3): 324—329 [吕耀平, 胡则辉, 叶丽平. RAPD标记在唇与花种质鉴定中的应用. 浙江大学学报(理学版), 2008, 35(3): 324—329]
[12] Xu W, Li C T, Cao D C. Preliminary study on oxygen consumption rate and suffocation point of Hemibarbus laboe in Wusulijiang River [J]. Journal of Guangdong Ocean Universty, 2007, 27(3): 11—15 [徐伟, 李池陶, 曹顶臣. 乌苏里江唇耗氧率和窒息点的初步研究. 广东海洋大学学报, 2007, 27(3): 11—15]
[13] Ma J, Zhang L Z, Zhuang P, et al. Development and allometric growth patters of larval Acipenser schrenckii [J]. Chinese Journal of Applied Ecology, 2007, 18(12): 2875—2882 [马境, 章龙珍, 庄平, 等. 施氏鲟仔鱼发育及异速生长模型. 应用生态学报, 2007, 18(12): 2875—2882]
[14] Kendall A J, Ahistrom E H, Moser H G. Early life stages of fishes and their characters [A]. In: Moser H G, Richards W J, Cohen D M, et al. (Eds), Ontogeny and systematics of fishes. Special Publication 1 [C]. American Society of Ichthyologists and Herpetologists, Lawrence, KS. 1984, 11—22
[15] Men Q, Lei J L, Wu Y F. Influence of abnormal development of swimbladder on the larvae rearing of marine fish [J]. Marine Fishery Research, 2003, 24(1): 80—84 [门强, 雷霁霖, 武云飞. 鳔器官的发育对人工培育鱼苗影响.海洋水产研究, 2003, 24(1): 80—84]
[16] Wang D, Zhao X L, Wang X G, et al. Preliminary study on embryonic and larval development of Hemibarbus maculates Bieeker [J]. Chinese Journal of Fisheries, 2008, 21(1): 1—8 [王丹, 赵晓临, 王晓光, 等. 花胚胎和仔鱼发育的初步研究. 水产学杂志, 2008, 21(1): 1—8]
[17] Gu R B, Wen H B, Xu G C, et al. Preliminary observation on the embryonic development and morphological of the yolk-sac larva of Hemibarbus maculates Bieeker [J]. Journal of Zhejiang Ocean University (Natural Science), 2006, 25(4): 373—378 [顾若波, 闻海波, 徐钢春, 等. 花胚胎发育及卵黄囊仔鱼形态的初步观察. 浙江海洋学院学报(自然科学版), 2006, 25(4): 373—378]
[18] Kawanabe H, Mizuno N. Freshwater Fish of Japan [M]. Tokyo: Jama to Keikoku-sha. 1989, 322—327
[19] Wang J Q, Zhao X W. Fish Culture and Propagation [M]. Dalian: Dalian University of Technology Press, 2000, 203 [王吉桥, 赵兴文. 鱼类增养殖学. 大连: 大连理工大学出版社. 2000, 203]
[20] Iwai T. On the free neuromasts of some teleost larvae [J]. Japanese Journal of Icthyology, 1972, 19: 307—311
[21] Qiao Y. Early morphogenesis and species identification of fishes in Yangtze River [D]. Thesis for Doctor of Science.Institute of Hydrobiology, Chinese Academy of Sciences, Beijing, 2005 [乔晔. 长江鱼类早期形态发育与种类鉴别.北京: 中国科学院研究院(水生生物研究所), 2005]
[22] Kawamura G. The sense organs and behaviors of milkfish fry in relation to collection techniques [C]. In: Juario J V, Ferraris R P, Benitez L V (Eds.), Advances in milkfish biology and culture: Proceedings of the Second International Milkfish Aquaculture Conference, 4—8 October 1983, Iloilo City, Philippines. (pp. 69—84). Metro Manila, Philippines: Published by Island Pub. House in association with the Aquaculture Department, Southeast Asian Fisheries Development Center and the International Development Research Centre
[23] Wells R M G, Weber R E. The spleen in hypoxic and exercised rainbow trout [J]. Journal of Experiment Biology, 1990, 150: 461—466
[24] Iwamatsu T. Stages of normal development in the medaka Oryzias latipes [J]. Mechanisms of Development, 2004, 121: 605—618
[25] Voskoboinikova O S, Pavlov D A. Larval Development of the Amur Sleeper Perccottus glenii (Perciformes, Gobioidei, Odontobutidae) and the Origin of Fish of the Suborder Gobioidei [J]. Journal of Ichthyology, 2006, 46: 788—802
[26] Cunha Castro M, Rodrigues P, Soares F, et al. Development of the immune system and use of immunostimulants in Senegalese sole (Solea senegalensis) [A]. In: Browman H I and Skiftesvik A B (Eds.), The Big Fish Bang. Proceeding of the 26th Annual Larval Fish Conference [C]. Published by the institute of marine research, Bergen, Norway, 2003, 189—192
[27] Yin M C. Advance and studies of early life history of fish [J]. Journal of Fisheries of China, 1991, 15(4): 348—358 [殷名称. 鱼类早期生活史研究与其进展. 水产学报, 1991, 15(4): 348—358]
[28] Shi Z H, Peng S M, Luo H Z, et al. Feeding habits and growth performance of larvae and juvenile of Paralichthys olivaceus under rearing conditions [J]. Journal of Shanghai Fisheries University, 2007, 16(6): 566—572 [施兆鸿, 彭士明, 罗海忠, 等. 人工育苗条件下舟山牙鲆仔稚鱼的摄食与生长.上海水产大学学报, 2007, 16(6): 566—572]
[29] Zhang Y Z, Xie Y J, Zhang W S. Feeding habits and growth of Plectorhynchus cinctus in early development stage [J]. Journal of Oceanography in Taiwan Strait, 2000, 19(1): 27—35 [张雅芝, 谢仰杰, 张文生. 花尾胡椒鲷早期发育阶段的摄食与生长特性. 台湾海峡, 2000, 19(1): 27—35]
[30] Farris D A. A change in the early growth rate of four larval marine fishes [J]. Limnol Oceanogr, 1959, 4: 29—36
MORPHOLOGICAL DEVELOPMENT AND EARLY GROWTH ON LARVAE AND JUVENILES OF HEMIBARBUS LABEO IN YALÜ RIVER
YANG Pei-Min, LUO Xiao-Nian, JIN Guang-Hai, LIU Yi-Xin, LI Jing-Wei and LI Jun
(Liaoning Key Laboratory for Prevention and Treatment of Aquatic Animal Diseases, Freshwater Fisheries Research Academy of Liaoning Province, Liaoyang 111000, China)
We studied the morphological development and early growth of larval and juvenile Hemibarbus labeo in Yalü River from hatching till 43 days. The newly hatched larvae were (7.92±0.29) mm under the temperature of 19.6—25.8 . ℃Sensor buds were differentiated on both sides of the head 2 days after hatching (DAH) and posterior swim bladder anlage appeared on Day 3 after hatching (AH). Initial feeding appeared on Day 5 AH along with the appearance of spleen and the complete absorption of yolk sphere on Day 7 AH. The caudal tip of the notochord started to curve upward on Day 9 AH, followed by the anterior swim bladder appearance on Day 10 AH. For 14-day-old larva, the caudal folk formed and the notochord stopped curving upward. Scales were found to be appeared at the back of the operculum and all fins were well-developed on Day 32 AH that the larvae reached the juvenile stage. The entire body was covered by the scales on Day 43 AH while the fry reached the young stage. Based on morphological changes in yolk sphere, notochord, and scale, the post-embryonic development of H. labeo can be classified into 5 stages: the yolk-sac stage (0—6 DAH), the preflexion stage (7—9 DAH), the fexion stage (10—14 DAH), the post flexion stage (15—32 DAH), and the juvenile stage (33—43 DAH). From hatching till Day 43 AH, the special growth rate of total length and body weight was 3.32% and 12.16%, respectively. The absorption of yolk sphere can be calculated through the equation: V=0.0048d3–0.0309d2–0.1240d+0.8453 (R2=0.8933); where V =yolk-sac volume in mm3and d = age in days. The appropriate equations for growth in the total length (LT) and body weight (W) of larval and juvenile H. labeo were as follows: LT=8.3821e0.0329d(R2=0.9586), and W=0.0048e0.0969d(R2=0.9463). In addition, the head length (LH) and body height (HB) can be calculated by the following equations: LH= –6E–05d3+0.002d2+0.1733d+0.7862 (R2=0.9577) and HB= –5E–05d3+ 0.0039d2+ 0.017d + 0.9389 (R2= 0.9621), respectively.
Hemibarbus labeo; Larvae; Juvenile; Morphological development; Early growth
S965.1
A
1000-3207(2014)01-0001-09

图版Ⅰ 鸭绿江唇仔、稚鱼形态发育
PlateⅠ Morphological development on larvae and juveniles of Hemibarbus labeo in Yalü River
1. 刚出膜仔鱼; 2. 2日龄仔鱼; 3. 3日龄仔鱼; 4. 5日龄仔鱼,箭头示未消化的轮虫卵; 5. 6日龄仔鱼; 6. 7日龄仔鱼; 7. 9日龄仔鱼; 8. 10日龄仔鱼; 9. 14日龄仔鱼; 10. 18日龄仔鱼; 11. 22日龄仔鱼; 12. 31日龄仔鱼; 13. 32日龄稚鱼; 14. 39日龄稚鱼; 15. 43日龄稚鱼. 图中比例尺代表1 mm
1. Newly hatched larva; 2. 2-day old larva; 3. 3-day old larva; 4. 5-day old larva, arrow indicating indigested rotatoria egg; 5. 6-day old larva; 6. 7-day old larva; 8. 10-day old larva; 9. 14-day old larva; 10. 18-day old larva; 11. 22-day old larva; 12. 31-day old larva; 13. 32-day old juvenile; 14. 39-day old juvenile; 15. 43-day old juvenile. Scale bar=1 mm
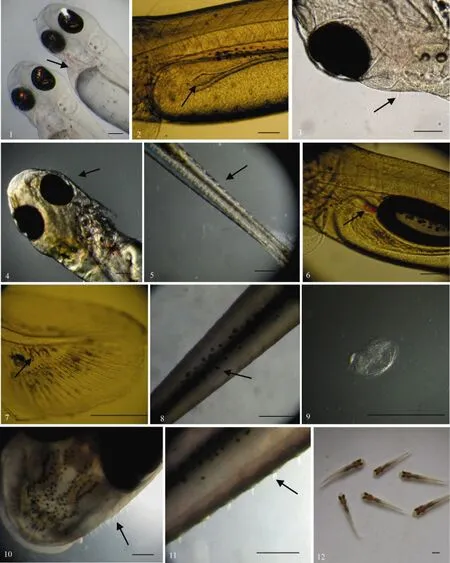
图版Ⅱ 鸭绿江唇仔、稚鱼局部特征
Plate Ⅱ Local character on larvae and juveniles of Hemibarbus labeo in Yalü River
1. 初孵仔鱼的心脏, 箭头示心脏; 2. 2日龄仔鱼的消化道, 箭头示消化道; 3. 2日龄仔鱼的头部, 箭头示感觉芽; 4. 3日龄仔鱼的头部,箭头示感觉芽 5. 3日龄仔鱼的躯干, 箭头示感觉芽; 6. 3日龄仔鱼的脾, 箭头示脾; 7. 9日龄仔鱼的尾部, 箭头是尾下骨; 8. 31日龄仔鱼的背部, 箭头示斑点; 9. 32日龄稚鱼的鳞片; 10. 43日龄稚鱼的头部, 箭头示感觉芽; 11. 43 日龄稚鱼的躯干, 箭头示感觉芽; 12. 43日龄稚鱼的顶面观; 图中比例尺代表200 μm
1. Heart of n ewly hatched larva, arrow indicating heart; 2. Intestine of 2-day old larva, arrow indicating intestine; 3. Head of 2-day old larva, arrow indicating sensor bud; 4. Head of 3-day old larva, arrow indicating sensor bud; 5. Trunk of 3-day old larva, arrow indicating sensor bud; 6. Spleen of 3-day old larva, arrow indicating spleen; 7. Caudal fin of 9-day old larva, arrow indicating hypural; 8. Top view of 31-day old larva, arrow indicating spot; 9. Newly born scale in 32-day old juvenile; 10. Head of 43-day old juvenile, arrow indicating sensor bud; 11. Trunk of 43-day old juvenile, arrow indicating sensor bud; 12. Top view of 43-day old juvenile. Scale bar=200 μm
10.7541/2014.01
2012-08-13;
2013-01-08
辽宁省重大、重点项目“渔业新品种引进、开发” (2008203001)资助
杨培民(1979—), 男, 山东聊城人; 高级工程师; 研究方向为鱼类繁养殖与遗传育种。E-mail:pmyang313@163.com
骆小年(1975—),男, 湖北蕲春人; 研究员; 研究方向为鱼类遗传育种与增养殖。E-mail: luo2989_cn@sina.com

