斜带石斑鱼MyD88基因的原核表达及蛋白纯化
韦友传孙宝宝陆专灵高 谦罗廷荣
(1. 广西大学动物科学技术学院, 南宁 530004; 2. 中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室, 武汉 430072)
斜带石斑鱼MyD88基因的原核表达及蛋白纯化
韦友传1,2孙宝宝1陆专灵1高 谦2罗廷荣1
(1. 广西大学动物科学技术学院, 南宁 530004; 2. 中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室, 武汉 430072)
Toll样受体(Toll-like receptor, TLR)是一类重要的模式识别受体, 其胞外结构域可识别特定的病原相关分子模式(Pathogen-associated molecular patterns, PAMPs), 胞内的 TIR (Toll-like/IL-1 receptor)结构域则参与启动胞内信号转导, 诱导细胞产生活性氧中间体(Reactive oxygen intermediate)、活性氮中间体(Reactive nitrogen intermediate)和促炎症因子, 在感染早期发挥重要作用[1]。在哺乳动物中, 髓样分化因子 88(Myeloid differentiation factor 88, MyD88)是TLR信号通路的关键接头分子, 其C端TIR域与TLR的TIR相互结合后, 通过募集IL-1受体相关激酶(Interleukin-1 receptor-associated kinase, IRAK)IRAK4、IRAK1和IRAK2, 激活NF-κB和MAPK, 进而诱导IL-1、TNF和IFN等细胞因子表达[2—4]。
迄今为止, 有关鱼类MyD88分子的报道主要涉及基因克隆和表达调节研究。已有的研究显示, 人工感染迟钝爱德华氏菌(Edwardsiella tarda)的牙鲆(Paralichthys olivaceus), 其头肾和脾脏中MyD88表达阳性细胞显著增多[5]; 用灭活的副溶血弧菌(Vibrio parahaemolyticus)刺激大黄鱼(Pseudosciaena crocea), 其免疫器官 MyD88的表达水平显著上调[6], 灭活的鳗弧菌(Vibrio anguillarum)刺激半滑舌鳎(Cynoglossus semilaevis), 也得到类似结果[7];应用PolyI∶C和鞭毛蛋白刺激虹鳟(Oncorhynchus mykiss)头肾细胞, MyD88表达上调[8]。Skjaeveland, et al.的研究显示, 用 CpG ODN 处理转染大西洋鲑(Salmo salar) MyD88基因的哺乳动物细胞, 可激活 NF-κB表达[9]。此前, 我们已克隆到斜带石斑鱼(Epinephelus coioides)的TLR1、TLR2及MyD88基因, 分析了它们的表达模式及其表达调节[10,11]。本研究旨在原核表达并纯化斜带石斑鱼MyD88重组蛋白, 为研究和解析斜带石斑鱼MyD88生物学功能与鱼类TLR信号转导通路奠定基础。
1 材料与方法
1.1 斜带石斑鱼MyD88基因原核表达载体的构建
根据斜带石斑鱼MyD88 cDNA序列(GenBank登录号: HQ197956), 设计特异性引物 MyD88-F1: 5'-CTGTCGTC TCCGGAAACTCTCCAAC-3'和 MyD88-R1: 5'-TGGTCC TTGGTTACGGCAGCGAGA-3', 以斜带石斑鱼脾脏cDNA为模板, 扩增包含MyD88开放阅读框的序列片段。25 μL体系PCR反应条件为: 94 ℃ 4 min; 94 ℃ 3 0s 、63 ℃ 3 0s、72 ℃60s, 35个循环; 72 ℃ 1 0min 。琼脂糖凝胶电泳, 回收纯化目的片段, 连接 pMD18-T载体, 转化 TOP10感受态细胞, PCR鉴定阳性克隆, 提取重组质粒pMD18T-MyD88-1。
设计带酶切位点的引物 MyD88-F2: 5'-TCGGATCCATGGCGTGTAAGGACCCAGA-3'和MyD88-R2: 5'-TGCTCGAGTCGGCAGCGAGAGCGCCTTG-3', 下划线所示分别为限制性内切酶BamH I和Xho1 I的酶切位点。以pMD18T-MyD88-1为模板, PCR反应条件、目的片段回收、连接、转化和阳性克隆筛选同上。提取重组质粒pMD18T-MyD88-2, 使用 BamH I和 Xhol I分别对pMD18T-MyD88-2和 pET-32a双酶切, 回收酶切片段, 16℃连接过夜, 连接产物转化TOP10细胞。PCR筛选重组克隆, 提取重组原核表达质粒 pET-32a-MyD88, 测序检查有无移码或突变。
1.2 斜带石斑鱼MyD88重组蛋白表达、纯化及免疫印迹检测
将pET-32a-MyD88和作为对照的pET-32a分别转化大肠杆菌BL21 (DE3), 将阳性克隆接种到10 mL含氨苄青霉素(100 μg/mL)的LB培养液中, 37 ℃ 210 r/min 振荡培养至A600达到0.6—0.8, 各取1 mL作为对照。加入IPTG至终浓度1 mmol/L, 37 ℃ 210 r/min诱导培养4h, 4℃离心(5000 g, 5min), 用1/10体积PBS重悬菌体沉淀, 超声破碎, 4℃离心(12000 g, 15min)后分别收集上清和沉淀。
SDS-PAGE蛋白电泳检测后, 将单克隆阳性菌落进行50 mL扩大培养并诱导表达, 4℃离心(5000 g, 5min), 5 mL 1×结合缓冲液(0.5 mol/L NaCl, 20 mmol/L Tris-HCl, 5 mmol/L咪唑, pH 7.9)重悬菌体, 冰浴条件下超声破碎(30min), 4℃离心(12000 g, 15min), 去上清。加入3 mL含6 mol/L尿素的1×结合缓冲液, 重悬沉淀, 冰浴1 h彻底溶解包涵体。4℃离心(12000 g, 30min), 收集上清, 加入到离子化并平衡后的 His-Bind亲和层析柱 (Novagen),以5 mL/h流速过柱; 随后依次用5 mL含6 mol/L尿素的1×结合缓冲液和3 mL含6 mol/L尿素的1×清洗缓冲液(0.5 mol/L NaCl, 20 mmol/L Tris-HCl, 60 mmol/L咪唑, pH 7.9)过柱, 去除非特异性结合蛋白; 用2.5 mL含6 mol/L尿素的洗脱缓冲液 (20 mmol/L Tris-HCl, 0.5 mol/L NaCl, 200 mmol/L咪唑, pH 7.9)进行洗脱。
SDS-PAGE蛋白电泳后, 使用Mini Trans-Blot电转仪,将蛋白转至PVDF膜(80 V, 1h)。TBS溶液(0.1 mol/L NaCl, 0.1 mol/L Tris, pH 7.5)漂洗3次, 5%脱脂奶粉封闭(2h), 与1∶3000稀释的抗6-His单抗室温孵育1h; TBS漂洗3次后加入碱性磷酸酶标记的1∶500稀释的二抗, 室温孵育1h; 反应结束后使用NBT/BCIP避光显色。
2 结果
2.1 斜带石斑鱼MyD88原核表达载体pET-32a-MyD88
通过克隆(pMD18T-MyD88-1)和亚克隆(pMD18TMyD88-2)制备, 使用 BamH I和 Xho1 I对 pMD18TMyD88-2和 pET-32a分别双酶切, 胶回收 MyD88和pET-32a片段, 连接、转化, 提取获得重组表达质粒pET-32a-MyD88。PCR鉴定结果以及BamH I与Xhol I双酶切得到的900 bp和5800 bp的两个片段, 均与预期一致。测序结果表明插入的斜带石斑鱼MyD88基因表达框无移码或突变。
2.2 斜带石斑鱼MyD88的重组表达与纯化的融合蛋白
将pET32a-MyD88转化到大肠杆菌BL21 (DE3), 与诱导前相比, 经IPTG诱导后, SDS-PAGE电泳图谱中明显新增约53 kD的蛋白条带, 与推测的融合蛋白分子量相当, 而转入空质粒pET32a的阴性对照在诱导前后均未见相应的蛋白条带(图1)。可溶性分析显示融合蛋白以包涵体形式表达。用6 mol/L尿素溶解包涵体, 经His-Bind亲和层析柱纯化, 电泳结果显示洗脱液中蛋白纯度较高,纯化蛋白的分子量与预计相符(图1)。
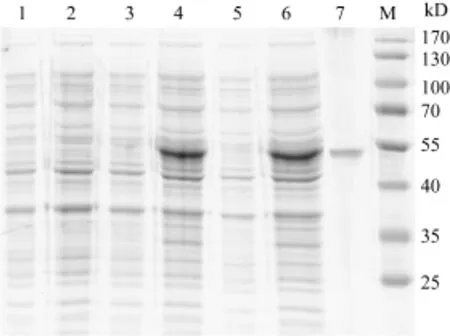
图1 MyD88重组蛋白表达的特异性与可溶性分析Fig. 1 Expression specificity and dissolubility of the recombinant MyD88 protein
2.3 免疫印迹
利用抗 6-His单克隆抗体及相应二抗, 对含pET32a和 pET32a-MyD88的大肠杆菌 BL21重组菌诱导前后表达的蛋白和纯化的蛋白进行免疫印迹检测,结果显示 pET32a-MyD88重组菌诱导后及纯化洗脱液中均可检测到的分子量约53 kD的蛋白条带(图2), 进一步证实纯化蛋白为含 6-His标签的斜带石斑鱼MyD88融合蛋白。空载体pET32a经诱导表达分子量约为21 kD的标签蛋白。
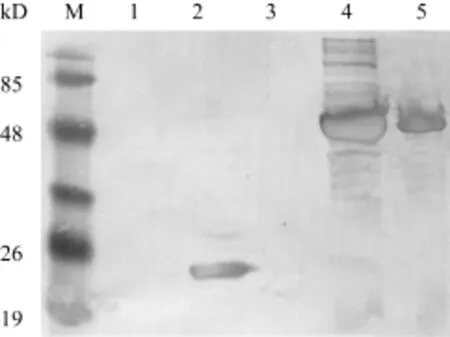
图2 MyD88重组蛋白的免疫印迹检测Fig. 2 Western blot detection of the recombinant MyD88 protein
3 讨论
pET表达系统是功效最强大的重组蛋白原核表达系统之一, 其特点在于由T7强转录翻译信号调控表达框中插入的外源基因表达。宿主菌BL21 (DE3)中的T7 RNA聚合酶在IPTG作用下高效表达, 进而可充分调动宿主菌资源表达目的基因[12,13]。pET-32a融合表达载体秉承了pET可高效表达目的蛋白的特性, 且在目的片段前插入硫氧还蛋白(Trx)基因, 109个氨基酸残基的硫氧还蛋白与目的蛋白融合在一起, 帮助目的蛋白折叠, 增加其可溶性; 在融合蛋白N端还带有6-His标签便于目的蛋白的亲和纯化与鉴定[14,15]。
MyD88属于Toll/IL-1R家族成员, 是TLR信号传导通路中的重要接头分子, 参与除TLR3外所有TLR家族成员的信号传导。本研究通过 RT-PCR扩增斜带石斑鱼MyD88基因ORF序列, 克隆(pMD-18T-MyD88-1)与亚克隆(pMD-18T-MyD88-2)制备, 以及BamH I与Xhol I双酶切, 成功构建了斜带石斑鱼 MyD88原核表达载体pET32a-MyD88。将此表达载体转化大肠杆菌 BL21, 经IPTG诱导表达、亲和层析纯化和免疫印迹检测, 证实本研究构建的重组表达质粒 pET32a-MyD88在大肠杆菌中成功地进行了斜带石斑鱼MyD88融合蛋白的高效表达。所制备的带有 6-His标记的高纯度的斜带石斑鱼 MyD88重组蛋白为后续研究鱼类MyD88在TLR信号转导通路和先天性免疫中的作用奠定了一定基础。
[1] Werling D, Jungi T W. Toll-like receptors linking innate and adaptive immune response [J]. Veterinary Immunology and Immunopathology, 2003, 91(1): 1—12
[2] Sha Z, Abernathy J W, Wang S, et al. NOD-like subfamily of the nucleotide-binding domain and leucine-rich repeat containing family receptors and their expression in channel catfish [J]. Developmental and Comparative Immunology, 2009, 33(9): 991—999
[3] Takeda K, Akira S. Toll-like receptors in innate immunity [J]. International Immunology, 2005, 17(1): 1—14
[4] Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors [J]. Nature Immunology, 2010, 11(5): 373—384
[5] Takano T, Kondo H, Hirono I, et al. Identification and characterization of a myeloid differentiation factor 88 (MyD88) cDNA and gene in Japanese flounder, Paralichthys olivaceus [J]. Developmental and Comparative Immunology, 2006, 30(9): 807—816
[6] Yao C L, Kong P, Wang Z Y, et al. Molecular cloning and expression of MyD88 in large yellow croaker, Pseudosciaena crocea [J]. Fish and Shellfish Immunology, 2009, 26(2): 249—255
[7] Yu Y, Zhong Q W, Zhang Q Q, et al. Full-length sequence and expression analysis of a myeloid differentiation factor 88 (MyD88) in half-smooth tongue sole Cynoglossus semilaevis [J]. International Journal of Immunogenetics, 2009, 36(3): 173—182
[8] Purcell M K, Smith K D, Hood L, et al. Conservation of toll-Like receptor signaling pathways in teleost fish [J]. Comparative Biochemistry and Physiology-Part D: Genomics and Proteomics, 2006, 1(1): 77—88
[9] Skjaeveland I, Iliev D B, Strandskog G, et al. Identification and characterization of TLR8 and MyD88 homologs in Atlantic salmon (Salmo salar) [J]. Developmental and Comparative Immunology, 2009, 33(9): 1011—1017
[10] Wei Y C, Pan T S, Chang M X, et al. Cloning and expression of Toll-like receptors 1 and 2 from a teleost fish, the orangespotted grouper Epinephelus coioides [J]. Veterinary Immunology and Immunopathology, 2011, 141(3-4): 173—182
[11] Wei Y C, Gao Q, Chang M X, et al. Cloning and expression of MyD88 gene in orange-spotted grouper Epinephelus coioides [J]. Genomics and Applied Biology, 2011, 30(3): 288—295 [韦友传, 高谦, 昌鸣先, 等. 斜带石斑鱼MyD88基因的克隆与表达. 基因组学与应用生物学, 2011, 30(3): 288—295]
[12] Yuan L D, Hua Z C. Expression, purification, and characterization of a biologically active bovine enterokinase catalytic subunit in Escherichia coli [J]. Protein Expression and Purification, 2002, 25(2): 300—304
[13] Umeyama T, Naruoka A, Horinouchi S. Genetic and biochemical characterization of a protein phosphatase with dual substrate specificity in Streptomyces coelicolor A3(2) [J]. Gene, 2000, 258(1-2): 55—62
[14] Ribas A V, Ho P L, Tanizaki M M, et al. High-level expression of tetanus toxin fragment C-thioredoxin fusion protein in Escherichia coli [J]. Biotechnology and Applied Biochemistry, 2000, 31( Pt 2): 91—94
[15] Zhao J H, Xu Z, Hua Z C. Expression of human cardiac-specific homeobox protein in Escherichia coli [J]. Protein Expression and Purification, 2000, 18(3): 316—319
PROKARYOTIC EXPRESSION AND PROTEIN PURIFICATION OF THE MYD88 GENE IN GROUPER EPINEPHELUS COIOIDES
WEI You-Chuan1,2, SUN Bao-Bao1, LU Zhuan-Ling1, GAO Qian2and LUO Ting-Rong1
(1. College of Animal Science and Technology, Guangxi University, Nanning 530004, China; 2. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China)
斜带石斑鱼; MyD88; 原核表达; 蛋白纯化
Epinephelus coioides; MyD88; Prokaryotic expression; Protein purification
Q786
A
1000-3207(2014)01-0200-03
10.7541/2014.29
2012-09-28;
2013-07-19
国家重点基础研究发展计划(973)项目(2009CB118703); 国家自然科学基金面上项目(30871937)和广西自然科学基金项目(2012GXNSFAA053045)资助
韦友传(1971—), 男, 广西罗城人; 博士; 研究方向: 水产动物分子免疫学与病原学。E-mail: weiyc@gxu.edu.cn
高谦, E-mail: gaoqian@ihb.ac.cn

