Real-time PCR法用于日本血吸虫感染宿主血清DNA的定量检测及其感染度的评价
官 威,许 静,孙 缓,梁 松,董兰兰,夏超明
诊断在血吸虫病防治工作中对控制及消除传染源发挥关键作用。核酸诊断技术以其特异性强、敏感度高、反应快速,与病原体检测具有同等确诊价值,而成为血吸虫病诊断技术研究的热点之一。本课题组在前期工作中应用PCR、nest-PCR和LAMP法均已在血吸虫感染宿主血清中检测出DNA并具有高度敏感性及特异性,显示出潜在的实际应用价值[1-5]。但是,之前已建立的核酸诊断技术局限于定性检测。定量PCR与普通PCR相比,不仅具有高度的敏感性和特异性[6-7],可定量检测样本[8-13]的DNA水平,对评价血吸虫病感染度、感染宿主血清DNA水平变化具有重要意义。本研究应用前期工作中发现的日本血吸虫高度重复序列SjR2基因作为扩增的靶序列,设计特异性引物和TaqMan探针,建立日本血吸虫TaqMan real-time qPCR,拟通过定量检测日本血吸虫感染家兔血清DNA,确定早期检测的时间节点及其检测阈值,评价感染度,为血吸虫病早期诊断及疗效考核提供新的实验依据。
1 材料和方法
1.1实验动物模型的建立 清洁级新西兰家兔10只,雌性,重量2.0~2.5 kg (苏州大学实验动物中心),随机分为5组,每组两只。经腹部皮下感染日本血吸虫尾蚴,组1:30±2条;组2:50±2条; 组3:100±5条; 组4:200±10条; 组5:500±20条。阳性钉螺购自江苏省血吸虫病防治研究所。
1.2标本的收集 所有家兔在感染前取正常外周血清作为阴性对照。于感染后3 d、感染后1~7周(每周1次)采集各组家兔的外周血清;感染后第7周解剖家兔,收集成虫计数,保存备用。
1.3DNA模板的制备
1.3.1成虫DNA模板的制备 取日本血吸虫雄虫5条,用生理盐水研磨后,加入等体积虫体消化液(0.1 mol/L Tris-HC1、50 mmoL/L EDTA、1% 的SDS、500 μg/mL蛋白酶K,pH8.5),65 ℃下作用1 h,并不时振荡,再用酚氯仿抽提,取上清,用冷无水乙醇沉淀30 min,离心,常温下用75% 的乙醇洗沉淀,弃上清,60 ℃烘箱内干燥10 min,加50 μL TE缓冲液溶解沉淀。
1.3.2血清DNA模板的抽提[14]取感染兔血清200 μL,加入400 μL血清提取缓冲液(0.15 mol/L NaCl、10 mmol/L EDTA、10 mmol/L Tris-HC1、2% 的SDS、5 μg/mL鲑鱼精DNA、250 μg/mL蛋白酶K, pH7.6),55 ℃下消化10 min, 等体积酚氯仿异戊醇(25∶24∶1)抽提两次,12 000 g离心5 min,弃上清,再用氯仿异戊醇(24∶1)抽提,12 000 g离心5 min,弃上清,加入1/10体积NaAc(3 mol/L) 和2倍体积冷无水乙醇,-20 ℃下沉淀30 min,12000 g离心10 min,弃上清,常温下75%乙醇洗沉淀两次,第1次浸泡2 h,第2次浸泡30 min,并不时振荡。12 000 g离心5 min,弃上清,60 ℃温箱干燥10 min,加20 μL TE缓冲液溶解沉淀,4 ℃冰箱内保存。
1.4TaqMan real-time qPCR扩增
1.4.1引物和TaqMan探针设计 引物和探针以陆正贤[15]等报道的日本血吸虫高度重复基因SjR2为靶序列,综合Vector NTI Advance®11.5分析结果设计:上游引物primer F: 5′-CAG GCT TCC TTA GCT ACG ACT CTA G-3′ ,下游引物primer R: 5′-GGA TCC TGT ATA CGC GTT TCA GA-3′ ,探针probe: 5′-FAM-ATC CCG CTC CAT CGA TAT CTG CTG C-3′ TAM。由上海英俊生物技术有限公司合成。
1.4.2Real-time PCR反应体系 反应体积25 μL,包括Platinum®2×PCR SuperMix-UDG (60U/mLTaqDNA聚合酶、40 mmol/L Tris-HCl, pH 8.4、KCl、6 mmol/L MgCl2、400 μmol/L dGTP、400 μmol/L dATP、400 μmol/L dCTP、800 μmol/L dUTP、40 U/mL尿嘧啶DNA转葡糖基酶、稳定剂)、上下游引物和探针各10 μmol/L、50 mmol/L MgCl2、25 μmol/L ROX校对染料(甘氨酸结合的5-羧基-X-罗丹明琥珀酰酯、20 mmol/L Tris-HCl, pH 8.4、0.1 mmol/L EDTA以及 0.01%的 Tween®20),模板4 μL。反应在ABI 7500定量PCR仪上进行:50℃孵育5 min,95 ℃预变性2 min,95 ℃、15 s,60 ℃、1 min, 扩增45个循环。在60℃循环温度末端,每个循环的荧光量被测定。反应数据通过7500 System SDS v1.4.0软件分析。
1.5TaqMan定量PCR特异性和敏感度的评价 引物和探针的特异性通过正常家兔、健康人血清DNA、空白对照(三蒸水)以及其它成虫模板来考核;反应的敏感性以连续10倍稀释的日本血吸虫SjR2基因重组质粒分析。
1.6重组质粒的制备 将PCR产物(77 bp)连接至pMD19-T载体,连接产物热转化至E.coliCompetent Cell JM109中,筛选阳性克隆菌落,提取质粒CTE739,测序。由宝生物工程(大连)有限公司合成。
2 结 果
2.1EPG检测及成虫计数确定家兔感染度 如表1所示,组1平均每只家兔体内检出8条雌虫、9条雄虫,镜检EPG为14;组2平均每只家兔体内检出15条雌虫、19条雄虫, EPG为24;组3平均每只家兔体内检出25条雌虫、43条雄虫, EPG为48;组4平均每只家兔体内检出78条雌虫、81条雄虫, EPG为97;组5平均每只家兔体内检出186条雌虫、194条雄虫, EPG为232。

表1 EPG检测与成虫计数结果
2.2Real-time定量PCR的特异性 实验结果显示,曼氏血吸虫、华支睾吸虫、旋毛虫、卫氏并殖吸虫、正常家兔血清样本、健康人血清样本以及空白对照扩增曲线均在阈值水平以下,只有日本血吸虫扩增曲线在阈值线以上,并呈指数状分布。将以上各样本扩增产物进行2%琼脂糖凝胶电泳,结果显示,只有日本血吸虫泳道出现特异性目的条带(图1)。将日本血吸虫成虫样本的扩增产物进行测序,经BLAST序列比对,同源相似度达到97.4%(75/77)。
2.3Real-time定量PCR的灵敏度 将日本血吸虫SjR2基因重组质粒连续10倍稀释11个梯度,即浓度4.47×100拷贝/μL~4.47×1010拷贝/μL,每个浓度梯度设3个复孔,real-time PCR结果显示,可检测到质粒最小浓度为4.47×10 拷贝/μL,标准曲线回归方程y=-3.0987x + 49.158,相关系数为0.996 5(图2)。
2.4Real-time PCR检测感染兔血清DNA 从组1~组5家兔感染后3 d至7周的外周血清中提取的DNA模板,每份样本3个复孔,real-time定量PCR检测结果分析显示:组1在感染后第2周的血清样本中开始测到目的DNA,浓度为119.03拷贝;组2在感染后第1周的血清样本开始测到目的DNA,浓度为54.36拷贝;组3在感染后第1周的血清样本开始测到目的DNA,浓度为72.24拷贝;组4和组5在感染后第3 d即可检测到目的DNA,浓度分别为60.34和142.47拷贝。表2为不同感染度家兔血清中日本血吸虫DNA的早期检测时间及血清中DNA含量的动态变化。表3为不同感染度家兔血清DNA检测的时间节点及其DNA含量。图3显示的为不同感染度家兔血清DNA动态变化。图4为血吸虫感染家兔血清DNA水平与感染度的相关性。
图1(A)Real-timePCR特异性扩增曲线
(B)Real-timePCR电泳结果
M: 标准marker; 1: 日本血吸虫成虫; 2: 曼氏血吸虫成虫; 3: 华支睾吸虫成虫; 4: 旋毛虫成虫; 5: 卫氏并殖吸虫成虫; 6: 正常家兔血清; 7: 健康人血清; 8: 空白对照
Fig.1(A)Amplificationplotofreal-timePCRforspecificity
(B)Resultsofelectrophoresisforproductsofreal-timePCR
M:Standard marker; 1:S.japonicum;
2:S.mansoni; 3:C.sinensis; 4:T.spiralis;
5:P.westermani; 6: Sera of normal rabbit;
7: Sera of healthy person; 8: Blank control.
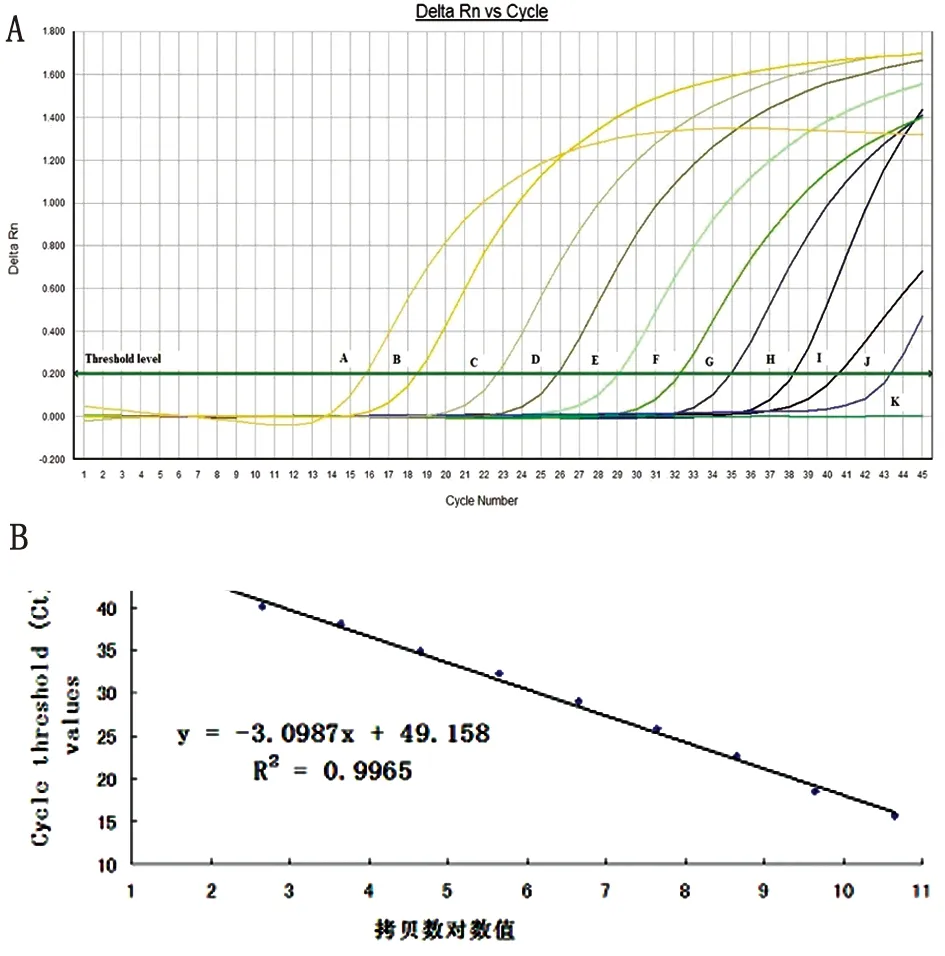
图2(A)Real-timePCR敏感性扩增曲线
A-K分别表示4.47×1010拷贝/μL~4.47×100拷贝/μL 11个10倍连续稀释度的扩增曲线,其中曲线K在阈值线以下;
图2(B)CT值与拷贝数对数值的标准曲线
Fig.2(A)Amplificationplotofreal-timePCRforsensitivity
A-K respectively represent the amplification plot with 10-fold dilution series of plasmid ranging from 4.47×1010-4.47×10copies, the curve of K was below the threshold.
Fig.2(B)StandardcurveforCtvaluesversuslogoftheplasmid
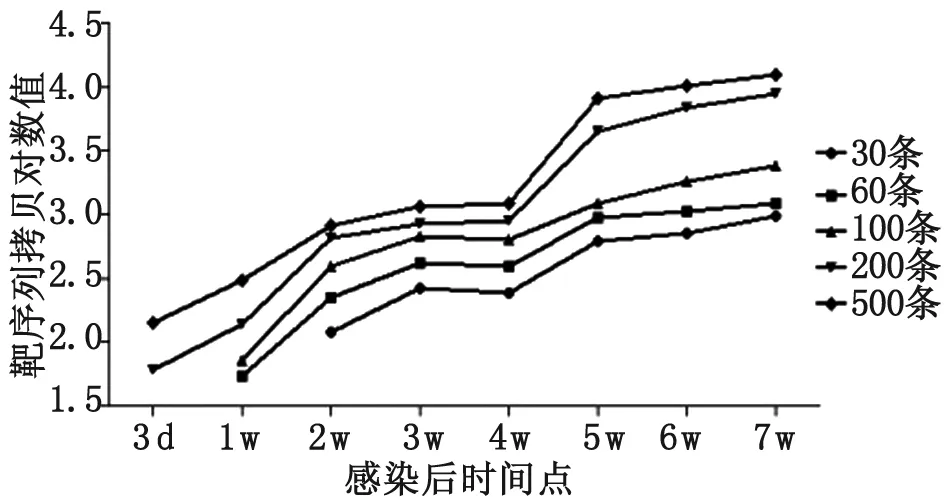
图3组1~组5家兔血清DNA动态变化
Fig.3DynamicchangesoftheserumDNAintherabbitsofgroup1-5
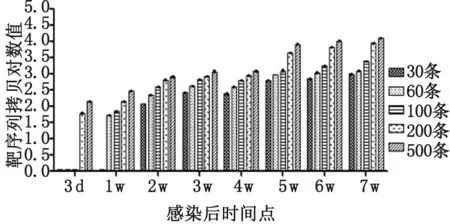
图4家兔血清DNA水平与感染度的相关性
Fig.4CorrelationbetweentheserumDNAofrabbitsandinfectiosity
表2Real-timePCR对不同感染度家兔血清中日本血吸虫DNA的早期检测时间及血清中DNA含量的动态变化
Tab.2TimeofearlydetectionofS.japonicumDNAinseraofrabbitswithdifferentinfectiosityanddynamicchangeofDNAlevelbyreal-timePCR

Group感染后不同时间血清中DNA含量(拷贝)DNA level in sera for different time points post-infection (copies)3 d1 w2 w3 w4 w5 w6 w7 w1119.03268.73245.31623.63707.77979.15254.36226.16414.87392.37959.181 068.261 229.16372.24396.49667.29632.411 213.171 810.612 448.08460.34140.21648.26838.23902.364 524.496 891.738 947.245142.47303.83824.171 152.361 224.088 214.6410 135.4812 414.28
3 讨 论
血吸虫的核酸检测技术已成为近年来血吸虫病诊断研究的热点之一[16-20]。本课题组前期研究结果表明,应用普通PCR法、巢式PCR法和LAMP法在日本血吸虫感染家兔模型的实验研究中具有较好的早期诊断和疗效考核价值[1-5]。但是,以上核酸诊断技术仅限于定性检测,无法评价血吸虫病的感染度,因此,研究血吸虫核酸定量检测技术,对于探索血吸虫感染宿主血清DNA动态变化规律[21],感染度的评价以及早期诊断与疗效考核具有重要意义。
本研究以日本血吸虫高度重复逆转录转座子SjR2的77 bp DNA为靶序列建立Taqman real-time qPCR法,检测靶基因重组质粒DNA的灵敏度为44.7拷贝,与本课题组已报道的来源于SjR2的230 bp靶序列巢式PCR法灵敏度(10.2拷贝)相当。特异性评价发现,该real-time qPCR法仅对日本血吸虫模板有扩增结果,而对曼氏血吸虫、肝吸虫、旋毛虫和肺吸虫的扩增结果均呈阴性。所建立的real-time qPCR法检测感染兔血清血吸虫DNA结果显示,感染后3 d就可以检测到日本血吸虫DNA,各组感染后3 d~7周宿主血清DNA浓度整体上呈上升趋势。由于感染后4周日本血吸虫发育成熟,雌虫大量产卵,感染5周以后的宿主血清DNA主要来源于崩解的虫卵[21],因此,感染5周以后血清DNA浓度明显升高。不同感染度早期检测的时间节点及其检测DNA含量分别为,在感染30条尾蚴家兔需在感染后2周才能检测到目的DNA,其阈值为119.03拷贝,在感染50条尾蚴、100条尾蚴家兔则在感染后1周可检测到目的DNA,其检测DNA量分别为54.36拷贝和72.24拷贝,感染200条尾蚴、500条尾蚴家兔最早在感染后3 d即可检测到目的DNA,其检测DNA量分别为60.34拷贝和142.47拷贝。研究结果显示,宿主血清DNA浓度随感染度的增大而上升,即宿主血清DNA水平与感染度呈正相关。
表3不同感染度家兔血清DNA早期检测时间节点及其DNA含量
Tab.3TimepointofearlydetectionofS.japonicumDNAinseraofrabbitswithdifferentinfectiosityandDNAlevel
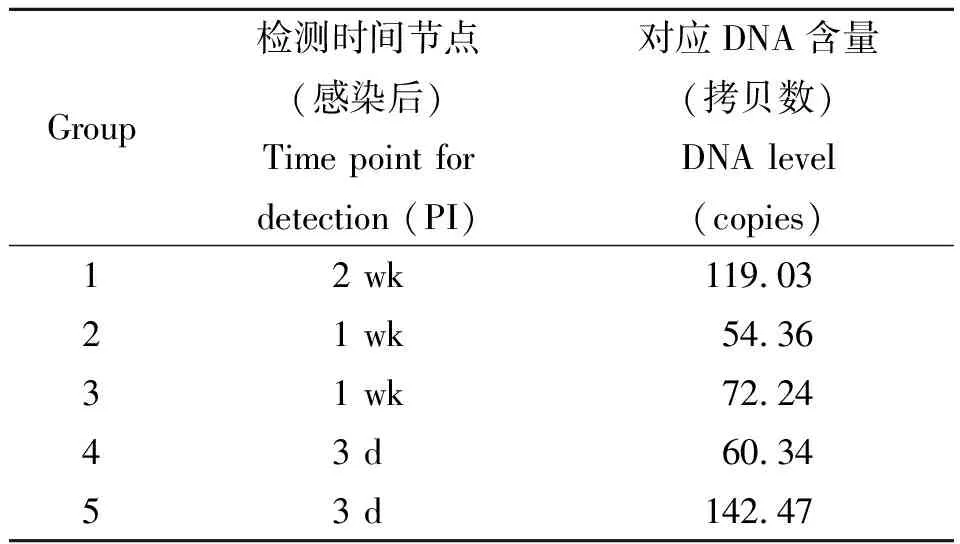
Group检测时间节点(感染后)Time point for detection (PI)对应DNA含量(拷贝数)DNA level (copies)12 wk119.0321 wk54.3631 wk72.2443 d60.3453 d142.47
本研究结果表明,以日本血吸虫高度重复基因SjR2为靶序列的Taqman real-time qPCR法在日本血吸虫感染家兔模型的诊断中显示出了较好的检测敏感性和特异性,并提示日本血吸虫感染宿主血清DNA浓度与感染度呈正相关,可用于评价宿主感染度。
参考文献:
[1]Lu ZX, Xu J, Xia CM, et al. Detection ofSchistosomajaponicumDNA by polymerase chain reaction[J]. Chin J Zoonoses, 2007, 23(5): 479-483. (in Chinese)
陆正贤, 许静, 夏超明, 等. 聚合酶链式反应检测日本血吸虫DNA的实验研究[J]. 中国人兽共患病学报, 2007, 23(5):479-483.
[2]Xia CM, Rong R, Lu ZX, et al.Schistosomajaponicum: a PCR assay for the early detection and evaluation of treatment in a rabbit model[J]. Exp Parasitol, 2009, 121(2): 175-179. DOI: 10.1016/j.exppara.2008.10.017
[3]Liu AP, Yang QL, Xia CM, et al. DNA detection of low-intensitySchistosomajaponicuminfection by nested-PCR assay in serum of host[J]. Suzhou Univ J Med Sci, 2010, 30(5): 915-918. (in Chinese)
刘爱平, 杨巧林, 夏超明,等. 巢式PCR法检测日本血吸虫低感染度宿主血清DNA的研究[J]. 苏州大学学报:医学版, 2010, 30(5): 915-918.
[4]Xu J, Rong R, Zhang HQ, et al. Sensitive and rapid detection ofSchistosomajaponicumDNA by loop-mediated isothermal amplification (LAMP)[J]. Int J Parasitol, 2010, 40(3): 327-331. DOI: 10.1016/j.ijpara.2009.08.010
[5]Guo JJ, Xu J, Xia CM, et al. Sensitive and specific target sequences selected from retrotransposons ofSchistosomajaponicumfor the diagnosis of schistosomiasis[J]. PLoS Negl Trop Dis, 2012, 6(3): e1579.
[6]Alasaada S, Soriguera RC, Abu-Madib M, et al. A TaqMan real-time PCR-based assay for the identification ofFasciolaspp[J]. Vet Parasitol, 2011, 179(1-3): 266-271. DOI: 10.1016/j.vetpar.2011.01.059
[7]Livak KJ, Flood SJ, Marmaro J, et al. Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization[J]. PCR Methods Appl, 1995, 4(6): 357-362.
[8]Rhodes G, Fluri A, Gerber M, et al. Detection ofMycobacteriumimmunogenum by real-time quantitative Taqman PCR[J]. J Microbiol Methods, 2008, 73(3): 266-268. DOI: 10.1016/j.mimet.2008.03.006
[9]Haakensen M, Dobson CM, Deneer H, et al. Real-time PCR detection of bacteria belonging to the Firmicutes Phylum[J]. Int J Food Microbiol, 2008, 125(3): 236-241. DOI: 10.1016/j.ijfoodmicro.2008.04.002
[10]Takács T, Jeney C, Kovács L, et al. Molecular beacon-based real-time PCR method for detection of 15 high-risk and 5 low-risk HPV types[J]. J Virol Methods, 2008, 149(1): 153-162. DOI: 10.1016/j.jviromet.2007.12.009
[11]Venkatesana G, Bhanuprakash V, Balamurugan, V, et al. TaqMan hydrolysis probe based real time PCR for detection and quantitation of camelpox virus in skin scabs[J]. J Virol Methods, 2012, 181(2): 192-196. DOI: 10.1016/j.jviromet.2012.02.002
[12]Lin ZB, Zhang YL, Cao J, et al. Comparison of loop-mediated isothermal amplication (LAMP) and real-time PCR method targeting a 529-bp repeat element for diagnosis of toxoplasmosis[J]. Vet Parasitol, 2012, 185(24): 296-300. DOI: 10.1016/j.vetpar.2011.10.016
[13]Bezerra-Vasconcelos DR, Melo LM, Albuquerque ES, et al. Real-time PCR to assess the Leishmania load in Lutzomyia Longipalpis sandflies: Screening of target genes and assessment of quantitative methods[J]. Exp Parasitol, 2011, 129(3): 234-239. DOI: 10.1016/j.exppara.2011.08.010
[14]Chen YP, Weng XH, Xu ZY, et al. Study on the detection ofSchistosomajaponicumDNA in samples from both schistosomiasis patients and animal models by using PCR[J]. Chin J Infect Dis, 1997, 15(4): 203-206. (in Chinese)
陈一平,翁心华,徐肇玥,等.聚合链反应检测日本血吸虫DNA的探索[J]. 中华传染病杂志,1997,15(4):203-206.
[15]Lu ZX, Xu J, Xia CM, et al. Detection ofSchistosomajaponicumDNA by polymerase chain reaction[J]. Chin J Zoonoses, 2007, 23(5): 479-483. (in Chinese)
陆正贤, 许静, 夏超明, 等. 聚合酶链式反应检测日本血吸虫DNA的实验研究[J]. 中国人兽共患病学报, 2007,23(5):479-483.
[16]Sandoval N, Siles-Lucas M, Pérez-Arellano JL, et al. A new PCR-based approach for the specific amplification of DNA from differentSchistosomaspecies applicable to human urine samples[J]. Parasitology, 2006, 133(Pt 5): 581-587.
[17]Lier T, Johansen MV, Hjelmevoll SO, et al. Real-time PCR for detection of low intensitySchistosomajaponicuminfections in a pig model[J]. Acta Trop, 2008, 105(1): 74-80.
[18]Gordon CA, Gray DJ, Gobert GN, et al. DNA amplification approaches for the diagnosis of key parasitic helminth infections of humans[J]. Mol Cell Probes, 2011, 25(4): 143-152. DOI: 10.1016/j.mcp.2011.05.002
[19]Wichmann D, Panning M, Quack T, et al. Diagnosing schistomiasis by detection of cell-free parasite DNA in human plasma[J]. PLos Negl Trop Dis, 2009, 3(4): e422. DOI: 10.1371/journal.pntd.0000422
[20]Zhou L, Tang JF, Zhao YY, et al. A highly sensitive TaqMan real-time PCR assay for early detection ofSchistosomaspecies[J]. Acta Trop, 2011, 120(1-2): 88-94. DOI: 10.1016/j.actatropica.2011.06.006
[21]Xu J, Liu AP, Guo JJ, et al. The sources and metabolic dynamics ofSchistosomajaponicumDNA in serum of the host[J]. Parasitol Res, 2013, 112(1): 129-133. DOI: 10.1007/s00436-012-3115-3

