新疆地区结核分枝杆菌北京/W系和非北京/W系间五种重要蛋白表达差异的初步研究
李 枫,李 华,梁海燕,黄 艺,米利古,王 仙,李永祥,申爱平,曹帅丽,袁 俐
结核病是一种由结核分枝杆菌(Mycobacterium tuberculosis, MTB)引起的慢性感染性疾病,严重威胁着人类的健康,其致死率在感染性疾病中位于全球第二,仅次于HIV/AIDS。结核分枝杆菌的流行存在着地域差异,据WHO最新的调查报告显示[1],近年来新发结核病病例最多的是亚洲,占全球新发病例的60%。中国的结核发病人数仅次于印度,排名第二,而新疆又为我国结核病疫情的高发区。
结核分枝杆菌北京/W系菌株是MTB的一个独特遗传谱系,占全球分离株的13%,全世界约有1/3的结核病由该型菌株所致[2],被认为是一类传播速度更快、毒力更强[3]、与耐药密切相关的菌株[4-5],推测这些特性可能与其内在分子表达的改变有一定的联系。本研究选取了MTB 5个重要的抗原蛋白,包括HspX,Hsp65,38kDa蛋白,Ag85B和MPT64,从DNA、RNA和蛋白水平比较这5个蛋白在北京/W系与非北京/W系菌株中的表达是否存在差异。
1 材料与方法
1.1菌株和细胞株 MTB标准株H37Rv由北京结核病胸部肿瘤研究所提供;MTB临床分离株60株,其中北京/W系与非北京/W系菌株各30株, 均收集分离于结核患者的痰液。鼠源性巨噬细胞株RAW264.7购自中国科学院典型培养物保藏委员会细胞库。
1.2主要仪器和试剂 PCR仪和Gel Doc 2000凝胶成像系统购于美国Bio-Rad公司;Smart CyclerⅡ实时荧光定量PCR仪购于美国Cepheid公司;7H9液体培养基购于美国Sigma公司;Taq DNA聚合酶、dNTP购于北京天根生物工程公司;细菌RNA提取试剂盒购于美国Omega公司;逆转录试剂盒购于上海东洋纺生物科技有限公司;荧光定量PCR试剂盒购于大连宝生物工程公司;结核分枝杆菌16kD、Hsp65、38kDa单克隆抗体和Ag85B多克隆抗体购于美国Abcam公司,MPT64多克隆抗体购于北京博尔迈生物技术有限公司;β-actin单克隆抗体、辣根过氧化物酶(HRP)标记山羊抗鼠IgG购于北京中衫金桥生物技术有限公司;ECL发光试剂盒购于美国Thermo公司。
1.3结核分枝杆菌的分离培养及鉴定 60株临床分离株均运用鉴别培养基PNB(对硝基苯甲酸)和TCH(噻吩-2-羧酸肼)进行了分支杆菌菌种初步鉴定[6],并进一步用PCR法扩增16SrRNA 和MTP40进行MTB复合群鉴定,确定为人型结核分枝杆菌[7]。北京/W系结核分枝杆菌经RD105缺失基因检测法进行鉴定确认[8]。
1.4基因克隆及测序 结核分枝杆菌 DNA制备:取适量细菌于500 μL的双蒸水中,85 ℃灭活30 min,8 000 r/min离心5 min,弃上清,加入500 μL TE充分混合,85 ℃水浴30 min,12 000 r/min离心5 min,取上清液于-20 ℃保存备用。通过GenBank查找5个目的蛋白HspX、Hsp65、38 kDa、Ag85B和MPT64对应的编码基因hspX、groEL2、psts1、fbpB和mpt64的基因序列,应用primer 5.0软件设计特异性引物(表1), PCR扩增产物经1% 琼脂糖凝胶电泳验证正确后测序以检测目的基因有无突变。引物合成与基因测序均由上海生工生物技术有限公司完成。
1.5MTB总RNA的提取及逆转录 取7H9液体培养基中处于对数生长期的菌液3 mL,8 000 r/min离心5 min,PBS洗涤3次,弃上清,按照细菌RNA提取试剂盒说明进行操作。用核酸蛋白仪测定mRNA的浓度和纯度,调整配平每个样本mRNA的量,取等量mRNA用于逆转录。将mRNA先于65 ℃变性5 min,立即置于冰上。逆转录体系为primer mix 0.5 μL,逆转录酶0.5 μL,Buffer 2.0 μL,RNA 1.0 μL,无Rnase H2O 6.0 μL。37 ℃ 15 min,98 ℃ 5 min,逆转录为cDNA,-20 ℃保存备用。
1.6实时定量PCR样品检测:应用primer 5.0软件设计5个目的基因和内参基因Siga的特异性引物(表2)用于实时荧光定量PCR,扩增产物长度为100-300 bp。qRT-PCR反应体系:SYBR Premix 10 μL,H2O 7 μL,上下游引物各0.5 μL,cDNA 2 μL。每个样品重复检测3次。

表1 基因测序的引物序列

表2 实时荧光定量PCR引物序列
1.7总蛋白的制备 结核分枝杆菌感染巨噬细胞RAW264.7 24 h后,收集细胞,2 000 r/min离心10 min,弃上清,用PBS洗涤3次。按照每106个细胞加入250 μL高效RIPA裂解液(细胞裂解液∶PMSF=100∶1),静置30 min。超声破碎1 min,振幅70%,超声1 s,停止1 s。14 000 r/min,4 ℃离心25 min,取上清。用核酸蛋白仪测定蛋白浓度,调整配平每个样本的蛋白量。
1.8Western blot检测蛋白表达 将蛋白于100 ℃变性5 min,取50 μg蛋白上样,以β-actin为内参进行SDS-PAGE电泳(5%浓缩胶和12%分离胶),通过半干转印法转移至PVDF膜上,于5%脱脂牛奶中封闭2 h,一抗4℃孵育过夜(结核分枝杆菌16 kD单克隆抗体1∶2 000稀释, Hsp65单克隆抗体1∶100稀释,38 kDa单克隆抗体1∶5 000稀释,Ag85B多克隆抗体1∶5 000稀释,MPT64多克隆抗体1∶1 000稀释,β-actin单克隆抗体1∶1 000稀释),TBST洗膜5次,每次10 min,二抗室温孵育1 h(1∶5 000稀释),TBST充分洗膜,ECL显色曝光。
1.9统计学分析 结果运用SPSS17.0软件进行统计学分析,五种重要蛋白在北京/W系和非北京/W系结核分枝杆菌间的比较分析采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1基因测序分析 结核分枝杆菌标准株H37Rv及临床分离株北京/W系与非北京/W系菌株的5个目的蛋白HspX、Hsp65、38kDa蛋白、Ag85B和MPT64对应的编码基因hspX、groEL2、psts1、fbpB和mpt64 PCR扩增产物进行测序,在GenBank中进行Blast比对,结果与标准株同源性为100%,未检测到基因突变。
2.2mRNA水平的相对表达 实时荧光定量PCR的结果采用相对定量法2-ΔΔCt值比较结核分枝杆菌临床分离株北京/W系与非北京/W系菌株不同基因mRNA的表达量(表3)。校正结果以非北京/W系菌株mRNA的表达量为1,北京/W系菌株与之比较(图1)。结果显示北京/W系菌株38kDa蛋白、Ag85B对应的编码基因psts1、fbpBmRNA的表达水平低于非北京/W系菌株,差异有统计学意义(P<0.05);HspX、Hsp65和MPT64对应的编码基因hspX、groEL2和mpt64 mRNA的表达水平与非北京/W系菌株相比,差异无统计学意义(P>0.05)。
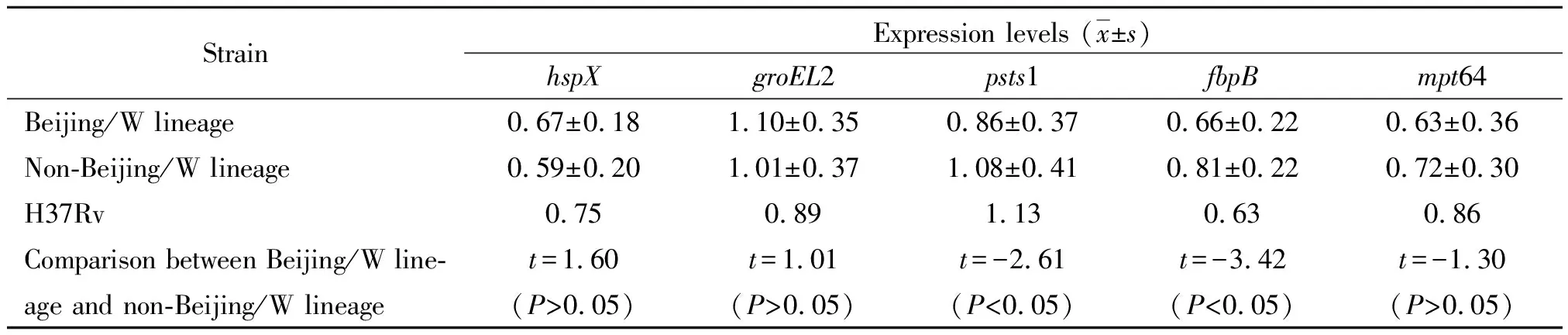
表3 结核分枝杆菌 mRNA的表达量
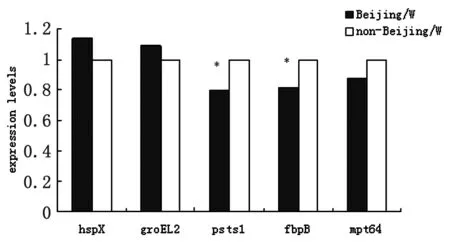
图1北京/W系和非北京/W系MTBmRNA的相对表达水平
注:*表示北京/W系与非北京/W系结核分枝杆菌比较差异显著(P<0.05)
Fig.1ThemRNArelativeexpressionlevelinBeijing/Wlineageandnon-Beijing/WlineageofMTB
The difference between Beijing/W lineage and non-Beijing/W lineage strains is significant (P<0.05).
2.3蛋白表达水平 Western blot检测细菌感染巨噬细胞RAW264.7 24 h后结核分枝杆菌临床分离株北京/W系与非北京/W系菌株蛋白HspX、Hsp65、38 kDa蛋白、Ag85B和MPT64的表达水平。结果用Quantity One软件分析条带灰度值,以目的条带的灰度值和对应样本β-actin的灰度值的比值代表蛋白的相对表达量(表4,图2)。
结果显示细菌感染细胞24 h后,北京/W系菌株HspX、Hsp65的表达水平高于非北京/W系菌株,38 kDa蛋白、Ag85B的表达水平低于非北京/W系菌株,差异均有统计学意义(P<0.05),MPT64的表达未见差异(P>0.05)。
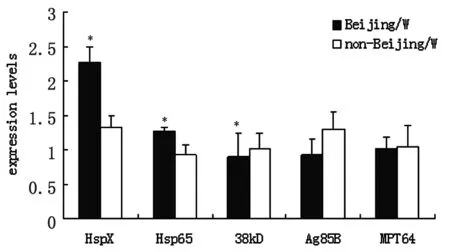
图2北京/W系和非北京/W系MTB蛋白表达水平的比较
注:*表示北京/W系与非北京/W系结核分枝杆菌比较,P<0.05
Fig.2ComparisononexpressionleveloftheproteininBeijing/Wlineageandnon-Beijing/WlineageofMTB
The difference between Beijing/W lineage and non-Beijing/W lineage strains is significant (P<0.05).
3 讨 论
结核分枝杆菌是胞内寄生菌,不产生内、外毒素及侵袭性酶,其致病性可能与细菌在组织细胞内大量繁殖引起的炎症,菌体成分和代谢物质的毒性以及机体对菌体成分产生的免疫损伤有关,而MTB分泌的蛋白及菌体蛋白在宿主抗MTB的免疫反应中发挥着重要的作用。北京/W系MTB在全球广泛分布并造成多次爆发流行,推测其传播高毒力性与其内在蛋白分子表达的改变有一定的联系。
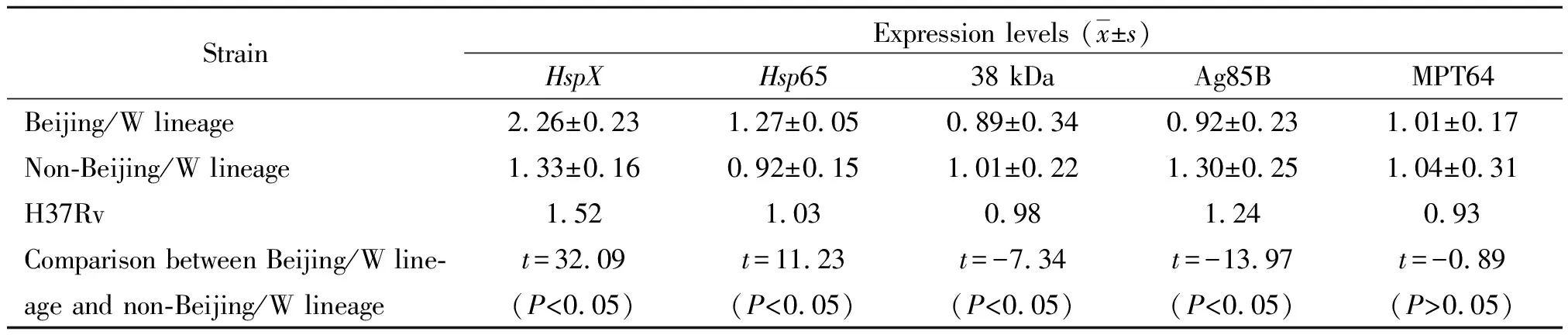
表4 结核分枝杆菌蛋白的表达量
HspX又称α晶体蛋白,是由MTB的hspX基因编码的一个重要的膜抗原。实验研究表明,HspX是MTB潜伏感染期机体免疫反应的重要靶抗原,对MTB进入休眠状态及MTB休眠菌在体内存活起着重要的作用,并且有基因敲除实验表明如果没有HspX,MTB将很难在宿主巨噬细胞内存活[9]。在结核潜伏期HspX高度表达,积累成为潜伏期细菌表达的主要蛋白质,该蛋白作为分子伴侣避免其他蛋白因热诱导而降解, 可能在MTB长期持留中起稳定细胞壁结构的作用,与MTB缓慢生长有关[10-11]。Hsp65是Hsp60家族成员之一,由gorEL2基因编码的分泌蛋白,具有高度的保守性。该蛋白具有很强的免疫原性,在结核分枝杆菌感染过程中,Hsp65是机体对抗其入侵的重要的免疫保护性抗原,在MTB感染的小鼠体内,约20%的反应性T细胞能够识别Hsp65[12]。本研究结果显示,细菌感染巨噬细胞24 h后,北京/W系菌株中HspX和 Hsp65蛋白的表达量均高于非北京/W系菌株,而感染细胞前mRNA的表达水平没有差异。推测可能是因为热休克蛋白高度保守,在正常的生理条件下表达水平较低,当被巨噬细胞吞噬后进入应激状态被大量诱导表达以发挥重要的作用。HspX的高表达有利于北京/W系菌株在宿主体内生存,赋予其更高的毒力和更强的抵抗性。但是对机体具有较强免疫保护作用的Hsp65在细菌感染细胞24h后在北京/W系菌株中也呈高表达,其具体作用机制有待进一步研究。
38 kDa蛋白是由psts1基因编码的一种磷酸盐转运蛋白,可能与胞内抗结核药物外排有关[13]。该蛋白以分泌蛋白和膜蛋白的形式存在, 能介导宿主巨噬细胞的凋亡,与凋亡受体TNFR1、TNFR2和Fas的表达上调密切相关[14]。此外该蛋白含有供T、B淋巴细胞识别的抗原表位,可以诱导机体产生较强烈的体液免疫和细胞免疫[15]。Ag85B是由fbpB基因编码的一种分泌蛋白,属于Ag85复合物(包括Ag85A,B,C)的组分之一,抗原分析表明三者中Ag85B的免疫原性最强,是BCG发挥生物学作用的主要成分,能诱导机体产生强烈的Th1免疫反应[16],Ag85B还可诱导PPD阳性健康人群外周血单个核细胞分泌IFN-γ,具有较强的免疫保护作用[17]。MPT64是由mpt64基因编码的一种结核分枝杆菌早期分泌蛋白,是机体抗MTB感染的保护性抗原,具有重要的细胞免疫功能。本研究结果显示,在北京/W系菌株中38kDa、Ag85B的mRNA和蛋白表达水平均低于非北京/W系菌株,二者均为免疫保护性蛋白,它们的低表达有助于北京/W系菌株逃避宿主免疫系统的识别和清除,提高了细菌的生存能力。而MPT64的表达未见差异。
北京/W系结核分枝杆菌在世界范围内广泛传播,具有更高的毒力和更强的抵抗性,可引起非保护性免疫并抑制和逃避宿主免疫,其特性与特有的蛋白分子表达有关。但是北京/W系菌株的流行是多因素综合作用的结果,其在体内的感染机制尚需进一步深入探索。
参考文献:
[1]WHO. Global tuberculosis control report[R]. Geneva: World Health Organization, 2012.
[2]Brudey K, Driscoll JR, Rigouts L, et al.Mycobacteriumtuberculosiscomplex genetic diversity: mining the fourth international spoligotyping database (SpolDB4) for classification, population genetics and epidemiology[J]. BMC Microbiol, 2006, 6: 23. DOI: 10.1186/1471-2180-6-23
[3]Zhang M, Gong J, Yang Z, et al. Enhanced capacity of a widespread strain ofMycobacteriumtuberculosisto grow in human macrophages[J]. J Infect Dis, 1999, 179(5): 1213-1217.DOI: 10.1086/314738
[4]Dong DD, Gao Q.Mycobacteriumtuberculosisgenetic diversity and differential virulence[J].Microbes Infect, 2010, 5(2): 106-110. (in Chinese)
董丹丹, 高谦. 结核分枝杆菌进化与致病性的研究[J]. 微生物与感染, 2010, 5(2): 106-110.
[5]Liu BB, Lu LP, Lü B, et al. Meta analysis on the correlation betweenMycobacteriumtuberculosisBeijing family strains and drug resistance[J]. Chin J Prev Med, 2012, 46(2): 158-164. (in Chinese)
刘彬彬, 卢亮萍, 吕冰, 等. 结核分枝杆菌北京家族菌株与耐药相关性研究的Meta分析[J]. 中华预防医学杂志, 2012, 46(2): 158-164.
[6]Chinese Anti-tuberculosis Association. The laboratory science procedure of diagnostic bacteriology in tuberculosis[J]. J Chin Anti-tuberculosis, 1996, 18(1): 28-31; 1996, 18(2): 80-85; 1996, 18(3): 127-134. (in Chinese)
中国防痨协会.结核病诊断细菌学检验规程[J].中国防痨杂志,1996,18(1):28-31;1996, 18(2):80-85;1996,18(3):127-134.
[7]Huard RC, Lazzarnil C, Butler WR, et al. PCR based method to differentiate the subspecies of theMycobacteriumtuberculosiscomplex on the basis of genomic deletion[J]. J Clin Microbiol, 2003, 41(4): 1637-1650. DOI: 10.1128/JCM.41.4.1637-1650.2003
[8]Tsolaki AG, Gagneux S, Pym AS, et al. Genomic deletions classify the Beijing/W strains as a distinct genetic lineage ofMycobacteriumtuberculosis[J]. J Clin Microbiol, 2005, 43(7): 3185-3191. DOI: 10.1128/JCM.43.7.3185-3191.2005
[9]Fu X, Zhang H, Zhang X, et al. A dual role for the N-terminal region ofMycobacteriumtuberculosisHsp16.3 in self-oligomerization and binding denaturing substrate proteins[J]. J Biol Chem, 2005, 80(8): 6337-6348. DOI: 10.1074/jbc.M406319200
[10]Shi CH, Jiang Y, Zhao Y, et al. Effects ofMycobacteriumtuberculosisHsp16.3 protein on the autophagy function of mice macrophages[J]. Chin J Cell Mol Immunol, 2011, 27(12): 1301-1303. (in Chinese)
师长宏, 江鹰, 赵勇, 等. 结核分枝杆菌Hsp16.3蛋白影响小鼠巨噬细胞自噬形成的实验研究[J]. 细胞与分子免疫学杂志, 2011, 27(12): 1301-1303.
[11]Daniel J, Maamar H, Deb C, et al.Mycobacteriumtuberculosisuses host triacylglycerol to accumulate lipid droplets and acquires a dormancy-like phenotype in lipid-loaded macrophages[J]. PloS Pathog, 2011, 7(6): e1002093. DOI: 10.1371/journal.ppat.1002093
[12]Lowrie DB, Tascon RE, Bonato VL, et al. Therapy of tuberculosis in mice by DNA vaccination[J]. Nature, 1999, 400(6741): 269-271. DOI: 10.1038/22326
[13]Bhatt K, Banerjee SK, Chakraborti PK. Evidence that phosphate specific transporter is amplified in a fluoroquinolone resistantMycobacteriumsmegmatis[J]. Eur J Biochem, 2000, 267: 4028-4032. DOI: 10.1046/j.1432-1327.2000.01437.x
[14]Sanchez A, Espinosa P, Esparza MA, et al.Mycobacteriumtuberculosis38-kDa lipoprotein is apoptogenic for human monocyte-derived macrophages[J]. Scand J Immunol, 2009, 69(1): 20-28. DOI: 10.1111/j.1365-3083.2008.02193.x
[15]Wu X, Yang X, Zhang J, et al. Humoral immune responses against theMycobacteriumtuberculosis38-kilodalton, MTB-48, and CFP-10/ESAT-6 antigens in tuberculosis[J]. Clin Vaccine Immunol, 2010, 17(3): 372-375. DOI: 10.1128/CVI.00287-09
[16]Lim JH, Park JK, Jo EK, et al. Purification and immunoreactivity of three components from the 30/32-Kilodalton antigen85 complex inMycobacteriumtuberculosis[J]. Infect Immune, 1999, 67(11): 6187-6190.
[17]Torres M, Herrera T, Villareal H, et al. Cytokine profiles for peripheral blood lymphocytes from patients with active pulmonary tuberculosis and healthy household contacts in response to the 30-kilodalton antigen ofMycobacteriumtuberculosis[J]. Infect Immun, 1998, 66(1): 176-180.

