细粒棘球绦虫GAPDH蛋白的生物信息学分析及其重组表达纯化和酶活性检测
吴巨龙,王 绚,吕 刚,苏 娟,逯召莲,孙萃萍,景 涛,2
细粒棘球绦虫(Echinococcusgranulosus,Eg,又名单房包虫)病是流行于我国(特别是西北地区)常见的人兽共患寄生虫病,是我国规划防治的五大寄生虫病之一[1]。
目前研究中,人们多采用多价复合疫苗即“鸡尾酒”式疫苗对其进行预防[2]。
甘油醛3-磷酸脱氢酶(glyceraldehyde 3-phosphate dehydrogenase, GAPDH) 是参与糖酵解的一种关键酶。在糖酵解过程中,GAPDH催化3-磷酸甘油醛转变成1, 3-二磷酸甘油酸, 后者作为底物在3-磷酸甘油酸激酶催化下生成3-磷酸甘油酸,同时生成一个ATP[3]。在寄生虫, GAPDH的含量非常丰富[4]。
本研究通过筛选细粒棘球绦虫成虫cDNA质粒文库, 寻找、识别出细粒棘球绦虫GAPDH(EgGAPDH)基因,将其编码区克隆到原核表达质粒pET30a(+)中, 表达出融合蛋白, 并检测其生活学活性,为进一步研究其功能奠定基础。
1 材料与方法
1.1材料
1.1.1细粒棘球绦虫成虫cDNA质粒文库、载体和菌株 细粒棘球绦虫成虫全长cDNA质粒文库以及EST序列测序结果,原核表达质粒pET30a(+)和大肠埃希菌DH5α、BL21(DE3)由本实验室保存。
1.1.2主要试剂 限制性内切酶EcoRⅠ和Hind Ⅲ,dNTP,蛋白质Marker,T4 DNA连接酶,Tag酶,质粒抽提试剂盒,DNA胶回收试剂盒购自TaKaRa公司;Ni-NTA层析柱、4 500 bp DNA Marker购自Qiagen公司;IPTG,一磷酸腺苷(AMP)购自北京索莱宝公司;烟酰胺腺嘌呤二核苷酸(NAD)、3-磷酸甘油醛、二硫苏糖醇(DTT)购自Sigma公司进口分装产品;其余试剂均为国产分析纯。
1.2方法
1.2.1EgGAPDH 生物信息学分析 开放阅读框识别采用ORF Finder软件;理化性质分析采用ProtParam网站;保守结构域的预测采用NCBI的CD-Search工具;用MEGA5.1工具构建进化树;蛋白质的二级结构和三级结构分别采用predictprotein和SWISS-MODEL网站预测。
1.2.2cDNA文库的筛选及目的基因的扩增 细粒棘球绦虫成虫cDNA文库经转化DH5α感受态细胞,蓝白斑筛选白色菌落并扩增培养,提取重组质粒pBlue-EgGAPDH。根据EgGAPDH基因序列,设计1对引物,在每条引物的5′端分别引入EcoRⅠ和HindⅢ酶切位点及保护性碱基。引物的序列为:
上游:5′-CAGAATTCATGAAGCCCCAGGTC-3′,
下游:5′-CGGAAGCTTTTAATGATCCCTCT-3′,
下划线序列为酶切位点。PCR扩增目的基因序列,用1.0%琼脂糖凝胶电泳鉴定PCR产物后切胶回收并纯化目的片段。
1.2.3重组表达质粒的构建及鉴定 取纯化好的PCR产物和表达载体pET30a(+),分别用EcoRⅠ和HindⅢ进行酶切后,在T4连接酶的作用下16 ℃过夜,将连接产物转化到已制备好的感受态菌BL21(DE3)中。用含卡那霉素的LB固体培养基筛选阳性菌株后,提取重组质粒,用限制性内切酶EcoRⅠ和HindⅢ酶切鉴定,送上海生工有限公司测序。
1.2.4重组EgGAPDH蛋白的诱导表达、纯化鉴定和蛋白浓度的测定 将重组菌接种于含卡那霉素的LB培养基中,37 ℃,180 r/min摇菌,培养6 h,收集菌液,加入IPTG至终浓度为0.8 mmol/L,20 ℃振荡培养过夜后,12 000 r/min离心10 min,收集菌体沉淀后用15 mL纯水重悬,超声8 min,用Ni-NTA层析柱纯化。通过12%SDS-PAGE检测纯化的蛋白。用Bradford法测定重组蛋白的浓度。
1.2.5EgGAPDH 重组蛋白体外酶活力分析 酶活性测定参照文献[5]所述方法进行。
2 结 果
2.1生物信息学分析结果
2.1.1理化性质的预测 对由cDNA序列推测得到的GAPDH蛋白质序列分析发现,其理论相对分子质量为36 128.3 Da,等电点为8.44。
2.1.2保守结构域预测 该蛋白具有2个保守功能结构域,分别是位于N端(第4-159位)的Rossmann NAD(P)结合功能域和位于C端(第156-314位)行使糖运输和代谢的催化功能域。
2.1.3分子进化树的构建 应用MEGA5.1工具,将细粒棘球绦虫与GenBank上已登录的多房细粒棘球绦虫EmGAPDH(登录号:U19101.1),猪肉绦虫TsGAPDH(登录号:EF468494.1),人HsGAPDH (登录号:BC029618.1),日本血吸虫SjGAPDH(登录号:FN316854.1),华支睾吸虫CsGAPDH(登录号:DF127286.1),恶性疟原虫PfGAPDH(登录号:AF030440.1),刚地弓形虫TgGAPDH(登录号: AF265361.1),秀丽隐杆线虫CeGAPDH(登录号:X04818.1),马来丝虫BmGAPDH(登录号:U18137.1),克氏锥虫TcGAPDH(登录号:X52898.1),婴儿利什曼原虫LiGAPDH(登录号:XM_001467109.1)等11种动物的GAPDH氨基酸序列进行同源比对分析后,运用MEGA5.1软件构建了系统发生树(图1)。从图中可以看出,细粒棘球绦虫GAPDH与多房棘球绦虫的GAPDH亲缘关系最近,与猪肉绦虫次之,与恶性疟原虫、婴儿利什曼原虫等的亲缘关系较远。
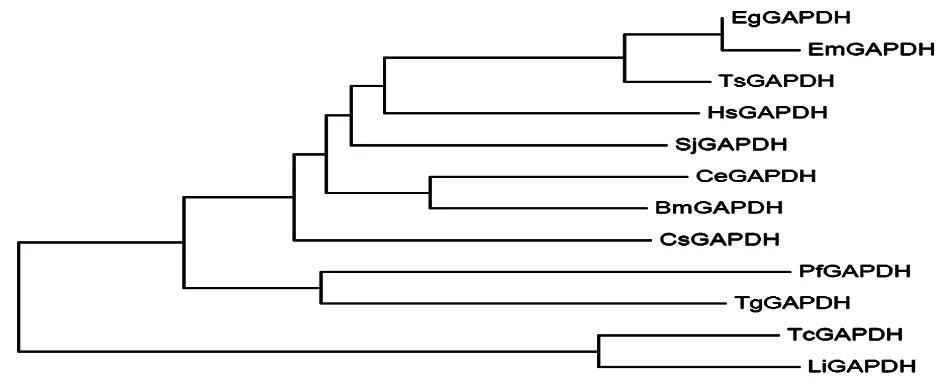
图1EgGAPDH系统发生树(数字代表进化距离)
Fig.1Analysisofphylogeny(thenumberindicateevolutiondistance)
2.1.4二级结构的预测 该蛋白二级结构中,α-螺旋占26.79%,β-折叠占30.36%,环状结构占42.86%。预测该蛋白有4个N-糖基化位点,6个蛋白激酶C磷酸化位点,3个酪蛋白激酶Ⅱ磷酸化位点,1个酪氨酸激酶磷酸化位点,4个N-豆蔻酰化位点,1个甘油醛3-磷酸脱氢酶活性位点。分析蛋白跨膜区,结果表明该蛋白为一个胞质内蛋白。
2.1.5三级结构的预测EgGAPDH的三维结果如图2所示,红色部分为酶的活性位点(aa149-156,序列为ASCTTNCL),从图2可以看出,EgGAPDH的活性位点是位于蛋白三维结构的表面部分。
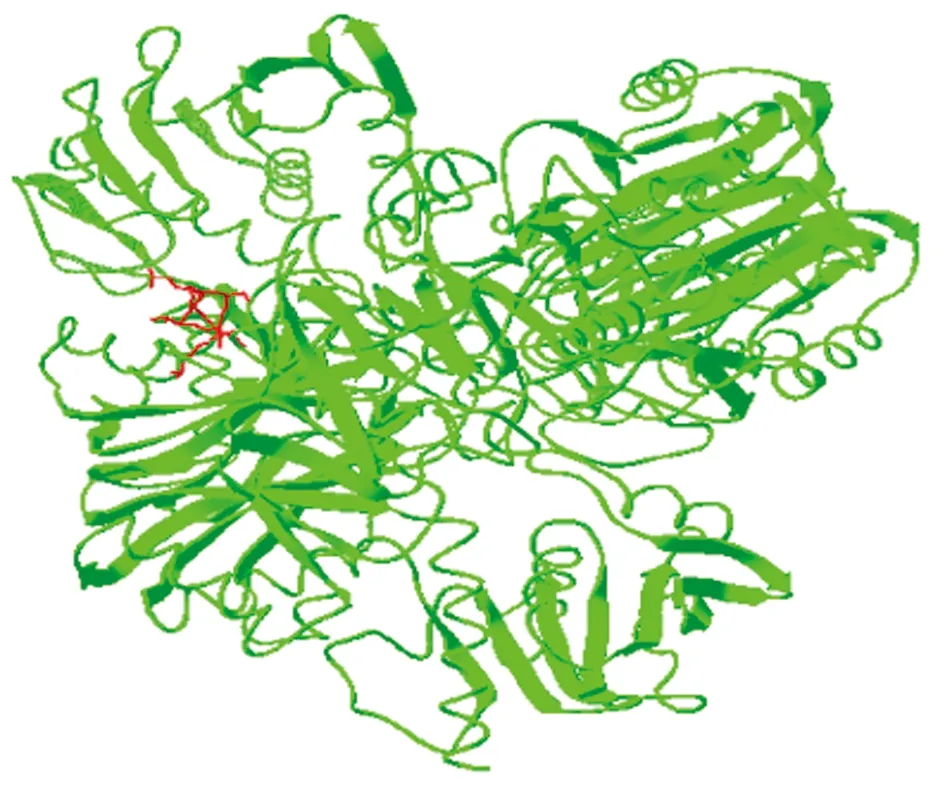
图2 EgGAPDH的三维结构预测
2.2EgGAPDH 基因PCR扩增EgGAPDH 基因PCR产物经1.0%琼脂糖凝胶电泳, 在约1 011 bp处显示1条清晰的条带,见图3。
2.3重组质粒的酶切鉴定 将重组表达质粒用限制性内切酶EcoRⅠ和Hind Ⅲ双酶切后,经1.0%琼脂糖凝胶电泳,检测到插入片断大小约1 011 bp, 与目的基因片段相符,见图4。
2.4重组pET30a(+)-EgGAPDH 蛋白表达、分离纯化及浓度测定 收集经IPTG诱导表达过夜的重组菌,超声裂解后进行12%SDS-PAGE分离,上清和沉淀中均有明显的目的蛋白,对上清蛋白采用Ni-NTA柱进行分离纯化。结果如图5所示。重组蛋白的浓度为0.42±0.03 mg/mL。
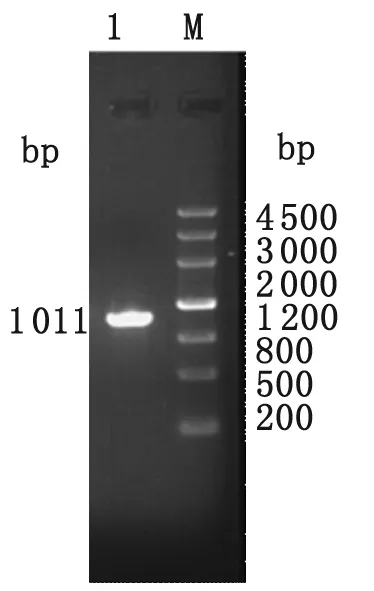
图3EgGAPDH基因PCR鉴定(1%琼脂糖凝胶电泳)
Fig.3IdentificationoftheamplifiedproductofGAPDHgene(1.0%agrosegelelectrophoresis)
1: Amplified product of GAPDH gene; M: DNA standard marker.

图4pET30a(+)-GAPDH重组体双酶切鉴定(1.0%琼脂糖凝胶电泳)
Fig.4IdentificationoftherecombinantpET30a(+)-GAPDHdigestedwithEcoRⅠandHindⅢ (1.0%agarosegelelectrophoresis)
M: DNA standard marker; 1: Recombinant pET30a(+)-GAPDH digested withEcoRⅠ andHind Ⅲ.
2.5EgGAPDH重组蛋白体外酶活力分析 表1显示, 在重组蛋白EgGAPDH的酶反应体系中, BSA加底物对照组和EgGAPDH未添加底物组均未见酶活,而EgGAPDH加底物组的A340值反应前后明显不同,A340值随重组蛋白EgGAPDH加入量的增多而增高。表明所获重组蛋白EgGAPDH具有酶催化活性。
在低酶量组反应体系的基础上,加入0.5 mL不同浓度的一磷酸腺苷(AMP),测定其对催化底物转化量NADH的影响。其结果见表2。
如表2结果所示,在所建立的GAPDH反应体系中,未加入一磷酸腺苷(AMP)时体系所测得的吸光度值随反应时间呈持续上升趋势,表明此体系中有反应发生。当加入0.5 mL 0.5 mmol/L的AMP时,体系所测得的吸光度值总体趋势仍上升,但相比第一组明显下降,表明AMP对体系中的反应产生抑制。当加大AMP量至0.5 mL 2 mmol/L时,体系所测定的吸光度值继续下降,表明对反应的抑制作用进一步增强。
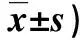
表1 重组蛋白EgGAPDH 的酶反应体系吸光度( A340值,
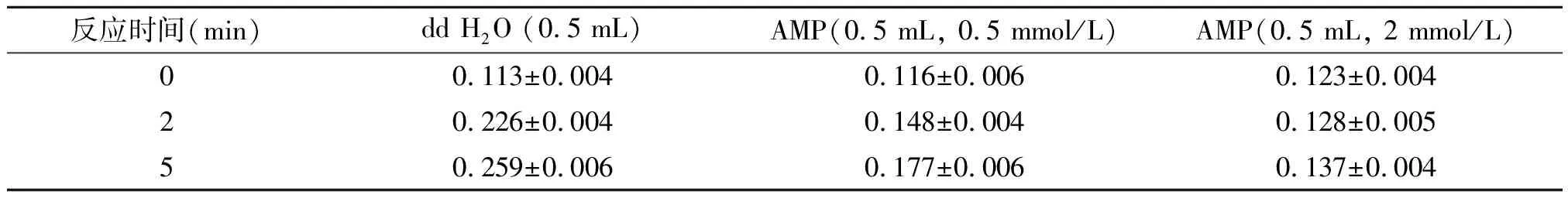
表2 一磷酸腺苷(AMP)对GAPDH酶反应体系光密度值的影响

图5重组pET30a(+)-GAPDH蛋白SDS-PAGE分析
Fig.5SDS-PAGEanalysisofthepET30a(+)-GAPDHprotein
M: Standard molecular weight protein marker;
1: pET30a(+)-EgGAPDH total of sonificated bacterial lysates;
2: pET30a(+)-EgGAPDH supernatant of sonificated bacterial lysates;
3: pET30a(+)-EgGAPDH deposition of sonificated bacterial lysates;
4: The purifiedEgGAPDH.
3 讨 论
GAPDH广泛存在于原核生物和真核生物中,在生物体的糖代谢中有着重要的作用。GAPDH由单一基因编码, 是一个高度保守的基因。GAPDH基因在所有的组织中的表达相对衡量、持续,在分子生物学的研究中,常被用作内参基因[6]。该基因除了在细胞糖酵解过程中产生重要作用外, 还执行不同的生物学功能, 这与GAPDH在亚细胞中的定位有关[7]。分布在细胞膜的GAPDH主要执行内吞功能, 参与大分子的运输。细胞浆中的GAPDH 主要参与糖酵解代谢,产生能量(ATP),以及通过对转录的调控,控制基因的表达。细胞核内的GAPDH除了通过对转录的调控来控制基因的表达外,还在DNA的复制, 遗传信息的传递,以及DNA的修复以保持基因组的稳定方面发挥作用[8]。
近年来GAPDH对寄生虫的保护性免疫力的研究在国内外受到关注, 多房棘球绦虫GAPDH抗原性和保护性免疫力已被证实[9], 曼氏血吸虫所衍生的42 kD GAPDH物种蛋白可以诱导小鼠产生抗血吸虫尾蚴感染的保护性反应[10],闫玉涛等学者曾研究日本血吸虫大陆株GAPDH基因核酸疫苗免疫C57BL/6小鼠诱生的免疫应答特征和保护性[11]。此外,GAPDH作为细粒棘球绦虫糖酵解过程的关键酶,是抑制糖酵解过程的潜在靶标,阻断GAPDH的功能可以干扰虫体赖以生存的碳水化合物和能量代谢,从而抑制寄生虫的生长,所以目前GAPDH已成为研发抗寄生虫药物的重要靶标[12]。国外文献报道,AMP及其相似物可以在GAPDH催化3-磷酸甘油醛生成1,3-二磷酸甘油酸的反应过程中对NAD+产生竞争性抑制,并以此来研究相关抗寄生虫的药物[13-18]。因此,对细粒棘球绦虫GAPDH酶及其基因的深入研究,无论对于更全面了解细粒棘球绦虫的生理代谢和致病作用,还是对新的抗细粒棘球绦虫药物的开发研究,都具有重要意义。
本研究首次克隆获得了1 011 bp的细粒棘球绦虫成虫GAPDH基因全长cDNA序列,基于GAPDH基因的cDNA序列推测的蛋白质序列长336个氨基酸。通过同源性分析发现该蛋白质在进化中高度保守。该蛋白包含2个保守区域,一个为NAD(P)结合功能域(aa4-159),另一个为酶的催化区(aa156-314),这说明该蛋白可能具有甘油醛3-磷酸脱氢酶相同的作用。
参考文献:
[1]Li WG, Chen YT. Advanced on the study of Eg95 vaccine against Echinococcus granulosus[J]. Chin J Zoonoses, 2006, 22(11): 1070-1072. (in Chinese)
李文桂, 陈雅棠. 细粒棘球绦虫Eg95疫苗研究进展[J]. 中国人兽共患病学报, 2006, 22(11): 1070-1072.
[2]Li ZJ, Zhao W. Analysis of protoscoleces-specific antigens from echinococcus granulosus with proteomics combined with western blot[J]. Biomed Environ Sci, 2012, 25(6): 718-723. DOI: 10.3967/0895-3988.2012.06.015
[3]Wang JY, Zhu SG, Xu CF. Biochemistry(Volume Two)[M]. 3rded. Beijing: Higher Education Press. 2002: 76. (in Chinese)
王镜岩, 朱圣庚, 徐长法. 生物化学(下册)[M]. 3版. 北京: 高等教育出版社,2002: 76.
[4]Wang QM, Wang MJ, Chang HL. Isolation and purification of recombinant protein glyceraldehyde-3-phosphate dehydrogenase ofSchistosomajaponicum[J]. Chin J Parasitol Parasit Dis, 1994, (04): 262-264. (in Chinese)
王琴美, 王鸣杰, 常惠玲. 日本血吸虫3-磷酸甘油醛脱氢酶的分离与纯化[J]. 中国寄生虫学与寄生虫病杂志, 1994, (04):262-264.
[5]Welch JE, Brown PL, O’Brien DA, et al. Human glyceraldehyde 3-phosphate dehydrogenase-2 gene is expressed specifically in spermatogenic cells[J]. J Androl, 2000, 21(2): 328-338. DOI:10.1002/j.1939-4640.2000.tb02111.x
[6]Shang HX, Jing R, Jia HT, et al. Functional diversity of GAPDH[J]. Progr Physiolog Sci, 2011, (05): 371-374. (in Chinese)
尚海旭, 井然, 贾弘禔, 等. GAPDH功能多样性[J]. 生理科学进展, 2011, (05):371-374.
[7]Mazzola JL, Sirover MA. Subcellular localization of human glyceraldehyde-3-phosphate dehydrogenase is independent of its glycolytic function[J]. Biochim Biophys Acta, 2003, 1622(1): 50-56. DOI: 10.1016/S0304-4165(03)00117-X
[8]Sirover MA. Role of the glycolytic protein, glyceraldehyde-3-phosphate dehydrogenase, in normal cell function and in cell pathology[J]. J Cell Biochem, 1997, 66(2): 133-140. DOI: 10.1002/(SICI)1097-4644(19970801)66:2<133::AID-JCB1>3.0.CO;2-R
[9]Muller-Schollenberger V, Beyer W, Schnitzler P, et al. Immunisation withSalmonellatyphimurium-delivered glyceraldehyde-3-phosphate dehydrogenase protects mice against challenge infection with echinococcus multilocularis eggs[J]. Int J Parasitol, 2001, 31(13): 1441-1449. DOI:10.1016/S0020-7519(01)00244-2
[10]El Ridi R, Farouk F, Sherif M, et al. T and b cell reactivity to a 42-kda protein is associated with human resistance to both schistosomiasis mansoni and haematobium[J]. J Infect Dis, 1998, 177(5): 1364-1372. DOI: 10.1086/515274
[11]Yan YT, Li XH, Liu SX, et al. Immunological characteristics induced in mice by nucleic acid vaccine harboring the gene encoding GAPDH inSchistosomajaponicum[J]. Chin J Parasitol Parasit Dis, 2005, 23(5): 266-269. (in Chinese)
闫玉涛, 李小红, 刘述先, 等. 日本血吸虫三磷酸甘油醛脱氢酶核酸疫苗小鼠体内的免疫应答特征[J]. 中国寄生虫学与寄生虫病杂志, 2005, 23(5): 266-269.
[12]Akinyi S, Gaona J, Meyer EV, et al. Phylogenetic and structural information on glyceraldehyde-3-phosphate dehydrogenase (g3pdh) in plasmodium provides functional insights[J]. Infect Genet Evol, 2008, 8(2): 205-212. DOI: 10.1016/j.meegid.2007.10.003
[13]Guido RV, Oliva G, Montanari CA, et al. Structural basis for selective inhibition of trypanosomatid glyceraldehyde-3-phosphate dehydrogenase: Molecular docking and 3d qsar studies[J]. J Chem Inf Model, 2008, 48(4): 918-929. DOI: 10.1021/ci700453j
[14]Bressi JC, Verlinde CL, Aronov AM, et al. Adenosine analogues as selective inhibitors of glyceraldehyde-3-phosphate dehydrogenase of trypanosomatidae via structure-based drug design[J]. J Med Chem, 2001, 44(13): 2080-2093. DOI:10.1021/jm000472o
[15]Aronov AM, Suresh S, Buckner FS, et al. Structure-based design of submicromolar, biologically active inhibitors of trypanosomatid glyceraldehyde-3-phosphate dehydrogenase[J]. Proc Natl Acad Sci U S A, 1999, 96(8): 4273-4278. DOI: 10.1073/pnas.96.8.4273
[16]Aronov AM, Verlinde CL, Hol WG, et al. Selective tight binding inhibitors of trypanosomal glyceraldehyde-3-phosphate dehydrogenase via structure-based drug design[J]. J Med Chem, 1998, 41(24): 4790-4799. DOI: 10.1021/jm9802620
[17]Van Calenbergh S, Verlinde CL, Soenens J, et al. Synthesis and structure-activity relationships of analogs of 2’-deoxy-2’-(3-methoxybenzamido)adenosine, a selective inhibitor of trypanosomal glycosomal glyceraldehyde-3-phosphate dehydrogenase[J]. J Med Chem, 1995, 38(19): 3838-3849. DOI: 10.1021/jm00019a014
[18]Verlinde CL, Callens M, Van Calenbergh S, et al. Selective inhibition of trypanosomal glyceraldehyde-3-phosphate dehydrogenase by protein structure-based design: Toward new drugs for the treatment of sleeping sickness[J]. J Med Chem, 1994, 37(21): 3605-3613. DOI: 10.1021/jm00047a017

