共表达KnobS蛋白与LTB蛋白的重组干酪乳杆菌构建
付锦楠,郭建军,袁 林,傅筱冲,何顺华
(江西省科学院微生物研究所,江西 南昌330096)
0 前言
减蛋综合征病毒(egg drop syndrome virus,EDSV)属禽类腺病毒,主要引起产薄壳蛋或无壳蛋、产蛋量迅速下降等特征。EDSV病毒是由11种大小从14 ku到97 ku不等的蛋白组成,其中纤维蛋白(fiber)是腺病毒的主要结构蛋白,可以识别细胞膜上的特异性受体[1],即病毒粒子通过纤维蛋白与细胞膜受体结合引起感染,纤维蛋白还可以阻断大分子的合成,抑制病毒的增殖,且带有主要的属和亚属特异性抗原决定簇及次要的种特异性抗原决定簇,同时也是EDSV的主要保护性抗原成分[2]。针对减蛋综合征病毒黏膜感染特点和减蛋综合征病毒纤维蛋白在疾病防治中所起的重要作用,设计以纤维蛋白KnobS为免疫原的黏膜免疫系统作为抵御病原入侵的第一道防线,对科学防治本病具有重要意义。
在疾病防治中,只能靠注射减蛋综合征疫苗来预防。由于注射极不方便,人们迫切希望有口服疫苗面市。用何种菌来表达减蛋综合征病毒纤维蛋白KnobS是该口服疫苗的关键所在。如果能利用乳酸菌表达和传递外源抗原进行黏膜免疫,无疑是最为安全有效的活菌疫苗。但乳酸菌作为载体表达外源抗原、存在外源抗原表达量低、免疫原性差,且有些乳酸菌表达的产物存在细胞内不能被免疫细胞识别和提呈等不足[3],因此如何提高乳酸菌外源抗原对黏膜免疫系统的刺激以及增加抗原与免疫细胞接触,是提高乳酸菌黏膜免疫应答的重要技术环节[4,5]。
本实验利用乳酸杆菌在肠道的黏附特性、耐胆汁酸盐、耐胰酶和在肠道的定殖和对机体的益生作用,构建表达减蛋综合征病毒纤维蛋白KnobS重组乳酸菌系统,为促进外源抗原对黏膜刺激的稳定性和持久性,在表达系统中插入了具有黏膜免疫佐剂的大肠杆菌不耐热肠毒素B亚单位(LTB),实现了KnobS蛋白与LTB在乳酸菌的共表达,从而为进一步研制EDS的口服活菌疫苗奠定了物质基础。
1 材料和方法
1.1 材料
1.1.1 试验材料 质粒pET28a-KnobS,重组质粒pMG36e-UP/L-LTB,大肠杆菌DH5α,干酪乳杆菌Lactobacillus casei 393由本室保存。
1.1.2 主要试剂 高保真DNA聚合酶、T4 DNA连接酶、DL2000 Marker、蛋白质Marker、限制性内切酶均购自大连TaKaRa公司;MRS培养基购自Oxoid公司;质粒抽提试剂盒、DNA纯化试剂盒购自爱思进公司;抗EDSV血清和抗LTB血清购自中国兽医药品监察所;HRP标记羊抗鸡IgG为KPL公司产品;电击杯为BioRad产品;引物委托上海英俊公司合成,其余试剂均为国产分析纯。
1.1.3 引物 上游引物P1含SalⅠ酶切位点,下游引物P2含PstⅠ酶切位点,用于扩增KnobS基因,约700 bp。引物CX2、CX2用于扩增LTB基因;引物CX1、CX3用于鉴定KnobS-LTB目的基因片段,引物序列如下:

1.2 方法
1.2.1 重组干酪乳杆菌的构建及鉴定 以pET28a-KnobS为模版,P1和P2为引物,PCR扩增目的基因 KnobS,反应体系50 μL:5X PCR Primer STAR Buffer 10 μL,dNTP Mixture 4 μL,模板1 μL,引物各1 μL,Primer STAR HS DNA Polymerase 0.5 μL,补水至50 μL。反应条件如下:94℃预变性30;94℃15 s,50℃15 s,72℃30 s,共28个循环;72℃延伸5 min。将胶回收的PCR产物KnobS和表达质粒载体pMG36e-UP/L-LTB分别进行Sal和PstⅠ双酶切,连接过夜,连接产物电转化感受态细胞干酪乳杆菌Lactobacillus casei 393[5]。
取适量菌液涂布于含有 10 μg/mL Cm的MRS琼脂培养基上,37℃ 厌氧培养36 h。挑取单个菌落,接种于含有10 μg/mL Cm的MRS液体培养基中,37℃厌氧培养过夜,提取质粒。对重组质粒进行酶切鉴定、以引物CX1、CX3进行PCR鉴定,并对疑似阳性重组质粒进行序列测定,获得的阳性重组质粒乳酸杆菌命名为pMG36e-UP/LTB-KnobS/Lactobacillus casei 393。
1.2.2 目的蛋白的诱导表达 pMG36e-UP/LTBKnobS/Lactobacillus casei 393阳性重组菌落接种于MRS液体培养基中,37℃厌氧培养过夜活化,取过夜培养菌以1∶20比例接种于MRS培养基中进行培养。样品处理:诱导表达菌液以6 000 r/min离心5 min,收集上清,加入SDS-PAGE样品缓冲液(含DTT),混匀,沸水浴10 min;12 000 r/ min离心5 min。优化表达条件,对重组细菌扩大培养,采用Ni-NTA离子亲和层析纯化重组蛋白。
1.2.3 表达产物的鉴定 同时设pMG36e-UP/LLTB/Lactobacillus casei 393为阴性对照进行SDSPAGE电泳及Western Blot分析,确定目的蛋白表达。重组蛋白样品经SDS-PAGE后,将电泳后的蛋白转移到 NC膜上,按照文献方法[2~5]进行Western blot检测,用5%脱脂乳37℃封闭2 h,用PBST洗3次;分别以鸡抗EDSV高免血清和抗LTB高免血清为一抗,1∶500稀释,37℃孵育2 h,PBST洗3次,再与二抗为HRP标记羊抗鸡IgG(1∶2 000稀释)作用1 h,PBST洗3次;DAB显色15~30 min,置蒸馏水中止显色。
1.2.4 鸡抗KnobS蛋白阳性血清与鸡红细胞的血凝抑制试验 根据EDSV的血凝价,配制4个血凝单位的病毒液。在96孔V形微量反应板中,每孔加入PBS 2.5 μL,第1孔加入鸡抗KnobS蛋白阳性血清2.5 μL,依次倍比稀释至每10孔,弃去2.5 μL,加入4单位病毒至倒数第2孔,室温作用30 min,最后一孔补2.5 μL PBS,加入10 mL/L的红细胞,室温放置30 min后,观察结果。
2 结果与分析
2.1 重组干酪乳杆菌表达质粒 pMG36e-UP/ LTB-KnobS的鉴定
以P1、P2为引物,pET28a-KnobS为模板,经PCR扩增获得约708bp的基因片段(见图1),该片段经1%琼脂糖凝胶纯化,纯化产物用Sal和PstⅠ双酶切,与相同双酶切的载体质粒pMG36e-UP/L-LTB进行连接,电转化 Lactobacillus casei 393,经氯霉素MRS平板培养基选择培养,挑取,单个菌落 pMG36e-UP/LTB-KnobS/Lactobacillus casei 393扩大培养,提取质粒后,经Sal和PstⅠ单酶切约有4.5 Kb的目的片段,双酶切分别切出3 700 bp和1 200 bp目的片段,PCR鉴定扩增出约1 200 bp的基因片段(见图2),测序鉴定结果表明外源基因KnobS正确插入pMG36e-UP/LTB中。
2.2 融合蛋白LTB-KnobS在干酪乳杆菌中的表达
对重组的pMG36e-UP/LTB-KnobS和pMG36e空载体干酪乳杆菌Lactobacillus casei 393进行诱导表达(见图3),结果在约41 kDa近出现目的条带,而空载体并未出现,说明LTB-KnobS可能在干酪乳杆菌中得到表达。从图3中诱导的情况看,在培养8 h后表达量开始逐渐增加,培养32 h后达到最大量,然后在培养40 h、48 h后表达量基本保持一致。

图1 EDSV纤维蛋白KnobS基因的PCR产物电泳图

图2 重组质粒pMG36e-UP/LTB-KnobS的鉴定
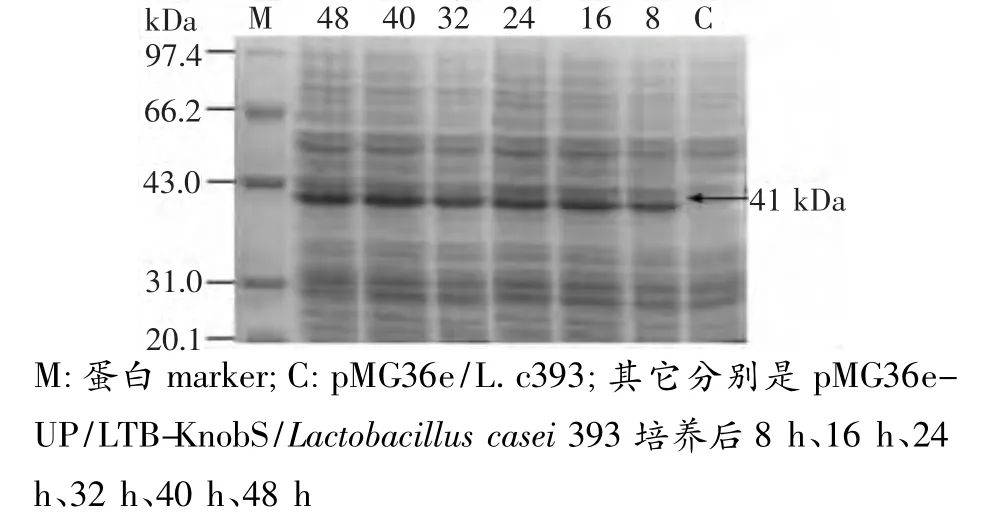
图3 SDS-PAGE电泳检测融合蛋白LTB-KnobS在干酪乳杆菌中的表达情况
2.3 重组融合蛋白的活性分析
表达的重组融合蛋白经纯化后不能与鸡红细胞发生凝集,说明重组蛋白无血凝活性。利用抗EDSV高免血清或抗LTB高免血清与重组融合LTB-KnobS蛋白进行western blot分析,在41 ku处出现清晰的印迹带,而不与其他杂蛋白反应(图4),表明重组蛋白有很好的反应活性。因此,重组蛋白具有较好的免疫原性。

图4 重组蛋白LTB-KnobS的western blot分析
3 讨论
以细菌、病毒作为活载体均可表达外源蛋白,但从生物安全性及疫苗免疫效果角度出发,能在肠道黏膜定植的乳酸菌被认为是最合适的载体系统。干酪乳杆菌是定植于人及动物肠道黏膜表面的重要益生菌群之一,作为表达和传递外源基因的载体系统[3],具有益生性安全性以及可以通过先天性免疫激活肠道黏膜免疫系统,不会刺激体产生抗体等重要特点。胞内表达、分泌表达、表面表达是目前研制乳酸杆菌活载体疫苗的主要表达形式。其中,分泌表达的蛋白质不易被蛋白酶降解,且保持较好的活性。Bermudez[6]等证明胞内和分泌形式的重组乳酸乳球菌表达的lFN-ω虽然均具有活性,但分泌型菌株表达的lFN-ω活性比在细胞质中表达的高两倍。Reveneau[7]等证明以乳酸菌作为抗原传递载体的口服疫苗刺激机体产生免疫应答与抗原表达的部位密切相关。本实验中使用的分泌型表达系统,在一定程度上保证了蛋白的表达量和蛋白活性。
纤维蛋白是EDSV的主要结构蛋白,其五邻体与六邻体一起构成病毒核衣壳,决定病毒粒子的大小。纤维蛋白带有主要的种特异性抗原决定簇和次要的亚属特异性抗原决定簇,是具有中和活性的抗原,其中和作用是阻断病毒体从酸性的核内质进入细胞,从而中和病毒。国内外学者对这纤维蛋白的研究表明,纤维蛋白的KnobS区[8]不但可识别宿主细胞受体而且能增强病毒的吸附,若病毒的KnobS区遭到破坏,即可阻止病毒的感染,因而,用EDSV纤维蛋白KnobS区作为免疫原,研究其诱导机体产生有效抗体来阻止病毒感染是可行的。
LTB作为黏膜免疫佐剂,能传递黏膜抗原信息,增加抗原特异性T细胞克隆的增殖和分化。LTB可激活Thl途径,不易引起变态反应,同时能增大抗原分子量,提高外源抗原的免疫原性,亦能提高CD8+T细胞对病毒感染细胞的杀伤力[3,5]。根据这一特点将LTB设计成为靶向分子,推测其与抗原分子的结合,有助于促进细胞对抗原分子的吸收。因此,本试验将编码减蛋综合征病毒主要免疫保护性抗原纤维蛋白KnobS与大肠杆菌不耐热肠毒素B亚单位(LTB)基因插入干酪乳酸杆菌分泌表达载体,构建共表达减蛋综合征病毒纤维蛋白KnobS与LTB的重组干酪乳杆菌;SDS-PAGE、Western-blot分析,以及血凝抑制试验均表明,该融合蛋白LTB-KnobS获得了正确表达;实现了LTB和减蛋综合征病毒纤维蛋白KnobS在乳酸杆菌的分泌融合表达。该重组干酪乳杆菌在动物免疫中,能否有效刺激机体免疫应答,LTB对KnobS是否具有免疫增强作用,尚需进一步进行动物免疫加以验证。
[1] 陈 滔,唐应华,陆吉虎,等.产蛋下降综合征病毒纤突蛋白Knob-S区原核表达及其活性分析[J].动物医学进展,2012,33(6):41-44.
[2] 郭建军,范汉东,杨一兵.减蛋综合征病毒纤维蛋白主要抗原结构域原核表达及抗原性鉴定[J].畜牧与兽医,2012,44(2):22-25.
[3] 王相清,欧 迪,任安琦,等.猪细小病毒VP2与大肠杆菌不耐热肠毒素B亚单位在干酪乳杆菌表面共表达[J].微生物学通讯,2009,36(10):1536-1541.
[4] Seegers J.Lactobacilli as live vaccine delivery vectors: progress and prospects[J].Trends Biotechnology,2002,20(12):508-515.
[5] 付锦楠,杨 罡,何顺华,等.大肠杆菌不耐热肠毒素B亚单位在干酪乳杆菌中的分泌表达[J].江西科学,2012,31(6):764-767.
[6] Bermudez-Humaran L G,Langella P,Commissaire J,et al.Controlled intra or extra cellular production of stap-hylococcal nuclease and ovine omega interferon in Lactococcus lactis[J].FEMS Microbiol Lett,2003,224:307-313.
[7] Reveneau N,Geoffroy M C.Comparison of the immune responses induced by local immunizations with recombinant Lactobacillus plantarum producing tetanus toxin fragment C in different cellular locations[J].Vaccine,2002,20:1769-1777.
[8] Fingerut E,GutterB,Gallili G,et al.Asubunit vaccine against the adenovirus egg drop syndrome using part of its fiber protein[J].Vaccine,2003,21:2761-2766.

