流动注射聚离子敏感膜电极检测三磷酸腺苷
雷佳宏,丁家旺,秦 伟
(1.海岸带环境过程与生态修复重点实验室 中国科学院烟台海岸带研究所,山东 烟台 264000;2.中国科学院大学,北京 100049)
三磷酸腺苷(adenosine triphosphate,ATP)广泛存在于各种生物体中,参与蛋白质、糖、脂肪等的代谢过程,并为生物体的生命活动直接提供能量[1-2];此外,ATP在环境分析、药物分析、临床诊断等方面也有着广泛的应用[3-4]。因此,对ATP准确快速的检测具有重要意义。
目前,ATP的检测方法有层析法、电泳法[5]、HPLC法[6]、质谱法[7]、荧光素酶法[8]、生物发光法[9]以及电化学方法[10-11]等。其中,电化学方法因具有灵敏度高、易于操作等优点,得到了广泛应用;而核酸适体由于其稳定、价廉,成为快速检测ATP的理想分子识别体。研究发现,核酸适体富含磷酸根基团,能够与聚阳离子鱼精蛋白发生较强的静电作用[12]。将鱼精蛋白作为指示分子,利用聚离子敏感膜电极能够对核酸适体进行间接电位检测[11,13]。
聚离子敏感膜电极由Meyerhoff课题组首先提出[14-15],其原理是聚离子在离子对协助作用下发生相界面转移,并产生类稳态的电位响应[16-17]。Bakker课题组发展了可逆的聚阳离子敏感膜电极,利用脉冲电流技术调控聚阳离子进入或离开敏感膜,实现了电极的循环使用[18]。最近,Meyerhoff课题组将基于脉冲电流调控的聚离子敏感膜电极作为流动注射检测器,实现了对鱼精蛋白和肝素等聚离子的连续检测[19]。作者所在课题组也建立了基于恒电流调控主离子释放的流动注射聚离子传感模式,并应用于血液中肝素的连续检测。目前,流动注射型聚离子传感模式未见应用于对核酸适体及其目标物质的检测。
本研究首次建立了以核酸适体作为识别分子、以聚离子敏感膜电极作为信号识别单元检测ATP的流动注射分析方法。
1 实验
1.1 试剂与仪器
三磷酸腺苷(ATP)、聚氯乙烯(PVC)、邻硝基苯辛基醚(o-NPOE)、四(十二烷基)-四(4-氯苯基)硼酸铵(ETH 500)、二壬基萘磺酸(DNNS,50%庚烷溶液)、鱼精蛋白、三羟甲基氨基甲烷(Tris),Sigma-Aldrich公司;四氢呋喃(THF)、浓盐酸(HCl)、氯化钠(NaCl)等,中国国药集团。
核酸适体,其碱基序列如下:5′-ACCTGGGGGAGTATTGCGGAGGAAGGT-3′[13],上海生物生工有限责任公司。
E2695型高效液相色谱仪,美国Waters;760 D型电化学工作站,上海辰华;PHSJ-3F型雷磁pH计,上海精科;CASCADE-BIO型超纯水系统,美国颇尔;XS105DU型精密电子天平,梅特勒-托利多。
1.2 聚离子敏感膜电极的制备与活化
聚离子敏感膜电极的膜组分如下:12.0 mg DNNS、12.0 mg ETH 500、60.0 mg PVC、122.0 mgo-NPOE。将称好的膜组分溶于3.0 mL THF中并搅拌2 h,倒入直径3.6 cm并固定于玻璃板上的玻璃圆环中,室温下挥干THF成膜。用打孔器将膜切割成直径6.0 mm的小圆片,并用THF粘在PVC管的末端,得到聚离子敏感膜电极。
电极内充液与活化液为含有50 μg·mL-1鱼精蛋白的Tris-HCl缓冲溶液(50 mmol·L-1Tris,pH=7.4,1 mmol·L-1NaCl,下同),电极需在活化液中活化12 h后使用;电极不用时于4 ℃下保存。
1.3 核酸适体与ATP的作用
核酸适体使用前经95 ℃加热5 min,然后置于冰上10 min,以保证其构象的柔韧性[20]。将2.0 μmol·L-1核酸适体与一定浓度的ATP于37 ℃孵育30 min,孵育过程中需不断搅拌,以促进核酸适体与ATP的作用。
1.4 电位检测
采用流动注射分析与电位法相结合的手段,将电位检测装置固定于流动分析系统中。检测系统包括载流系统、进样系统和电位检测系统。其中,载流系统和进样系统由高效液相色谱仪实现;电位检测系统(图1)由喷壁式流通池、电化学工作站和三电极体系(工作电极为聚离子敏感膜电极,参比电极为Ag/AgCl电极,辅助电极为铂丝电极)构成;载液经载流系统进入流通池,样品溶液经进样系统进入流通池;载液为Tris-HCl缓冲溶液,样品溶液为含有一定浓度核酸适体或其与ATP的复合物的Tris-HCl缓冲溶液,载液与样品溶液流出流通池后即为废液。电位检测采用计时电位模式,设置阳极电流为10 nA,初始极性为阳性。
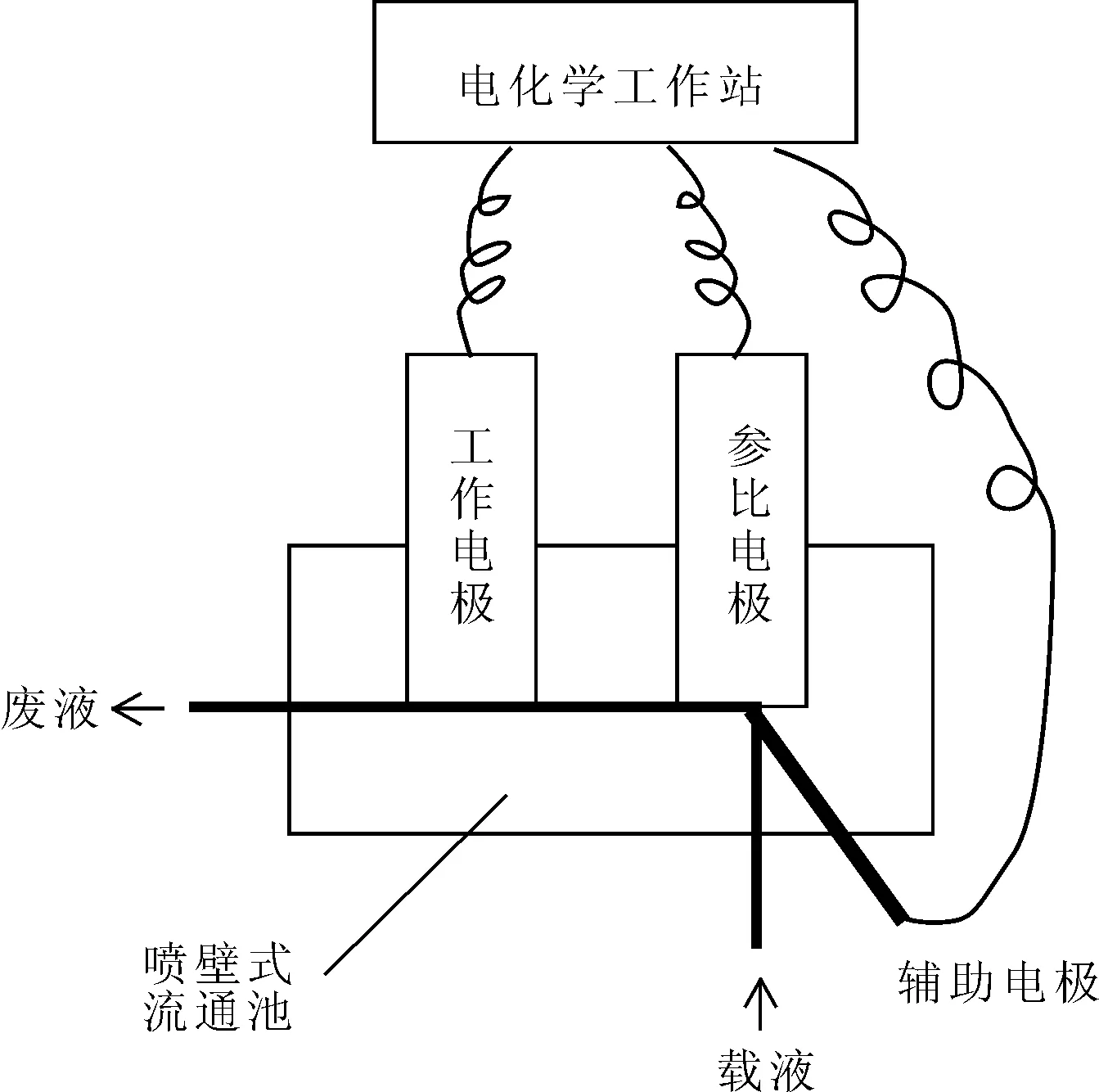
图1 电位检测系统示意图
2 结果与讨论
2.1 电位检测原理
经鱼精蛋白活化后的聚离子敏感膜电极,在施加恒定阳极电流条件下,电极外界面处的鱼精蛋白会产生一个稳定的由膜相到溶液相的主离子通量,使电极表面鱼精蛋白含量维持在恒定水平,从而得到稳定的基线电位;当分析物(如核酸适体)进入检测池,与电极表面的鱼精蛋白发生作用并形成稳定的复合物,界面处主离子浓度的减少会促使溶液相中的Na+进入膜相,引起电极电位的变化;当分析物流出检测池后,在阳极电流的作用下,电极表面被消耗的主离子迅速得到补充,使电极电位恢复初始状态,实现电极的在线更新与循环使用。
若核酸适体先与其目标物质(如ATP)作用形成复合物,以复合物形式存在的核酸适体进入检测池后不再与鱼精蛋白发生相互作用,使峰电位(Eh)值降低,可以实现对目标物质的检测。
2.2 检测条件的选择
以2.0 μmol·L-1核酸适体为检测对象,对流动注射分析方法的检测条件进行优化。
2.2.1电流对电极性能的影响(图2)
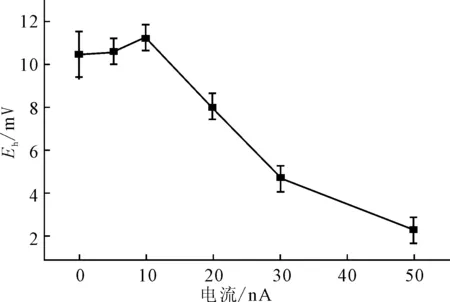
图2 电流对电位响应的影响
零电流条件下,鱼精蛋白由内充液扩散至聚离子敏感膜表面的速率较慢,使敏感膜表面的鱼精蛋白含量降低;外加电流的作用能够促进鱼精蛋白在敏感膜内的迁移,使鱼精蛋白在敏感膜表面的含量增加,从而产生更大的峰电位;由于聚离子敏感膜电极的电位响应校准曲线呈S形,当敏感膜表面的鱼精蛋白含量超出一定浓度范围后,电极变得不灵敏,对低浓度待测物质响应较小。由图2可知,在10 nA电流下,电极表现出最佳的响应性能。因此,电流选用10 nA。
2.2.2载液流速对电极性能的影响(图3)
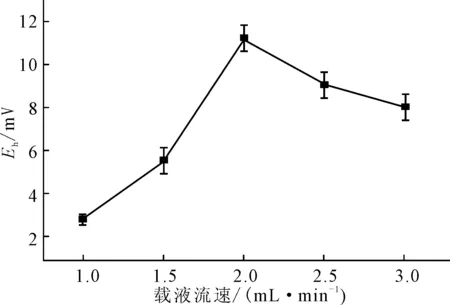
图3 载液流速对电位响应的影响
由图3可知,随着载液流速的加快,峰电位值升高。这是因为,载液流速加快,水相中以及水-膜界面处聚离子迁移速率加快,促进鱼精蛋白与核酸适体的作用,从而产生较大的峰电位;当流速超过2.0 mL·min-1时,核酸适体与鱼精蛋白的作用时间缩短,使得峰电位值降低。因此,载液流速选用2.0 mL·min-1。
2.2.3进样量对电极性能的影响(图4)
由图4可知,随着进样量的增加,峰电位值升高。这是因为,进样量增加,敏感膜界面处被消耗的鱼精蛋白量增加,从而引起峰电位值升高;当进样量达到80 μL后,鱼精蛋白的消耗量达到饱和,峰电位值不再升高。因此,进样量选用80 μL。
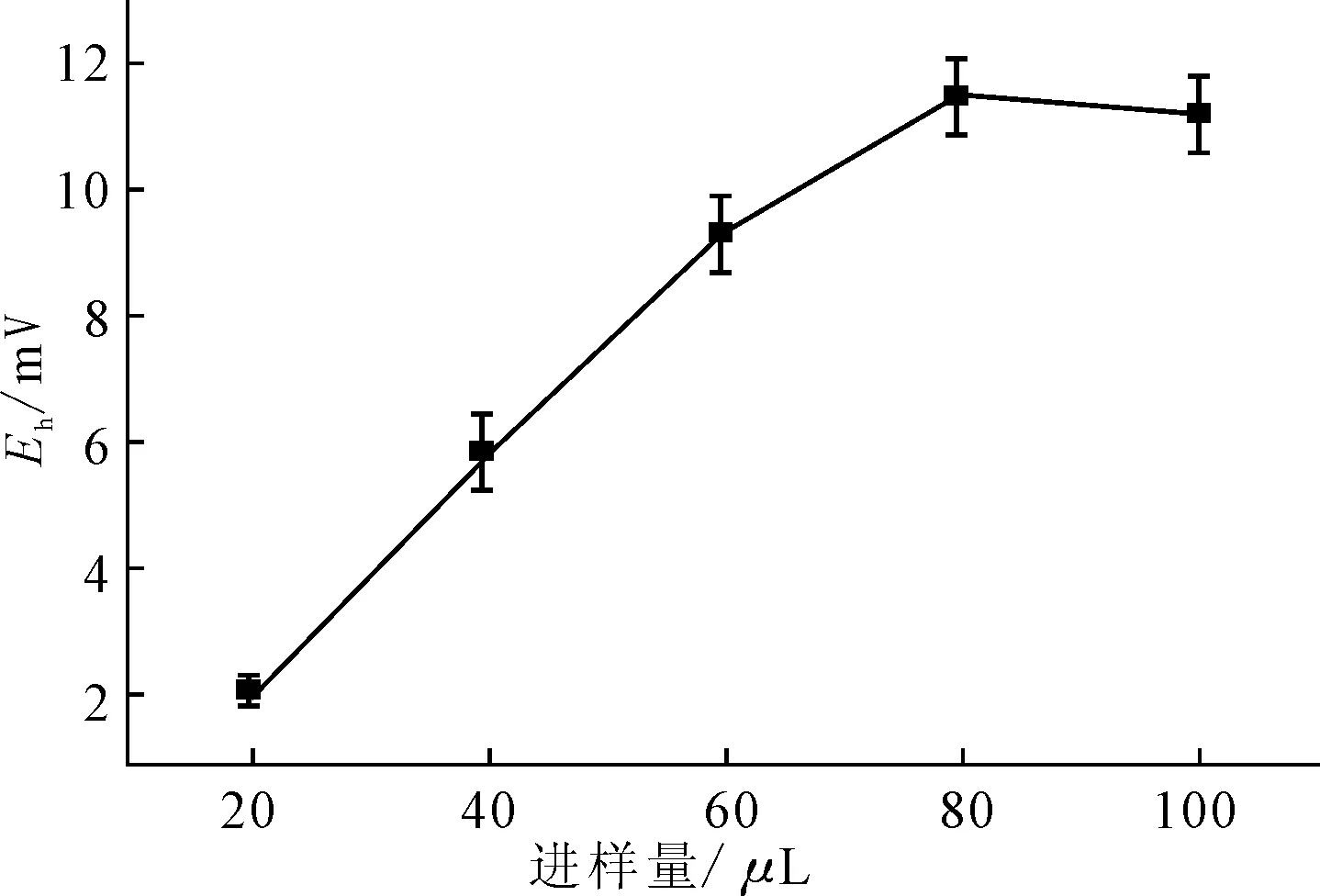
图4 进样量对电位响应的影响
2.3 电极对核酸适体的连续检测
在电流10 nA、载液流速2.0 mL·min-1、进样量80 μL的优化条件下,电极对不同浓度的核酸适体的电位检测结果如图5所示。图中EMF 表示电极电位值,Eh表示电极电位变化值(即峰高),ΔEh表示待测物所引起的电极电位峰高值与背景溶液所引起的电极电位峰高值之差,即扣除背景溶液影响后的峰高值。
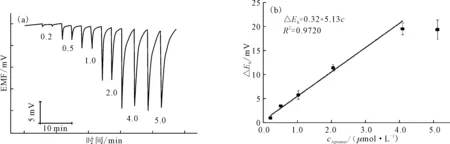
图5不同浓度(μmol·L-1)的核酸适体的电位响应
Fig.5Potentialresponsestoaptameratdifferentconcentrations(μmol·L-1)
由图5可知,在0.2~4.0 μmol·L-1浓度范围内,电极峰电位变化值与核酸适体浓度呈良好的线性关系,线性方程为:△Eh=0.32+5.13c(其中△Eh表示峰电位变化值,mV;c表示核酸适体的浓度,μmol·L-1),相关系数R2=0.9720。本方法对2.0 μmol·L-1核酸适体进行测定的相对标准偏差为1.9%(n=5)。
2.4 电极检测ATP的工作曲线
以2.0 μmol·L-1核酸适体为指示分子,对不同浓度的ATP进行检测,结果见图6。
由图6可知,在2.0~12.0 μmol·L-1浓度范围内,电极峰电位变化值与ATP浓度呈良好的线性关系,其线性方程为:ΔEh=0.90+0.44c(其中ΔEh表示峰电位变化值,mV;c表示ATP样品浓度,μmol·L-1),相关系数R2=0.9687。此时,电极的检出限为1.4 μmol·L-1。本方法对8.0 μmol·L-1ATP进行测定的相对标准偏差为6.3%(n=5)。
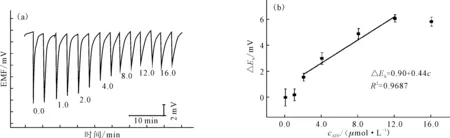
图6不同浓度(μmol·L-1)的ATP的电位响应
Fig.6PotentialresponsestoATPatdifferentconcentrations(μmol·L-1)
3 结论
提出了一种检测ATP的流动注射分析方法。经鱼精蛋白活化的聚离子敏感膜电极被放置在流动分析系统中,可对核酸适体及其目标物质进行电位检测;外加阳极电流能够促进电极表面所消耗的鱼精蛋白的补充,使电极能够快速恢复。本方法的选择性依赖于核酸适体对目标物质的选择性,使用不同的核酸适体作为识别分子,可以实现对不同目标物质的检测。在电流为10 nA、载液流速为2.0 mL·min-1、进样量为80 μL的优化条件下,本方法对ATP检测的线性范围为2.0~12.0 μmol·L-1,检出限为1.4 μmol·L-1。本方法亦可应用于其它聚阴离子(如肝素、透明质酸钠等)的检测。
参考文献:
[1]HARDIE D G,HAWLEY S A.AMP-Activated protein kinase:The energe charge hypothesis revisited[J].Bioessays,2001,23(12):1112-1119.
[2]MANFREDI G,YANG L,GAJEWSKI C D,et al.Measurements of ATP in mammalian cells[J].Methods,2002,26(4):317-326.
[3]ISHIDA A,YOSHIKAWA T,NAKAZAWA T,et al.Enhanced firefly bioluminescence assay of ATP in the presence of ATP extractants by using diethylaminoethyl-dextran[J].Analytical Biochemistry,2002,305(2):236-241.
[4]EGUCHI Y,SHIMIZU S,TSUJIMOTO Y.Intracellular ATP levels determine cell death fate by apoptosis or necrosis[J].Cancer Research,1997,57(10):1835-1840.
[5]FU C G,SONG L N,FANG Y Z.Determination of adenosine phosphate by co-electroosmotic capillary electrophoresis with amperometric detection[J].Analytica Chimica Acta,1999,399(3):259-263.
[6]KIM J,LEE J.Observation and quantification of self-associated adenosine extracted from royal jelly products purchased in USA by HPLC[J].Food Chemistry,2011,126(1):347-352.
[7]HUANG Y F,CHANG H T.Analysis of adenosine triphosphate and glutathione through gold nanoparticles assisted laser desorption/ionization mass spectrometry[J].Analytical Chemistry,2007,79(13):4852-4859.
[8]CRUZ-AGUADO J A,CHEN Y,ZHANG Z,et al.Ultrasensitive ATP detection using firefly luciferase entrapped in sugar-modified sol-gel-derived silica[J].Journal of the American Chemical Society,2004,126(22):6878-6879.
[9]KAMIDATE T,YANASHITA K,TANI H,et al.Firefly bioluminescent assay of ATP in the presence of ATP extractant by using liposomes[J].Analytical Chemistry,2006,78(1):337-342.
[10]OUYANG H X,LIU Q Y,LIANG A H,et al.Nanocatalytic resonance scattering spectral detection of trace ATP using labeled-free nanosilver as probe[J].Acta Chimica Sinica,2011,69(20):2493-2498.
[11]PRIETO M C,MAKI A H,BALHORN R.Analysis of DNA-protamine interactions by optical detection of magnetic resonance[J].Biochemistry,1997,36(39):11944-11951.
[12]DURUST N,MEYERHOFF M E.Determination of DNA and its binding to protamine using potentiometric polyion sensors[J].Journal of Electroanalytical Chemistry,2006,602(1):138-141.
[13]DING J,CHEN Y,WANG X,et al.Label-free and substrate-free potentiometric aptasensing using polycation-sensitive membrane electrodes[J].Analytical Chemistry,2012,84(4):2055-2061.
[14]MA S C,YANG V C,MEYERHOFF M E.Heparin-responsive electrochemical sensor:A preliminary study[J].Analytical Chemistry,1992,64(6):694-697.
[15]MA S C,YANG V C,FU B,et al.Electrochemical sensor for heparin:Further characterization and bioanalytical applications[J].Analytical Chemistry,1993,65(15):2078-2084.
[16]FU B,BAKKER E,YUN J H,et al.Response mechanism of polymer membrane-based potentiometric polyion sensors[J].Analytical Chemistry,1994,66(14):2250-2259.
[17]FU B,BAKKER E,YANG V C,et al.Extraction thermodynamics of polyanions into plasticized polymer membranes doped with lipophilic ion-exchangers:A potentiometric study[J].Macromolecules,1995,28(17):5834-5840.
[18]SHVAREV A,BAKKER E.Reversible electrochemical detection of nonelectroactive polyions[J].Journal of the American Chemical Society,2003,125(37):11192-11193.
[19]BELL-VLASOV A K,ZAJDA J,ELDOURGHAMY A,et al.Polyion selective polmeric membrane-based pulstode as a detector in flow-injection analysis[J].Analytical Chemistry,2014,86(8):4041-4046.
[20]ZHAO Q,Li X,SHAO Y H,et al.Aptamer-based affinity chromatographic assays for thrombin[J].Analytical Chemistry,2008,80(19):7586-7593.

