日本血吸虫重组Bb(pGEX-Sj26GST)疫苗免疫BALB/c小鼠脾细胞动态观察
张 丽,李文桂,谭建蓉
日本血吸虫病是一种严重危害人类健康的人兽共患寄生虫病,其主要流行于中国和菲律宾等国,给流行区的人民身体健康及经济发展造成严重影响。血吸虫病防治的最大难点在于再感染难以阻断,疫苗研究已成为学者公认的血吸虫防治的补充措施。脾脏是人体外周最大的免疫器官,其不仅是各种免疫细胞(B细胞、T细胞和巨噬细胞等)定居的场所,更是初次免疫应答(体液和细胞免疫)和再次免疫应答的场所,因此脾脏细胞学的改变与机体的免疫状态息息相关。本研究在成功构建日本血吸虫重组Bb(pGEX-Sj26GST)疫苗的基础上,动态观察疫苗在不同时间点诱导的BALB/c鼠脾细胞增殖、亚群和凋亡水平,以期为该疫苗的保护性免疫机制研究提供有意义的材料。
1 材料与方法

1.2实验动物及免疫方案 96只20~25 g,12~14周龄清洁级雌性BALB/c鼠购自重庆医科大学实验动物中心。将小鼠随机分为两组,每组48只,鼻腔黏膜接种组(IN):每只小鼠单次鼻腔粘膜接种105克隆形成单位(colony forming unit,CFU)/10 μL疫苗;皮下注射组(SC):每只小鼠单次皮下注射106CFU/100 μL疫苗,直至实验结束均无小鼠死亡。
1.3脾细胞的制备 免疫后0~20周,两组各随机剖杀4只小鼠,无菌取脾置200目尼龙网磨碎,用1 mL 0.85%的生理盐水冲洗,滤液置10 mL离心管中,加入4 mL双蒸水使渗透压降至0.15%以溶解红细胞,再加入1.34 mL 3.6%的生理盐水使其恢复等渗,用0.85%生理盐水冲洗两次,3 000 r/min(离心半径11 cm)离心10 min,去上清,加入10 mL 0.85%的生理盐水混匀,调制细胞数为5×106/mL,上述相同条件离心,弃上清,加入10 mL含10%胎牛血清的RPMI 1640培养液,再加入青霉素(1 000 U/mL)及链霉素(10 mg/mL)各100 μL混匀。
1.4脾细胞增殖的检测 将上述调制好浓度的脾细胞加入24孔培养板,每个标本设3孔,分别加入1 mL原液、1 mL原液+10 μg的SjAWA和1 mL原液+10 μg的ConA,再加入5 μg/mL的MTT 10 μL/孔,混匀,置37 ℃、5% CO2孵箱中培养18 h,弃上清150 μL/孔后,加入DMSO 150 μL/孔,反复吹打使形成的甲臜充分溶解后,于570 nm处检测OD值。

1.6Annexin V-FITC染色法检测脾细胞凋亡 上述脾细胞加入24孔细胞计数培养板,每个标本设置两组,分别加入700 μL原液及700 μL原液和10 μg ConA的混合物,于37 ℃、5%的CO2孵箱中培养16~18 h。收集培养板中的脾细胞于1.5 mL的EP管中,3 000 r/min(离心半径11.5 cm)离心3 min,加入4 ℃预冷的磷酸盐缓冲液(PBS)1 mL混匀,3 000 r/min离心3min,重复1次,加入250 mL的结合缓冲液充分混匀,调整细胞浓度为1×106/mL,加入20 μg/mL的碘化丙啶溶液(PI)10 μL及Annexin V-FITC 5 μL混匀,室温避光孵育15 min,流式细胞仪记录FITC标记的凋亡细胞在波长为495 nm紫外光激发下产生的525 nm的绿色荧光剂PI标记的凋亡及坏死细胞在波长为340 nm紫外光激发下产生的620 nm的红色荧光,CellQuet软件分析细胞凋亡。
2 结 果
2.1脾细胞增殖 未刺激及SjAWA刺激时SC组小鼠脾细胞增殖水平于免疫后4~20周明显升高,ConA刺激时于4~18周升高显著,均于免疫后8周达最高水平(与0周比差异具有统计学意义,P<0.05或0.01);IN组中原液组于2~18周升高,SjAWA刺激组在2~10周及14~18周升高,ConA刺激组于2~8周及12~18周升高,均于免疫后4周达最高水平(与0周比差异具有统计学意义,P<0.05或0.01);同一时间点两组ConA组显著高于相应的SjAWA组,SjAWA组明显高于相应的原液组(P<0.05或0.01);两种免疫途径无明显差异,但IN组早于SC组达最大值(表1)。
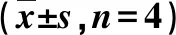
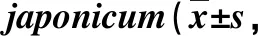
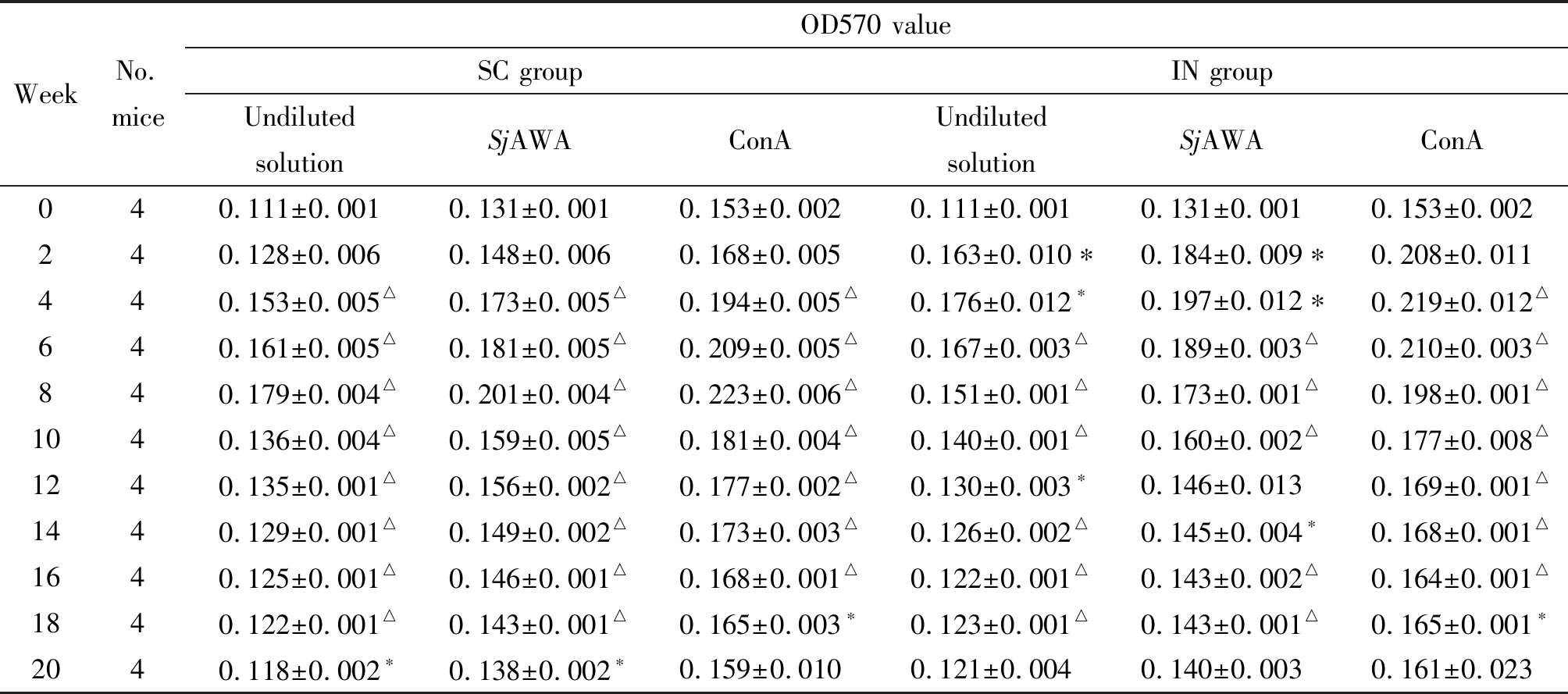
WeekNo.miceOD570 valueSC groupIN groupUndilutedsolutionSjAWA ConAUndilutedsolutionSjAWA ConA040.111±0.0010.131±0.0010.153±0.0020.111±0.0010.131±0.0010.153±0.002240.128±0.0060.148±0.0060.168±0.0050.163±0.010∗0.184±0.009∗0.208±0.011440.153±0.005△0.173±0.005△0.194±0.005△0.176±0.012∗0.197±0.012∗0.219±0.012△640.161±0.005△0.181±0.005△0.209±0.005△0.167±0.003△0.189±0.003△0.210±0.003△840.179±0.004△0.201±0.004△0.223±0.006△0.151±0.001△0.173±0.001△0.198±0.001△1040.136±0.004△0.159±0.005△0.181±0.004△0.140±0.001△0.160±0.002△0.177±0.008△1240.135±0.001△0.156±0.002△0.177±0.002△0.130±0.003∗0.146±0.0130.169±0.001△1440.129±0.001△0.149±0.002△0.173±0.003△0.126±0.002△0.145±0.004∗0.168±0.001△1640.125±0.001△0.146±0.001△0.168±0.001△0.122±0.001△0.143±0.002△0.164±0.001△1840.122±0.001△0.143±0.001△0.165±0.003∗0.123±0.001△0.143±0.001△0.165±0.001∗2040.118±0.002∗0.138±0.002∗0.159±0.0100.121±0.0040.140±0.0030.161±0.023
Note: vs.0 week,*P<0.05,△P<0.01.

2.3脾细胞凋亡 未刺激和ConA刺激时SC组脾细胞凋亡水平分别于免疫后2~4周、2~6周升高显著,均于免疫后2周达最大值(P<0.01或P<0.05);IN组均于4周显著升高并达峰值(P<0.01)。同一时间点两组ConA组脾细胞凋亡水平均高于相应的原液组(P<0.01),两种免疫途径无统计学差异,但SC组先于IN组达最峰值(表3)。
3 讨 论
研究发现日本血吸虫成虫诱导的淋巴细胞增殖反应与抵抗再感染相关[1],提示脾细胞的增殖、分化在宿主免疫应答的调节方面具有重要作用,测定脾淋巴细胞增殖能力可作为反映免疫能力的一个重要指标。赵晶晶等[2]发现,BALB/c小鼠感染日本血吸虫后6~8周,脾脏体积增大,质量增加,淋巴细胞数目也明显增多,提示日本血吸虫感染,将导致宿主脾细胞增殖,发挥保护性免疫效应。本研究发现SC组小鼠脾细胞水平于免疫后4周开始明显升高,并于8周达峰值,而IN组从免疫后2周开始显著升高,于4周达最高值,表明该疫苗在早期即可诱导脾细胞增殖反应;且同一时间点SjAWA和ConA刺激组脾细胞增殖水平均高于相应的原液组,而ConA刺激组高于SjAWA组,可能因为SjAWA为特异性刺激物,而ConA能非特异性的促进所有淋巴细胞的增殖;提示该疫苗可诱导宿主产生较强的细胞免疫。
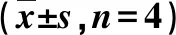
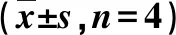
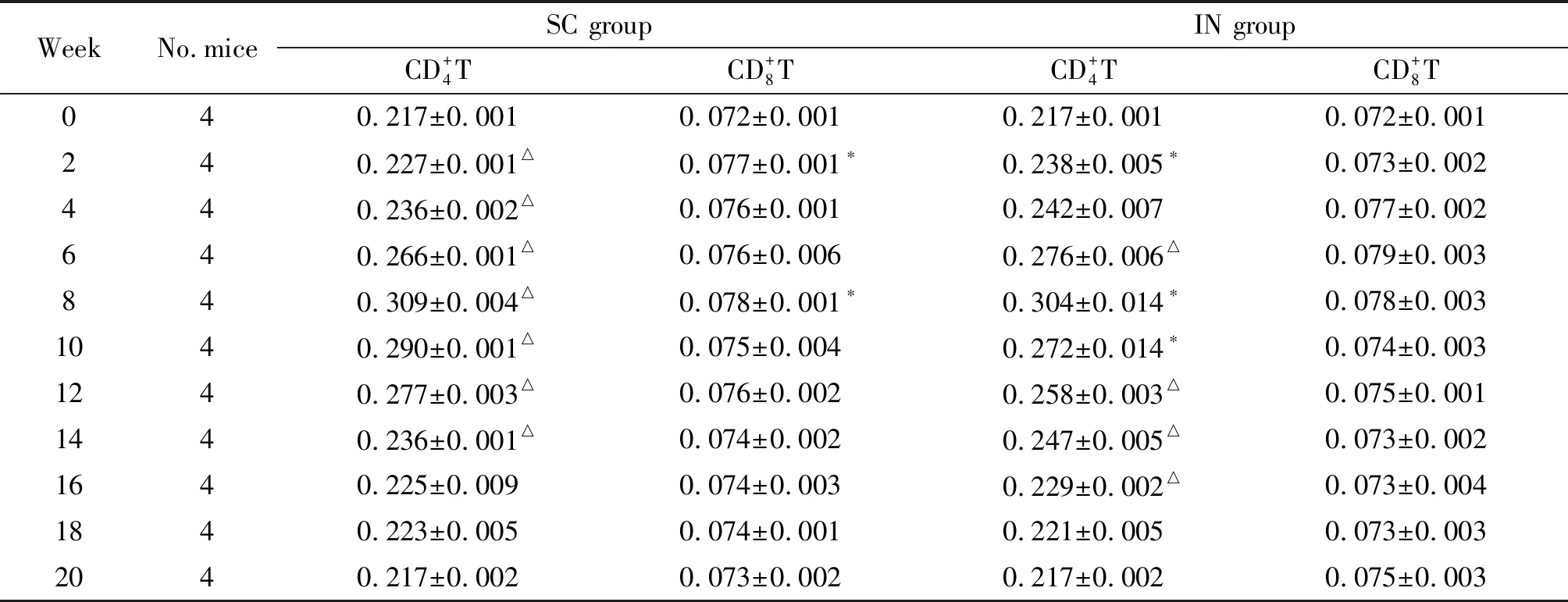
WeekNo.miceSC groupIN groupCD+4T CD+8T CD+4T CD+8T040.217±0.0010.072±0.0010.217±0.0010.072±0.001240.227±0.001△0.077±0.001∗0.238±0.005∗0.073±0.002440.236±0.002△0.076±0.0010.242±0.0070.077±0.002640.266±0.001△0.076±0.0060.276±0.006△0.079±0.003840.309±0.004△0.078±0.001∗0.304±0.014∗0.078±0.0031040.290±0.001△0.075±0.0040.272±0.014∗0.074±0.0031240.277±0.003△0.076±0.0020.258±0.003△0.075±0.0011440.236±0.001△0.074±0.0020.247±0.005△0.073±0.0021640.225±0.0090.074±0.0030.229±0.002△0.073±0.0041840.223±0.0050.074±0.0010.221±0.0050.073±0.0032040.217±0.0020.073±0.0020.217±0.0020.075±0.003
Note: vs.0 week,*P<0.05,△P<0.01.
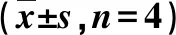
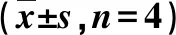

WeekNo.miceSCGroup INGroupUndiluted solutionConA group Undiluted solution ConA group040.027±0.0000.051±0.0010.027±0.0000.051±0.001240.087±0.002△0.112±0.003△0.027±0.0010.048±0.002440.076±0.009∗0.104±0.007△0.087±0.005△0.107±0.005△640.031±0.0020.053±0.000△0.036±0.0060.056±0.006840.029±0.0010.051±0.0010.029±0.0030.050±0.0021040.028±0.0020.050±0.0020.029±0.0030.051±0.0031240.027±0.0030.049±0.0030.028±0.0010.049±0.0011440.027±0.0010.049±0.0010.025±0.0000.047±0.0011640.027±0.0010.049±0.0010.026±0.0020.048±0.0021840.027±0.0000.049±0.0000.026±0.0010.048±0.0012040.027±0.0010.049±0.0010.026±0.0010.047±0.002
Note: vs.0 week,*P<0.05,△P<0.01.

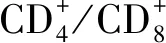

参考文献:
[1]Roberts M, Butterworth AE, Kimani G, et al. Immunity after treatment of human schistosomiasis: association between cellular responses and resistance to reinfection[J]. Infect Immun, 1993, 61(12): 4984-4993.
[2]Zhao JJ, Hang J, Mai JY, et al. Changes of cytology of spleen in BALB/c infected withSchistosomajaponicum[J]. J Trop Med, 2009, 9(2): 140-143, 154. (in Chinese)
赵晶晶,黄俊,麦璟莹,等.日本血吸虫感染BALB/c小鼠脾脏细胞学的变化[J].热带医学杂志,2009,9(2):140-143,154.
[3]Wang WS, Li YL. Studies on relationship between immune inhibition and apoptosis of T cells in mice infected withSchistosomajaponicum[J]. Chin J Schisto Ctrl, 2000, 12(5): 257-260. (in Chinese)
王文实,李雍龙.日本血吸虫感染的免疫抑制现象与T细胞凋亡的关系研究[J].中国血吸虫病防治杂志,2000,12:257.
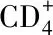
[5]Li WG, Shi YE. Study on changes of T lymphocyte subsets in mice immunized by BCG-Sj26GST vaccine againstSchistosomajaponicum[J]. Chin J Zoonoses, 2000, 16(2): 56-58. DOI: 10.3969/j.issn.1002-2694.2000.02.017 (in Chinese)
李文桂,石佑恩.血吸虫重组BCG-Sj26GST疫苗诱导小鼠T淋巴细胞亚群变化的研究[J].中国人兽共患病杂志,2000,16(2):56-58.
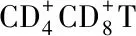
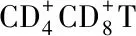
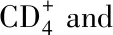
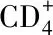
[8]Zhang N, Li WG. Dynamic observation on splenocyte apoptosis in mice immunized with recombinantBifidobacteriumbifidumpGEX-Sj14-3-3 ofSchistosomajaponicum[J]. Chin J Endem, 2012, 31(6): 604-607. DOI: 10.3760/cma.j.issn.1000-4955.2012.06.004 (in Chinese)
张宁,李文桂.日本血吸虫重组Bb(pGEX-Sj14-3-3)疫苗免疫BALB/c小鼠脾细胞凋亡的动态观察[J].中国地方病学杂志,2012,31(6):604-607.
[9]Xu XY, Zhao JQ, Chi Y, et al. Detection of apoptosis of Th1 and Th2 cells in C57BL/6 mice chronically infected withSchistosomajaponicum[J]. Chin J Schisto Ctrl, 2008, 20(1): 8-11. DOI: 10.3969/j.issn.1005-6661.2008.01.02 (in Chinese)
许馨予,赵嘉庆,迟莹,等.慢性日本血吸虫感染C57BL/6小鼠体内Th1/Th2胞凋亡的检测[J].中国血吸虫病防治杂志,2008,20(1):8-11.


——以江苏省为例

