布鲁氏菌外膜蛋白 VirB4在感染胚胎滋养层细胞中的作用分析
孙志华,刘良波,张 豫,刘 娟,韩玉霞,刘来珍,郭 乾,陈创夫,张 辉
布鲁氏菌病(Brucellosis)是由布鲁氏菌(Brucella)引起的动物源性人兽共患传染病[1]。属“家畜、家禽防疫条例实施细则”中二类传染病,在世界范围内广泛流行,尤其在中国,近年来,全世界范围内有回升的势头[2]。布鲁氏菌是一种兼性胞内寄生菌,革兰氏染色阴性,可引起天然宿主网状内皮系统持续性感染[3]。在家畜和野生动物中,主要引起雌性的流产、繁殖生育能力的下降;致使雄性发生睾丸炎、附睾炎,最终发展为不育症。人感染后出现“波浪热”,心内膜炎,脑炎以及关节和腰部脊柱疼痛等症状[4]。在急性感染期,布鲁氏菌可侵袭胎盘绒毛膜的滋养层细胞,容易引起母畜流产,但是其分子机制目前尚不完全清楚[5]。巨噬细胞和胚胎滋养细胞是布鲁氏菌主要宿主细胞,virB区编码的Ⅳ型分泌系统(T4SS)在布鲁菌感染宿主过程中发挥着重要作用[6-7]。布鲁氏菌T4SS由virB操纵子编码,共12个基因(virB1-virB12);由同一启动子调控,是一个多蛋白的跨膜复合物,受宿主细胞类型、生长温度、营养条件、pH值等因素调控[8]。其中VirB4暴露于细胞液中,有一个完整的三磷酸核苷酸结合区,对物质的运输起重要作用。进一步的研究表明,virB4是流产相关基因[9]。Kim[10]等采用缺失virB4基因的牛种布鲁氏菌疫苗株S19的突变株接种孕期母鼠,发现突变株可以在胎盘中繁殖,其侵染力和繁殖力下降,不会引起流产。由此可见布鲁氏菌VirB4蛋白与侵染宿主引起的流产密切相关。因此,探索布鲁氏菌Ⅳ型分泌系统的毒力因子和滋养层细胞靶蛋白的结合机制,为进一步阐明布鲁氏菌胞内寄生机制提供理论依据。
1 材料与方法
1.1实验材料
1.1.1菌株 酿酒酵母菌株AH109(MATα表型)、酿酒酵母菌株Y187(GMATa表型)均购自Clontech公司,布鲁氏菌RB51株和大肠杆菌E.coliDH5α为本实验室保存。
1.1.2试剂 胶原酶Ⅰ购自美国Gibco公司;TGS购自上海麦莎生物科技有限公司;荧光素酶标记羊抗鼠IgG购自北京博奥森生物技术有限公司;RNA提取试剂Trizol购自Invitrogen公司;cDNA文库构建试剂盒、双链cDNA纯化试剂盒、酵母感受态细胞的制备试剂盒、YPD培养基,SD/-Leu等营养选择性培养均购自Clotech公司;酵母质粒抽提试剂盒、SYBR Green荧光染料均购自北京天根生化科技有限公司;T4 DNA连接酶试剂盒,DNA Marker购自北京天为时代有限公司;限制性内切酶NdeI/PstI购自上海生工生物工程技术服务公司;Taq DNA聚合酶、dNTPs、普通琼脂糖凝胶DNA回收试剂盒、pMD18-T克隆载体、离心柱型质粒小题试剂盒均购自天根生化科技有限公司;其他试剂均为国产分析纯。
1.2试验方法
1.2.1牛胚胎滋养层细胞的分离与培养 取怀孕45~60 d母牛完整子宫,无菌条件下收集胎儿子叶,采用胶原酶消化方法分离胚胎滋养层细胞,经培养纯化达到实验要求后备用。
1.2.2布鲁氏菌侵染牛胚胎滋养层细胞 cDNA文库的构建 布鲁氏菌RB51以100∶1(细菌个数∶细胞个数)的比例侵染牛胚胎滋养层细胞,提取侵染后滋养层细胞总RNA,然后逆转录20 μL 的cDNA,再以cDNA为模板进行PCR检测。
1.2.3布鲁氏菌virB4基因酵母表达载体的构建
1.2.3.1目的基因的扩增 设计并由上海生工合成virB4基因的引物,其上游:5′-CATATGGGCGCTCAATCCAAATAC-3′;下游:5′-CTGC
AGTCACCTTCCTGTTGATTTGGAC-3′。PCR
反应体系(20 μL):10×PCR buffer 2 μL,dNTP 0.8 μL,上、下游引物各0.2 μL,模板2 μL,Taq DNA聚合酶0.5 μL,去离子水14.3 μL。反应条件:94 ℃ 1 min,57 ℃ 1 min,72 ℃ 2 min 40 s。用1%琼脂糖凝胶电泳检测扩增结果,回收目的片段,连接pMD18-T载体,转化E.coliDH5α感受态,在含Amp(50 μg/mL)的 LB平板上筛选阳性菌落,经菌液 PCR鉴定后,摇菌,进行酶切和测序鉴定。
1.2.3.2酵母表达载体的构建 连接目的基因virB4和pGBKT7得到诱饵质粒 pGBKT7- virB4;将 pGBKT7-virB4重组子转化至E.coliDE3感受态细胞,混匀、冰浴、热击转化后均匀涂布于于含Kan(50 μg/mL)的LB平板上;挑取 PCR鉴定阳性的菌落于LB液体培养基中过夜培养,提取质粒,-20 ℃保存,备用。
1.2.3.3pGBKT7-virB4重组质粒的转化 选取SD/-Leu和SD/-His阴性、SD/-Ura和YPDA阳性的酿酒酵母菌株Y187按Clontech公司的YeastmakerTMYeast Transformation System 2说明书制备感受态细胞;采用醋酸锂法将 pGBKT7-virB4重组质粒转化至新制备的酿酒酵母菌Y187感受态细胞中,涂布于SD/-Trp/Kan(20 μg/mL)平板上,30 ℃培养4 d;对长出的转化子进行菌落PCR扩增,经1%琼脂糖凝胶电泳后在凝胶显像系统中观察。
1.2.3.4酿酒酵母菌Y187(pGBKT7-virB4)自激活检测和毒性检测 将酿酒酵母菌Y187(pGBKT7-virB4)涂于 SD/-Trp和 SD/-Trp-His平板上,30 ℃培养4~5 d,观察 SD/-Trp和 SD/-Trp-His平板上菌落的生长情况;从SD/-Trp平板上挑选单个菌落进行X-α-Gal分析,挑取酿酒酵母菌Y187阳性转化子接种到80 mL SD/-Trp/Kan(20 μg/mL)液体培养基上,30 ℃培养20 h,检测菌液的 OD值。
1.2.4酵母双杂交筛选与布鲁氏菌VirB4相互作用的滋养层细胞捕获蛋白
1.2.4.1酵母双杂交阴、阳性对照体系的建立 将 pGADT7-T转化AH109酵母感受态细胞作为对照prey 体系;将pGBKT7-53与pGBKT7-Lam转化Y187酵母感受态细胞作为对照bait体系。挑取携带有pGADT7-T质粒的AH109菌斑与携带有pGBKT7-53质粒的Y187菌斑,将两种菌斑置于盛有500 μL 2×YPD 的1.5 mL离心管中,30 ℃,40 r/min摇菌培养20 h,离心弃上清,500 μL 2×YPD悬浮沉淀,取100 μL涂于SD/Ade/-His/-Leu/-Trp/X-α-Gal 平板上,30 ℃ 倒置培养4 d。
1.2.4.2pGBKT7-virB4 与滋养层细胞cDNA 捕获文库的互作试验 分别挑取携带有 pGBKT7-virB4 的Y187菌斑接种到100 mL SD/-Trp/Kanr(50 μg/mL)液体培养基,30 ℃ 恒温箱,54 r/min培养20 h,离心浓缩菌落,使菌落浓度≥1×109cells/mL;从-80℃冰箱中取出一管分装的浓度大于2×107cells/mL的5 mL的冻存管的酵母菌AH109 (pGADT7-cDNA liberary),融化后,向灭菌处理的2 L三角瓶中依次加入45 mL 2×YPD/Kanr(50 μg/mL)、2 mL酵母菌 AH109(pGADT7-cDNA liberary)、5mL Y187(pGBKT7-virB4),无菌处理后,30 ℃ ,54 r/min摇菌培养20 h,离心弃上清,用50 mL 0.5×YPD/Kanr(50 μg/mL)洗涤两次,用1 mL 0.5×YPD/Kanr(50 μg/mL)重悬沉淀,将菌悬液平均涂50个直径为150 mm的SD/-Ade/-His/-Leu/-Trp平板,30 ℃ 倒置培养4 d。
1.2.4.3阳性菌落的 X-α-Gal 蓝斑筛选 将在SD/-Ade/-His/-Leu/-Trp 平板上长出的菌落转接于的SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板上。置于30 ℃培养温箱,观察并记录。
1.2.4.4阳性菌落的质粒提取及鉴定 将SD/-Ade/-His/-Leu/-Trp/X-α-Gal平板上变蓝的酵母菌分别接种到SD/-Ade/-His/-Leu/-Trp液体培养基上,30 ℃ 培养,250 r/min培养72 h,用酵母小提质粒试剂盒进行质粒提取并用1.2 %琼脂糖凝胶电泳分析。
1.2.5特异结合蛋白辅酶 Q10和 SLC3A2 的 mRNA 表达检测
1.2.5.1引物的设计和合成 依据 GenBank所收录的全序列,采用 Primer 5.0软件设计辅酶 Q10和 SLC3A2的引物序列,辅酶 Q10上游:5′-CCCGTCGATGTTTAGAGGAA-3′,下游5′-TTTGTCCAGCACACACTCGT-3′; SLC3A2上游:5′-ACCCCAGTGTTCAGCTATGG-3′,下游为:5′-ATGCTGAGGTGTTGGGAAAG-3′。
1.2.5.2目的基因 PCR 扩增及产物的纯化 以100∶1(细菌个数∶细胞个数)的比例,用布鲁氏菌RB51和S19株侵染滋养层细胞。用 TRIZOL试剂盒提取总RNA,反转录为cDNA后为模板,用PCR方法扩增得到辅酶 Q10和 SLC3A2的基因片段。PCR扩增体系(20.0 μL):10×反应缓冲液(含15.0 mmol/L MgCl2) 2.0 μL,dNTP(各2.5 mmol/L) 0.8 μL,上、下游引物各(25 μmol/L)0.2 μL,模板2 μL,Taq DNA聚合酶(2.5 U/μL) 0.5 μL,补水至20.0 μL;PCR反应条件:95 ℃ 4 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;最后72 ℃延伸7 min。PCR产物进行1.5 %琼脂糖凝胶电泳分析,并以琼脂糖凝胶DNA回收纯化试剂盒进行纯化,操作方法按产品说明书进行。
1.2.5.3实时定量RCR检测mRNA表达量的变化 构建pMD18-T-Q10和pMD18-T-SLC3A2质粒,挑选阳性克隆,进行菌液PCR鉴定,提质粒。经鉴定正确后的阳性质粒作为标准品备用。用微量紫外分光光度计测定 A260/280质粒浓度,做记录后,按公式算成拷贝数后,将其10倍系列稀释成含有101~109的9个梯度,作为模板,在12.5 μL PCR反应体系中加入:上,下游引物各0.5 μL,模板1 μL,SYBR 6.25 μL,补水至12.5 μL;按实时定量PCR反应3步法在 MaXro3000实时荧光定量 PCR仪进行,数据被收集后,绘制扩增曲线,标准曲线和熔解曲线,利用制作的标准曲线比较经布鲁氏菌RB51和S19侵染前后蛋白表达量的变化。
2 结 果
2.1cDNA文库的建立
2.1.1总RNA检测结果 1%甲醛变性琼脂糖凝胶电泳显示28S、18S和5.8S rRNA条带清晰,28S rRNA与18S rRNA的比例约为2∶1,总 RNA的完整性良好(图1)。分光光度计检测3.5 h提取的总RNA纯度,测得A260/280值分别为1.90,表明总 RNA纯度较高。LD-PCR产物经1%琼脂糖凝胶电泳,可见文库ds cDNA呈瀑布状分布,大小在0.2~4 kb范围,在接近1 kb左右的区域较为密集(图2)。
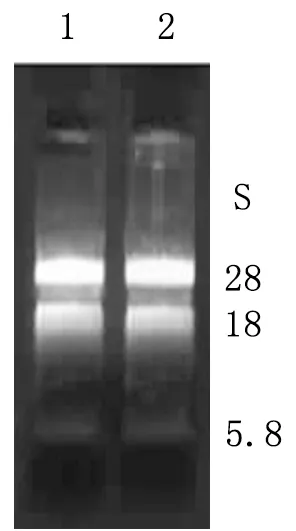
图1 总RNA凝胶电泳

图2LD-PCR凝胶电泳
Fig.2DetectionofLD-PCRproducts
1: LD-PCR products; M: Marker IV
2.2cDNA文库的筛选
2.2.1文库转化效率检测结果 对随机选取10个平板进行菌落计数,计算出1个平板的平均菌落数为650个,共计200个平板,则cDNA文库库容量为1.3×106个转化子,即在3 μg pGADT7-Rec(0.5 μg/μL)线性化载体中,有1.3×106个载体发生重组,达到了建库的要求,即> 1×106转化子/3 μg pGADT7-Rec。
2.2.2cDNA 文库的污染检测结果 将回收后的cDNA文库的平均涂于5个直径为150 mm SD/-Leu YPD平板 30 ℃恒温培养3 d后,未见霉斑、丝状物等出现,说明回收的文库没有受到污染。
2.2.3cDNA文库插入片段长度评价结果 从平板上随机挑取65个单克隆,提取质粒,用文库扩增引物扩增插入片段,进行琼脂糖电泳,图3中是其中的23个克隆,结果表明该文库的 cDNA插入片段在0.2~5.0 kb之间。
2.3与 virB4 互作蛋白的初步验证
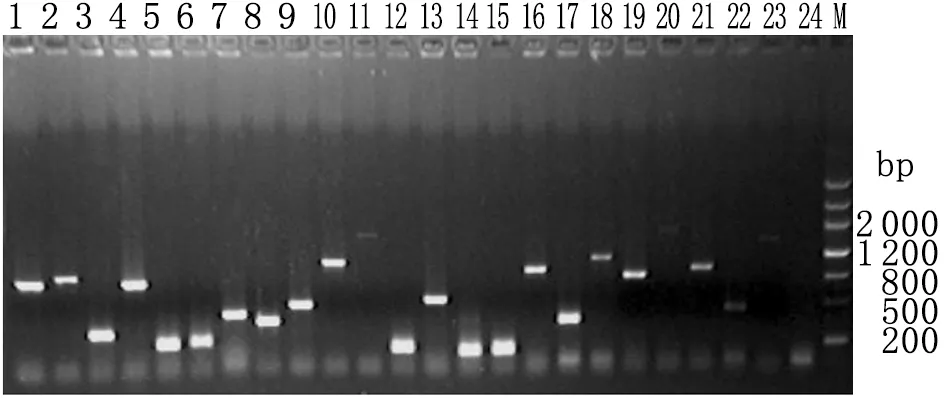
图3cDNA文库插入片段的PCR鉴定
Fig.3DetectionofinsertsofcDNAlibrary
1-23: Clones of cDNA library; 24: Negative control.
2.3.1pGBKT7-virB4 的PCR和酶切鉴定结果 菌落PCR扩增片段大小在2 000~3 000 bp之间,与预期结果2 496 bp一致。pGBKT7-virB4质粒经NdeI/PstI双酶切后,电泳结果与预期(2 496 bp)相符(见图4)。

图4重组质粒pGBKT7-virB4的PCR扩增
Fig.4PCRamplificationofrecombinantplasmidpGBKT7-virB4
1-5: pGBKT7-virB4 PCR product; 6: Positive control; 7: Negative control
2.3.2转化子Y187的鉴定 以SD/-Trp/Kan20 μg/mL固体培养基长出的菌落为模板进行PCR鉴定,结果出现1条约2 596 bp的 DNA片段,大小与目标片段一致(图5)。
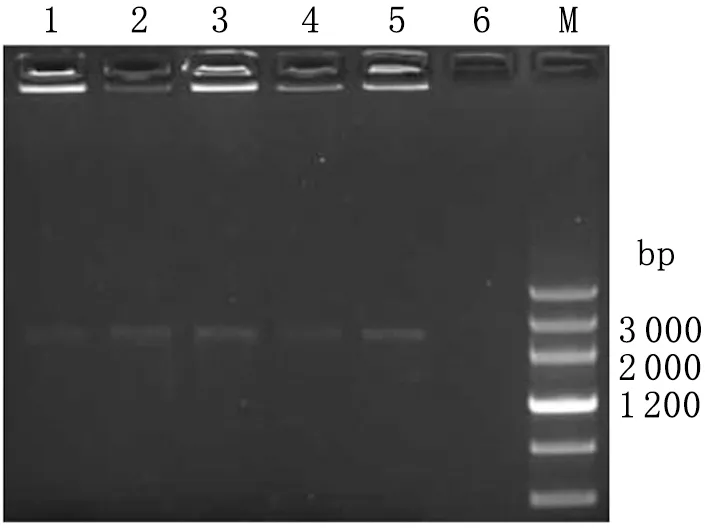
图5Y187转化子PCR鉴定
Fig.5Y187transformantamplifiedbyPCR
1-5: PCR product; 6: Negative control.
2.3.3自激活检测和毒性检测 经过培养,SD/-Trp平板上长出100个左右的直径为2~3 mm的菌落;在SD/-Trp-His平板上没有菌落出现;经X-α-Gal分析无蓝色菌落出现,表明无自激活活性。挑取酵母菌Y187阳性转化子接种到80 mL SD/-Trp/Kan(20 μg/mL)液体培养基上,30 ℃,250 r/min培养20 h,菌液的OD值大于0.8,表明Y187阳性转化子无毒性。
2.3.4酵母双杂交阴性、阳性对照结果 酵母菌株AH109 (pGADT7-T)与酵母菌株Y187 (pGBKT7-53)经配合后,在SD/Ade/-His/-Leu/-Trp/X-α-Gal的平板上长出直径为2~3 mm的蓝色菌落,而在SD/-Ade/-His/-Leu/-Trp/X-α-Gal未长出菌落。
2.3.5VirB4诱饵蛋白 X-α-Gal筛选 酵母菌株 AH109 (pGADT7-liberary)与酵母菌株Y187(pGBKT7-virB4)经配合后,在SD/-Ade/-His/-Leu/-Trp的平板上长出直径为2~3 mm的菌落。
再将这些菌落转接到SD/-Ade/-His/-Leu/-Trp/X-α-Gal,部分菌落变蓝(图6)。

图6 VirB4 诱饵蛋白筛选阳性结果
2.3.6VirB4诱饵蛋白基因捕获 prey 蛋白基因的序列分析 pGBKT7-virB4诱饵质粒最终获得13个阳性AD质粒,Blastn序列分析结果(见表1)。

表1 阳性AD质粒Blastn分析结果
2.3.7侵染前后辅酶Q10和SLC3A2基因表达量的变化 基因辅酶Q10的标准曲线方程:y=-3.52×LOG(X)+40.34,相关系数为0.998,扩增效率为89.8%。基因SLC3A2的标准曲线方程:y=-4.147×LOG(X)+45.94,相关系数为0.993,扩增效率为74.2%。同样的标准曲线条件下,检测布鲁氏菌S19和RB51侵染前后辅酶Q10基因和SLC3A2基因表达量的前后变化(以未侵染的cDNA为对照),测得各自的扩增曲线,发现侵染后辅酶Q10和SLC3A2的表达量均提高了(图7)。
3 讨 论
布鲁氏菌是兼性胞内寄生菌[11],胚胎滋养层细胞是布鲁氏菌侵染的靶细胞。胚胎滋养层细胞受到损伤会引发强烈的炎症反应,影响胎儿向母体的植入,容易引发母畜流产[12]。布鲁氏菌不产生外毒素,布鲁氏菌的毒力主要表现在其侵袭力以及在宿主内的生存和繁殖能力。因此,布鲁氏菌的毒力因素一直是布病病原学中重要的研究问题之一,与布鲁氏菌病的发病机理、免疫机制乃至临床治疗和预防等息息相关。布鲁氏菌侵入细胞形成布氏小体后,能有效的阻止布氏小体和溶酶体融合,致使布鲁氏菌能在细胞中寄生、繁殖。本文研究病原外膜蛋白与宿主细胞间的互作为布鲁氏菌新型药物的研发、家畜布病预防和治疗提供科学依据。

图7布鲁氏菌侵染前后辅酶Q10和SLC3A2基因表达量的变化
Fig.7ExpressionofcoenzymeQ10andSLC3A2geneafterBrucellainfection
virB是布鲁氏菌毒力基因,与宿主细胞胞内生存、复制有关。1999年,T4SS首次由O’Callaghan[13]在猪布鲁氏菌中发现,该系统是一个复合体,由12个跨越细菌胞壁的不同蛋白构成,形成一个操纵子,是细菌在宿主细胞内复制和持续感染不可缺少的。VirB结构的改变直接影响到布鲁氏菌外膜的结构和性质,直至影响到布鲁氏菌的胞内适应和存活[8]。VirB1是T4SS非必需的组件;VirB3、VirB6、VirB7、VirB8、VirB9、VirB10分布于胞膜孔道中可以传送信号;VirB4和VirB11是两个ATP酶分子,其中VirB4有一个完整的ATP结合区。Kim[10]等采用缺失VirB4基因的牛种布鲁氏菌疫苗株S19的突变株接种孕期母鼠,发现突变株可以在胎盘中繁殖,其侵染力和繁殖力下降,不会引起流产。可见,布鲁氏菌VirB4蛋白与侵染宿主引起流产密切相关,在本研究中筛选牛种布鲁氏菌疫苗株VirB4蛋白在侵染牛胚胎滋养层细胞过程潜在的结合靶蛋白,为揭示牛种布鲁氏菌感染与母畜流产之间的分子作用机制奠定基础。另外,本实验中克隆的VirB4基因,与参考株基因的同源性很高,有4个突变位点,全部为有义突变,所以表达的蛋白也会和参考株不一样,毒力是否受到了影响需进行进一步研究探讨。
辅酶Q10在细胞内与线粒体内膜结合,参与细胞氧化磷酸化及ATP生成过程,是呼吸链中重要的递氢体[14-15],是细胞自身产生的天然抗氧化剂和细胞代谢的激活剂,能够提高有机体的免疫力。Folkers K[16]报道了老鼠服用了辅酶Q10能提高机体免疫细胞杀死细菌的活力,激发免疫球蛋白和抗体数量。本研究证实布鲁氏菌侵染宿主细胞后引起VirB4互作的靶蛋白辅酶Q10的表达量具有明显升高,这可能是布鲁氏菌侵染宿主细胞后的应激反应,促使辅酶Q10表达量提升,表明其在布鲁氏菌引发的致炎过程中起重要作用。SLC3A2是一个II型跨膜蛋白,具有催化钙:钠逆向运输蛋白的功能;与糖代谢、钙离子运输、氨基酸运输、细胞生长相关[17]。Ca2+达到一定浓度后,启动一系列病理生理机制损伤神经细胞,诱导细胞凋亡、甚至死亡,而SLC3A2催化Na+-Ca2+逆向运输蛋白[18]。本研究也证实了布鲁氏菌侵染引起SLC3A2表达量升高,这可能在布鲁氏菌侵染过程中抑制细胞凋亡具有重要的意义。辅酶Q10和SLC3A2与VirB4特异结合的蛋白的表达量升高说明了其在布鲁氏菌侵染滋养层细胞的过程中发挥作用,但具体生物学功能需进行更深入的研究。
本研究成功构建牛种布鲁氏菌疫苗株RB51侵染牛胚胎滋养层细胞cDNA文库;筛选出布鲁氏菌疫苗株RB51的VirB4蛋白在侵染牛胚胎滋养层细胞过程作用的13种蛋白,并通过实时定量PCR检测了特异结合蛋白辅酶Q10和SLC3A2的表达量在布鲁氏菌侵染后都增加了;试验中对VirB4蛋白与宿主细胞的互作研究为进一步阐明布鲁氏菌感染宿主细胞的发病机制奠定了基础。
参考文献:
[1]Yi XP, Gu WX, Wu DL, et al. Biological characteristics of vaccine candidate A19-ΔVirB12 mutant strain ofBrucellaabortus[J]. Chin J Zoonoses, 2012, 29(9): 836-840. DOI: 10.3969/cjz.J.Issn.1002- 2694.2013.09.002 (in Chinese)
易新萍,谷文喜,吴冬玲,等.流产布鲁氏菌疫苗A19-ΔVirB12突变株生物学特性研究[J].中国人兽共患病学报, 2012, 29(9): 836-840. DOI: 10.3969/ cjz. J. Issn. 1002- 2694. 2013. 09. 002.
[2]Si R, Xu ZK.Brucellosisresearch[J]. Endem Dis Bull, 2006, 5(21): 80-82. (in Chinese)
司瑞,徐志凯.布鲁氏菌国内研究进展[J].地方病通报, 2006, 5(21), 80-82.
[3]Al Dahouk S, Fleche PL, Nockler K, et al. Evaluation ofBrucellaMLVA typing for humanbrucellosis[J]. J Microbiol Methods, 2007, 69: 137-145. DOI: 10.1016/j.Mimet.2006.12.015
[4]Zheng K, Chen DS, Wu YQ, et al. MicroRNA expression profile in RAW264.7 cells in response toBrucellamelitensisinfection[J]. Int J Biologic Sci, 2012, 8(7): 1013-1022. DOI: 10.7150/ijbs.3836
[5]Zhong Q, He QN, Fan WX, et al. Construction of VirB8 deletion mutants ofBrucellaand detection of its infection and virulence[J]. Chin J Anim Vet Sci, 2009, 40(6): 892-897. DOI: 0366-6964(2009) 06-0892-06 (in Chinese)
钟旗,何倩倪,范伟兴,等.布鲁氏菌VirB8变异株的构建及其感染力和毒力的测定[J].畜牧兽医学报, 2009, 40(6): 892-897. DOI: 0366-6964(2009) 06- 0892- 06.
[6]Delrue RM, Deschamps C, Leonard S, et al. A quorum-sensing regulator controls expression of both the type IV secretion system and the flagellar apparatus ofBrucellamelitensis[J]. Cell Microbiol, 2005, 7: 1151-1161. DOI: 10.1111/j.1462-5822.2005.00543.x
[7]Guo Q, Chen CF, Zhang H, et al. Construction of theSaccharomycescerevisiaeexpression vector containing virB4 gene[J]. Heilongjiang Anim Sci Vet Med, 2010, 7: 14-16. DOI: 1004-7034(2010) 06-0014-03 (in Chinese)
郭乾,陈创夫,张辉,等.牛种布鲁菌 virB4基因酵母表达载体的构建[J].黑龙江畜牧兽医, 2010, 7: 14-16. DOI: 1004-7034(2010)06-0014-03.
[8]Gao GJ, Ke YH, Xu J, et al. Construction ofB.ovisvirB mutant and analysis the intracellular environmental adaptations[J]. China Biotechnol, 2012, 32(11): 86-91. DOI: 10.13523/j.cb.20121114(in Chinese)
高光俊,柯跃华,徐杰,等.布鲁氏菌 B.ovis virB缺失株的构建及胞内环境适应性分析[J].中国生物工程杂志, 2012, 32(11): 86-91. DOI: 10.13523/j.cb.20121114.
[9]Watarai M, Makino S, Shirahata T. An essential virulence protein ofBrucellaabortus, VirB4, requires an intact nucleoside-triphosphate-binding domain[J]. Microbiology, 2002, 148(5): 1439-1446.
[10]Kim S, Lee DS, Watanabe K, et al. Interferon-gamma promotes abortion due toBrucellainfection in pregnant mice[J]. BMC Microbiol, 2005, 5(1): 22. DOI: 10.1186/1471-2180-5-22
[11]Forestier C, Deleuil F, Lapaque N, et al.Brucellaabortuslipopolysaccharide in murine peritoneal macrophages acts as a down-regulator of T cell activation[J]. J Immunol, 2000, 165: 5202-5210.
[12]Pappas G, Akritidis N, Bosilkovski M, et al.Brucellosis[J]. N Engl Med, 2005, 352: 2325-2336. DOI: 10.1056/ NEJMra050570
[13]O'Callaghan D, Cazevieeille C, Allardet-Servent A, et al. A homologue of theAgrobacteriumtumefaciensVirB andBordetellapertussisPtl type IV secretion systems is essential for intracellular survival ofBrucellasuis[J]. Mol Microbiol, 1999, 33(6): 1210-1220. DOI: 10.1046/j.1365-2958.1999.01569.x
[14]Ashkani Esfahani S, Esmaeilzadeh E, Bagheri F, et al. The effect of co-enzyme Q10 on acute liver damage in rats, a biochemical and pathological study[J]. Hepat Mon, 2013, 13(8): 13685-13686. DOI: 10.5812/hepatmon.13685
[15]Bonakdar RA, Guarneri E. Coenxyme Q10[J]. Am Faor Physician, 2005, 72(6): 1065-1067.
[16]Folkers K, Osterborg A, Nylander M, et al. Activities of vitamin Q10 in animal models and a serious deficiency in patients with cancer[J]. Biochem Biophys Res Commun, 1997, 234: 296-299. DOI: 10.1006/bbrc.1997.6522
[17]Feral CC, Nishiya N, Fenczik CA, et al. CD98hc (SLC3A2) mediates integrin signaling[J]. Proc Natl Acad Sci U S A, 2005, 102: 355-360. DOI: 10.1074/jbc.M702877200
[18]Chang DC, Meng C. A localized elevation of cytosolic free calcium is associated with cytokinesis in the zebrafish embryo[J]. J Cell Biol, 1959, 131(6): 1539-1545.

