日本血吸虫硫氧还蛋白谷胱甘肽还原酶同源建模及功能分析
黄经纬,郑予桐,李家璜,华子春
血吸虫病是一种分布广泛,危害严重的人兽共患寄生虫病,该病在全球74个国家呈地方性流行,每年约有2亿人受到感染。寄生人体的血吸虫主要有5种:日本血吸虫(Schistosomajaponicum)、曼氏血吸虫(Schistosomamansoni)、埃及血吸虫(Schistosomahaematobium)、间插血吸虫(Schistosomaintercalatum)和湄公血吸虫(Schistosomamekongi)。其中日本血吸虫、曼氏血吸虫和埃及血吸虫是人体主要的寄生虫。我国是日本血吸虫病的主要流行区之一, 每年受感染的人数接近3千万[1-2]。迄今为止,化学药物治疗仍然是血吸虫病最有效的治疗方法。对血吸虫最有效的化学药物是吡喹酮 (praziquantel),它于20世纪70年代后期发现的,是5种人体血吸虫病唯一的治疗药物。但是随着吡喹酮的广泛使用,曼氏血吸虫和埃及血吸虫对吡喹酮的敏感性有所下降, 亦有研究表明,吡喹酮对日本血吸虫的疗效也发生了变化。因此,开发新的血吸虫病治疗药物十分紧迫[3-5]。
硫氧还蛋白谷胱甘肽还原酶(thioredoxin glutathione reductase, TGR)是血吸虫生理代谢过程中关键的酶,在血吸虫体内氧化还原平衡中发挥重要作用[6]。血吸虫通常寄生在宿主循环系统,在这种富含氧的环境下,易受宿主体内活性氧的进攻。为了对抗活性氧的氧化损伤,大部分动物体内有两套氧化还原系统——硫氧还蛋白系统和谷胱甘肽系统,将氧化型的硫氧还蛋白和谷胱甘肽还原为还原形式,实现对细胞内的伤害性氧化的修复。哺乳动物中行使这一功能的酶为硫氧还蛋白还原酶(thioredoxin reductase, TrxR)和谷胱甘肽还原酶(glutathione reductase, GR),但是血吸虫体内并没有单独的TrxR或GR[7],而是被一种多功能酶所替代,这种酶兼具TrxR和GR的双重活性,被称为硫氧还蛋白谷胱甘肽还原酶。已经有研究发现,针对血吸虫TGR的RNAi实验可以使曼氏血吸虫死亡[8];亦有实验表明,抑制该酶的活性可以导致日本血吸虫死亡,但对宿主的不良反应较小[9]。这些事实都说明该TGR是血吸虫病治疗新药开发的潜在靶分子。
目前曼氏血吸虫TGR(SmTGR)的晶体结构已经得到测定[10-11],该结构的解析对了解TGR结构与功能,进而筛选或设计有效的抗曼氏血吸虫药物具有重要的价值。
日本血吸虫TGR (SjTGR) 结构至今还未被解析,本文以SmTGR为模板,对日本血吸虫SjTGR进行同源建模,分析其结构与功能,为进一步研究设计抗日本血吸虫药物奠定理论基础。
1 材料与方法
1.1日本血吸虫同源建模 以SjTGR(Swiss-Prot:B5THG7)为查询序列,通过Swiss-Pdbviewer 4.10软件[12]的子程序Blast对三维结构数据库PDB(http://www.rcsb.org/pdb/home/home.do)进行同源搜索,选取分数高(Score=1045)、E值为0、且分辨率为1.9埃的smTGR的晶体结构 (Swiss-Prot序列:Q962Y6,结构PDB ID: 2X8H[10]) 作为建模的模板。
整个单体蛋白的前期比对在Swiss-Pdbviewer中进行,比对结果递交到Swiss-Model在线服务器的工程模块(Project mode)进行同源建模,对于Swiss-Model给出的SjTGR结构,再用Swiss-Pdbviewer对其侧链进行进一步的优化,并进行全局能量最小化计算,得到SjTGR亚基的结构模型,最后我们采用PISA(http://www.ebi.ac.uk/msd-srv/prot_int/pistart.html)[13],将该单亚基装配成为二聚体形式——即SjTGR的天然结构形式。蛋白质的结构分析和图形显示采自于Discovery studio View 3.5图形可视软件(Accelrys Software Inc. USA )。
1.2TGR结构评估与分析 蛋白质结构的评估采用在线的软件PROCHECK(http://www.ebi.ac.uc/thrnton-srv/databases/pdbsum/Generate.html)。
1.3序列比对 多序列比对采用软件Genedoc(http://www.nrbsc.org/gfx/genedoc/)。
2 结果与讨论
2.1结构模型与评估 因为日本血吸虫TGR(SjTGR)与曼氏血吸虫TGR (SmTGR)蛋白序列相似性为90% (图1A),所以SmTGR是SjTGR可靠的结构模板。我们以SmTGR(PDB ID:2X8H,分辨率1.9埃)作为模板,得到了SjTRG的结构模型(图1B)。TGR亚基结构比较表明SmTGR与SjTGR骨架原子间的RMSD为0.31(图1C)。用PROCHECK检测模型的立体化学合理性,图2显示了日本血吸虫TGR二聚体的ramachandran图,除去112个Gly和44个Pro外,有879个氨基酸(85.3%)在主要允许区,143个氨基酸(13.9%)在额外允许区,所有二面角的估测值G因子值都在-0.5之上,该结果表明了我们构建的蛋白质SjTGR结构的可靠性。
2.2SjTGR重要的活性位点 与曼氏血吸虫smTGR相同,日本血吸虫SjTGR同样具有NADPH和FAD结合结构域,吡啶核苷酸二硫化物氧化活性中心(-CVNVGC-),在N-端有Grx活位基序(-CPFC-)[11,14-15]。现有的研究认为,NADPH作为电子供体起始了TGR的氧化还原电子通路;FAD接受来自NADPH的电子,然后进一步将电子传递给以C154-C159为中心的活性口袋而完成电子的初步流动。参考SmTGR-配体复合物晶体结构中(PDB ID:2X99)NADPH的结合模式,我们也将NADPH接入SjTGR中,SjTGR中参与NADPH结合的氨基酸残基包括:Lys162、 Gly293-Val297、Lys300、Arg317、Ser318、Arg322、Ala390-Arg393、Gln440、 Leu441、Thr472和Phe474(图3A),这些氨基酸在不同来源的TGR蛋白中(日本血吸虫(Swiss-Prot序列:B5THG7)、曼氏血吸虫(Q963Y6)、肝吸虫(A8E0R8)、细粒棘球绦虫(Q869D6)、鼠(Q99MD6)和人(Q86VQ6))极为保守(图3B,红框标记),预示与该位点结合的抑制剂有可能抑制多种TGR蛋白。
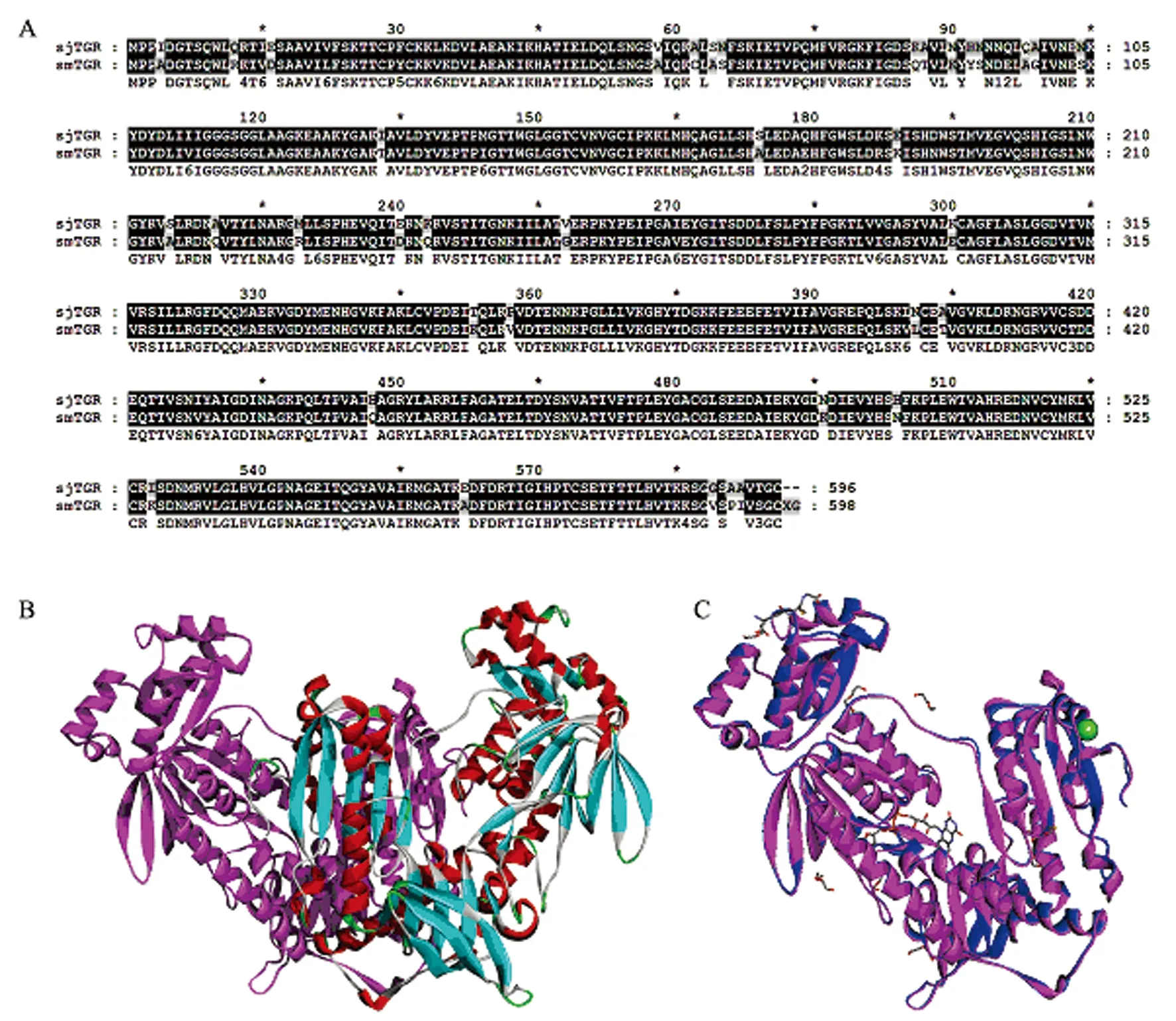
图1SjTGR结构模型
Fig.1HomologystructureofSjTGR
A: Sequence alignment betweenSjTGR and smTGR proteins; B: Homodimer structure model ofSjTGR;
C: Subunit structure alignment betweenSjTGR (violet) and the templateSmTGR (blue)

图2SjTRG结构评估ramachandran图
Fig.2RamachandranplotofSjTGRmodelbyPROCHECK
我们同时分析了谷胱甘肽(GSH)的结合位点,以smTGR-GSH复合物结构(PDB ID:2X8H)为参考,我们将GSH放入SjTGR的Grx结构域 (图3A),SjTGR上与结合GSH的氨基酸残基主要有:Lys25、Cys28和Phe30(属于Grx活位基序-CPFC-)、Thr71、Val72、Pro73、Asp84、Ser85和Lys86,这些残基在血吸虫和肝吸虫TGR中极为保守,但哺乳动物TGR在Phe30和Asp84-Ser85-Lys86位点上有较大的差异,分别被His和Gly-Cys-Asp所取代(图3B,蓝框标记),这暗示着以Grx结构域的GSH结合位点作为药物靶点,有助于设计寄生虫特异性的抑制剂。

图 3 SjTGR底物结合的位点
TGR蛋白同时具有GR和TrxR活性,我们分析了GR的底物——氧化型GSH(GDS/GSSG)的结合位点。尽管血吸虫的TGR的GDS复合物没有解析,人类的GR蛋白-GDS复合物结构(PDB ID:1GRA)已经得到测定,参考该蛋白的GDS结合区域特性,我们将GDS放入SjTGR蛋白的GR的活性口袋,并进行能量优化。GDS的结合位点位于SjTGR二聚体的界面附近,同时与两个亚基相互作用,SjTGR中参与GDS底物结合的残基主要有第一个亚基上的Ser117、Ala121、Lys124、Val55、Leu208、Tyr212、Ile446和Arg450,以及另一个亚基上的Lys506、Leu508、His571-Thr573,以及Val593 (图3A)。序列比较表明,GDS结合位点有着高度保守性(图3B,紫红框标记),而Ala121和Val593在寄生虫TGR都为Ala和Val,但是在人或鼠中分别为Ser和Gln,这有可能作为寄生虫TGR的GDS抑制剂特异性的筛选位点。
2.3SjTGR C末端的重要作用SjTGR在C-末端也具有Sec(硒代半胱氨酸)[16]。虽然PDB ID为2X8C的SmTGR拥有完整的C末端氨基酸,但其分辨率只为3.1埃,结构可靠性较差,因此本文选择PDB ID为2X8H(分辨率1.9埃,缺少了Tyr594之后的氨基酸残基)的SmTGR结构为模板,以确保构建出的SjTGR构象更加可靠。但C-末端对TGR的生物学功能极为重要,已经有学者对TRG的含Sec的C末端的作用进行了研究。 Angelucci 与Sharma等发现,除了TrxR的活性丧失外,截去C-末端的smTGR仅拥有约0.8%的GR活性和40%的Grx活性[7, 11],表明C-末端的存在是TGR高效地行使功能的重要保证。Prast-Nielsen 等报道Sec597的SmTGR突变体也能快速被金诺芬抑制,但他们认为Sec可能不是抑制剂的结合位点,Sec的存在仅仅加速该抑制过程[15]。在生理pH情况下,硒原子亲核性比硫原子强。所以Sec的存在可以使得含硒蛋白与底物速率更快,并且在与底物反应后,生成物可以高效地接收来自其他激活的Cys对的电子。除了电子对接受与释放,C末端可能还具备电子转移的功能。Angelucci等认为C末端可摆动到Grx结构域,与GSH相互作用的Cys发生电子传递[10]。我们的分析显示Val593能与GDS的形成相互作用(图3A),推测C-末端的氨基酸也可能参与GDS在GR酶活性位点的结合作用,这可部分解释为何截去C-末端,TGR的GR活性会受到重要影响。序列比对表明不同的TGR的C-末端具有一定特异性(图3B),因此针对SjTGR的C-末端设计抑制剂,限制C-末端的柔性和摆动,将有可能特异性地抑制SjTGR内的电子传递,从而影响日本血吸虫体内的氧化还原平衡。
3 结 论
本文以SmTGR为模板构建了日本血吸虫SjTGR的同源结构,PROCHECK的分析表明所构建的模型具有较高可靠度。通过结构和序列的比较,分析了SjTGR的NADPH、GSH以及GDS的结合位点。比较这些位点在不同血吸虫间的差异,表明TGR中NADPH与GDS的结合位点极为保守,因此其他来源TGR的NADPH或GDS的竞争抑制剂可能对日本血吸虫也会有抑制作用。而TGR的GSH的结合位点有着相对明显的寄生虫特异性,表明这个位点有可能作为寄生虫TGR药物的特异性结合位点。TGR的C末端氨基酸链对血吸虫TGR电子传递起着重要作用,因而阻断C末端摆动的抑制剂将可能有效地抑制TGR活性。
参考文献:
[1]Shadan S. Drug discovery: schistosome treatment[J]. Nature, 2008, 452(7185): 296. DOI: 10.1038/452296b
[2]Lin DD, Wu XH, Jiang QW, et al. Strategic emphasis for research development of schistosomiasis control in China[J]. Chin J Schist Ctrl, 2009, 21(1): 1-5. (in Chinese)
林丹丹,吴晓华,姜庆五,等. 我国血吸虫防治研究的战略重点思考 [J]. 中国血吸虫病防治杂志, 2009, 21(1): 1-5
[3]Xiao SH. Progress in development of new antischistosomal drugs in recent years[J]. Chin J Parasitol Parasit Dis, 2010, 28(3): 218-225. (in Chinese)
肖树华. 近年来发展抗血吸虫新药的进展 [J]. 中国寄生虫学与寄生虫病杂志. 2010, 28(3): 218-225
[4]Melman SD, Steinauer ML, Cunningham C, et al. Reduced susceptibility to praziquantel among naturally occurring Kenyan isolates ofSchistosomamonsoni[J]. PLoS Negl Trop Dis, 2009, 3(8): e504. DOI: 10.1371/journal.pntd.0000504
[5]Wang W, Dai JR, Li HJ, et al.Is there reduced susceptibility to prsziquantel inSchistosomajaponicumevidence from China[J]. Parssitology, 2010, 137(13): 1905-1912. DOI: 10.1017/S0031182010001204
[6]Huang HH, Day L, Cass CL, et al. Investigations of the catalytic mechanism of thioredoxin glutathione reductase fromSchistosomamansoni[J]. Biochemistry, 2011, 50(26): 5870-5882. DOI: 10.1021/bi200107n
[7]Sharma M, Khanna S, Bulusu G, et al. Comparative modeling of thioredoxin glutathione reductase fromSchistosomamansoni: A multifunctional target for antischistosomal therapy[J]. J Mol Graphics Modeling, 2009, 27(6): 665-675. DOI: 10.1016/j.jmgm.2008.10.009
[8]Kuntz AN, Davioud-Charvet E, Sayed AA, et al. Thioredoxin glutathione reductase fromSchistosomamansoni: an essential parasite enzyme and a key drug target[J]. PLoS Med, 2007, 4(6): e206. DOI: 10.1371/journal.pmed.0040206
[9]Song LJ, Li JH, Xie SY, et al. Thioredoxin glutathione reductase as a novel drug target: evidence fromSchistosomajaponicum[J]. PLoS One, 2012, 7(2): 1-11. DOI: 10.1371/journal.pone.0031456
[10]Angelucci F, Dimastrogiovanni D, Boumis G, et al. Mapping the catalytic cycle ofSchistosomamansonithioredoxin glutathione reductase by X-ray crystallography[J]. J Biol Chem, 2010, 285(42): 32557-32567. DOI: 10.1074/jbc.M110.141960
[11]Angelucci F, Miele AE, Boumis G, et al. Glutathione reductase and thioredoxin reductase at the crossroad: The structure ofSchistosomamansonithioredoxin glutathione reductase[J]. Proteins: Struct Funct Bioinform, 2008, 72(3): 936-945. DOI: 10.1002/prot.21986
[12]Guex N, Peitsch MC. SWISS-MODEL and the Swiss-PdbViewer: An environment for comparative protein modeling[J]. Electrophoresis, 1997, 18: 2714-2723. DOI: 10.1002/elps.1150181505
[13]Krissinel E, Henrick K. Inference of macromolecular assemblies from crystalline state[J]. J Mol Biol, 2007, 372: 774-797. DOI: 10.1016/j.jmb.2007.05.022
[14]Han Y, Zhang M, Hong Y, et al. Characterization of thioredoxin glutathione reductase inSchistosomajaponicum[J]. Parasitol Int, 2012, 61(3): 475-480. DOI: 10.1016/j.parint.2012.03.005
[15]Prast-Nielsen S, Huang HH, William DL. Thioredoxin glutathione reductase: Its role in redox biology and potential as a target for drugs against neglected diseases[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2011, 1810(12): 1262-1271. DOI: 10.1016/j.bbagen.2011.06.024
[16]Song LJ, Yu CX, Xie SY, et al. Expression and characterization of thioredoxin glutathione reductase ofSchistosomajaponicum[J]. Chin J Schist Ctrl, 2011, 23(4): 412-418. (in Chinese)
宋丽君,余传信,谢曙英,等.日本血吸虫硫氧还蛋白谷胱甘肽还原酶的表达及特性分析[J]. 中国血吸虫病防治杂志. 2011. 23 (4): 412-418.
——以江苏省为例

