旋毛虫肌幼虫排泄分泌物激活的巨噬细胞和成肌细胞共培养对成肌细胞分化的影响
王艳凤,王 楠,丁 静,孙 尧,刘晓雷,王学林,刘明远,白 雪
旋毛虫病是由旋毛虫(Trichinella)引起的一种呈全球性分布的食源性人兽共患寄生虫病,因食入含有旋毛虫感染性肌幼虫的生的或半生的肉类引起。旋毛虫在感染不同时期,释放许多生物活性物质调节宿主免疫反应并入侵宿主肌细胞为自己构建了一个安全的包囊来达到成功的寄生。包囊的形成是一个复杂的过程,其排泄分泌物及其诱导宿主细胞释放的效应分子在感染肌细胞的转换及其周围环境的改变中发挥着重要的作用[1]。体外实验表明,旋毛虫肌幼虫虫体粗提物能够刺激巨噬细胞分泌血管内皮生长因子(VEGF)和成纤维生长因子2(FGF2),其中VEGF可能与维持保姆细胞(nurse cells)的低氧环境及刺激释放I型胶原的纤维母细胞的增殖有关,这些结果表明旋毛虫感染肌细胞周围的巨噬细胞对包囊的形成有着重要的影响[2]。
目前旋毛虫不同时期的排泄分泌物(即ES产物)影响宿主细胞功能的研究相对甚少。另外免疫细胞与成肌细胞共培养是近几年来建立的一种体外研究免疫生理的新技术,是研究细胞间相互作用的有力手段。因此,本研究通过分离培养旋毛虫肌幼虫时期的ES产物,体外研究与旋毛虫ML ES作用后的巨噬细胞共培养对成肌细胞分化的影响,利用共培养技术,建立了巨噬细胞与成肌细胞共培养模型,探讨与肌幼虫排泄分泌物作用的巨噬细胞共培养对成肌细胞分化的影响,这些研究为深入了解ES产物的功能同时为旋毛虫入侵后包囊形成机理提供新的思路。
1 材料与方法
1.1 材料
1.1.1细胞、实验动物与旋毛虫虫种 小鼠巨噬细胞株J774A.1和小鼠成肌细胞C2C12购自ATCC(American Type Culture Collection),本室常规传代。Wistar大鼠,购自长春生物制品研究所,用于旋毛虫传代保种及旋毛虫不同时期排泄分泌物的收集。中国河南猪旋毛虫分离株T.spiralis(ISS534),由本室传代保种。
1.1.2主要试剂 嵌入小皿和共培养板、25 mL细胞培养瓶、细胞培养板(6孔和24孔)购自COSTAR公司产品;RPMI-1640培养液、Hoechst 33342购自Sigma公司;细胞蛋白裂解液购自碧云天生物技术有限公司;辣根过氧化物酶标记羊抗鼠IgG以及羊抗兔IgG购自Santa Cruz公司;正常山羊血清购自鼎国;高糖DMEM培养基、马血清购自GIBCO公司;鼠抗Myosin Heavy Chain单抗购自Upstate公司;鼠抗Myogenin单抗均自美国Santa Cruz公司;兔抗MyoD多抗均自美国Santa Cruz公司;Alexa Fluor 555-羊抗兔IgG和Alexa Fluor 488-羊抗鼠IgG购自Invitrogen公司。
1.2 方法
1.2.1旋毛虫肌幼虫排泄分泌物(ML ES)的收集 取旋毛虫ISS534保种的Wistar系大鼠1只,脱颈致死,留胴体和膈肌用人工消化液(10 g/L胃蛋白酶和10 mL/L浓盐酸)在37 ℃恒温培养箱里消化2 h后,过筛并采用自然沉淀的方法收集感染性肌幼虫,低倍显微镜检查并计数后,经口感染Wistar系大鼠8 000条/只,共10只。与感染后35 d剖杀收集肌幼虫,将肌幼虫洗净并用含200 U/mL青霉素,200 U/mL链霉素的RPMI 1640培养液在CO2培养箱中培养,24 h后离心,收集的培养液上清作为ML ES备用。
1.2.2小鼠J774A.1巨噬细胞以及成肌细胞C2C12的复苏及培养 取出液氮罐中冻存的小鼠J774A.1巨噬细胞以及成肌细胞C2C12,立刻置于37 ℃的恒温水浴锅中,迅速晃动,当细胞完全解冻后转入含有DMEM培养液的离心管中,水平离心800 r/min,8 min,弃上清。用含有100 U/mL青霉素、100 U/mL链霉素、10%灭活胎牛血清的DMEM培养基重悬细胞,在37 ℃、5% CO2及饱和湿度的培养箱中培养24 h后经倒置显微镜观察细胞形态。细胞汇合度达到90%时0.25%胰酶消化继续培养,细胞传代培养2~3次后用于实验研究。
1.2.3旋毛虫肌幼虫期排泄分泌物(ML ES)处理巨噬细胞 将复苏培养后的J774A.1巨噬细胞按每孔0.5×105个细胞接种于12 mm嵌入小皿并放入24孔板,置于37 ℃、5% CO2、饱和湿度的培养箱中培养。细胞生长约20 h后,其中一些嵌入小皿中加含有ML ES(5 μg/mL)的10% DMEM培养基,孵育24 h,另一些嵌入小皿中加含相同体积PBS的10%DMEM培养基作为空白对照。
1.2.4J774A.1-C2C12共培养模型的建立与分组 将小鼠成肌细胞C2C12按每孔1×105个细胞接种于含有经多聚赖氨酸处理的盖玻片的24孔培养板中(用于细胞免疫荧光分析)或2×105接种于6孔板(用于Western blot分析),待细胞贴壁后,将其分成3组:标记A(ML ES处理组)、标记B(PBS处理组)、标记C(非共培养组)。方法如下:吸出(A)组的C2C12成肌细胞原生长培养液后,将含有ML ES的J774A.1巨噬细胞嵌入皿小心移入24孔板或6孔板中央,之后在培养板和嵌入小皿之间加入分化培养基;吸出(B)组的C2C12成肌细胞原培养液后,将含有PBS的J774A.1巨噬细胞嵌入小皿小心移入24孔或6孔培养板中央,之后在培养板和嵌入皿之间加入分化培养基;(C)组为单纯分化培养基诱导培养的小鼠成肌细胞C2C12(非共培养)。各组均按1 d、3 d、6 d 3个时间段标记后,置于37 ℃、5% CO2及饱和湿度的培养箱中培养。
1.2.5细胞免疫荧光法检测与ML ES处理的巨噬细胞共培养对成肌细胞分化及成肌调节因子的影响 共培养1 d、3 d、6 d后,取对照组和处理组的C2C12细胞,PBS洗涤3次,加入4%的多聚甲醛固定0.5 h,吸走多聚甲醛,PBS洗涤3次。浸泡在0.1%Triton X-100中,4 ℃通透20 min后PBS洗3次。用封闭液(含5%正常山羊血清)室温封闭30 min。吸出封闭液,封闭液稀释以下一抗:兔抗MyoD多克隆抗体(1∶50)、鼠抗Myogenin单克隆抗体(1∶100)、鼠抗肌球蛋白重链MHC单克隆抗体(1∶100)4℃孵育过夜。次日用PBS洗3次,每次10 min。滴加Alexa Fluor 555 Goat anti-rabbit IgG或Alexa Fluor 488 Goat anti-mouse IgG(封闭液1∶200稀释),避光孵育30 min。PBS洗3次,每次10 min。Hoechst 33342室温复染5 min,PBS洗2次,每次10 min。甘油封片,将细胞板置于激光共聚焦显微镜下观察结果。
1.2.6Western blot分析与旋毛虫ML ES处理的巨噬细胞共培养对成肌细胞分化以及成肌调节因子的影响 共培养1 d、3 d、6 d后,收集对照组和实验组的C2C12细胞,经裂解液(用时提前加入PMSF,终浓度为1 mmol/L)获取细胞总蛋白,采用BCA法对所抽提蛋白质的浓度进行测定。获取细胞总蛋白进行12%SDS-PAGE后,电转移至硝酸纤维素膜(PVDF膜)上,室温封闭2 h;封闭液稀释以下一抗:兔抗MyoD多克隆抗体(1∶100)、鼠抗Myogenin单克隆抗体(1∶500)、鼠抗肌球蛋白重链MHC单克隆抗体(1∶200),4 ℃孵育过夜;次日用PBST洗膜3次,每次10 min;沥干后将转移膜用辣根过氧化酶标记的羊抗鼠或者辣根过氧化酶标记的羊抗兔IgG(封闭液1∶5 000稀释)室温孵育2 h;同样用PBST洗膜3次,每次10 min,随后用ECL化学发光显示试剂盒显色,观察结果。
2 结 果
2.1细胞免疫荧光法检测与旋毛虫ML ES处理的巨噬细胞共培养对成肌细胞分化及成肌调节因子的影响 通过细胞免疫荧光分析在共培养1 d、3 d、6 d后,ML ES处理的巨噬细胞共培养对小鼠成肌细胞C2C12的MyoD、Myogenin和MHC表达的影响。结果显示,与正常分化的对照组相比,MyoD(如图1)、Myogenin(如图2)和MHC(如图3)阳性细胞数明显减少。

图1与肌幼虫排泄分泌物处理的巨噬细胞共培养对C2C12成肌细胞MyoD表达的影响
Fig.1Effectofco-culturedmacrophagestreatmentwithESproductsfrommusclelarvaeofT.spiralisontheexpressionofMyoDofC2C12myoblast
2.2Western blot分析与旋毛虫ML ES处理的巨噬细胞共培养对成肌细胞分化以及成肌调节因子的影响 Western blot分析进一步检测了这些因子的表达变化。如图4所示,ML ES处理的巨噬细胞共培养组,MyoD、Myogenin以及MHC蛋白的表达明显低于对照组蛋白的表达。
3 讨 论
目前对巨噬细胞与肌细胞的相互作用,已经有了深入的研究,但在旋毛虫感染肌细胞后,巨噬细胞对生肌程序的调节国内外尚未报道。本实验室先前的研究已表明巨噬细胞是旋毛虫免疫调节的靶细胞,那么ES产物调节的巨噬细胞不但在免疫逃逸中发挥重要的作用,同时在感染肌细胞表型的改变中同样发挥着重要的角色[1-2]。卫星细胞的再生与分化完全依靠于其周围的环境,详细的了解旋毛虫ES产物作用后的巨噬细胞及其因子与成肌细胞的相互作用将有助于我们从整体上理解旋毛虫感染后肌细胞表型的转化机制,而不是单单的集中在寄生虫与肌细胞的相互作用。
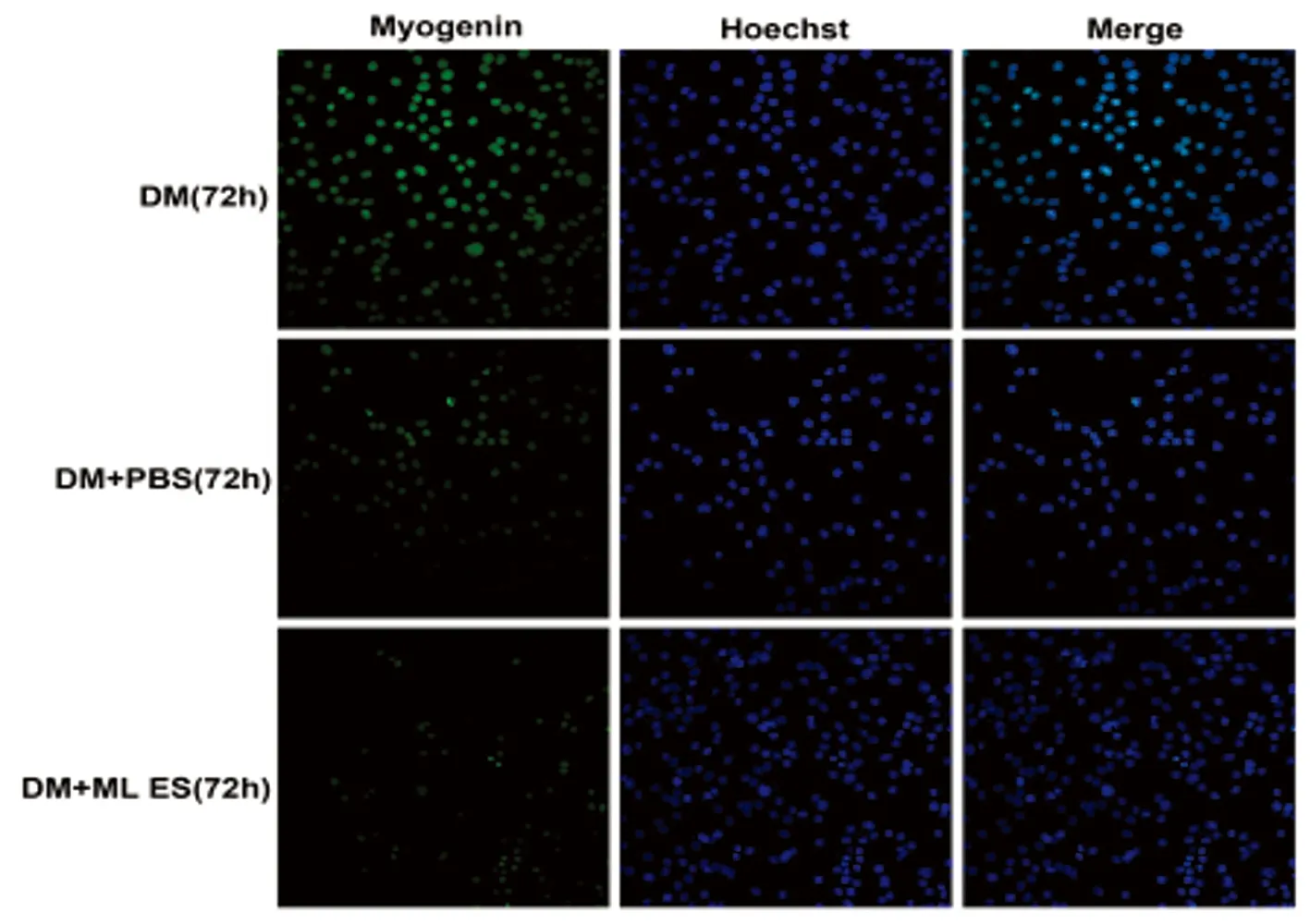
图2与肌幼虫排泄分泌物处理的巨噬细胞共培养对C2C12成肌细胞Myogenin表达的影响
Fig.2Effectofco-culturedmacrophagestreatmentwithESproductsfrommusclelarvaeofT.spiralisontheexpressionofMyogeninofC2C12myoblast
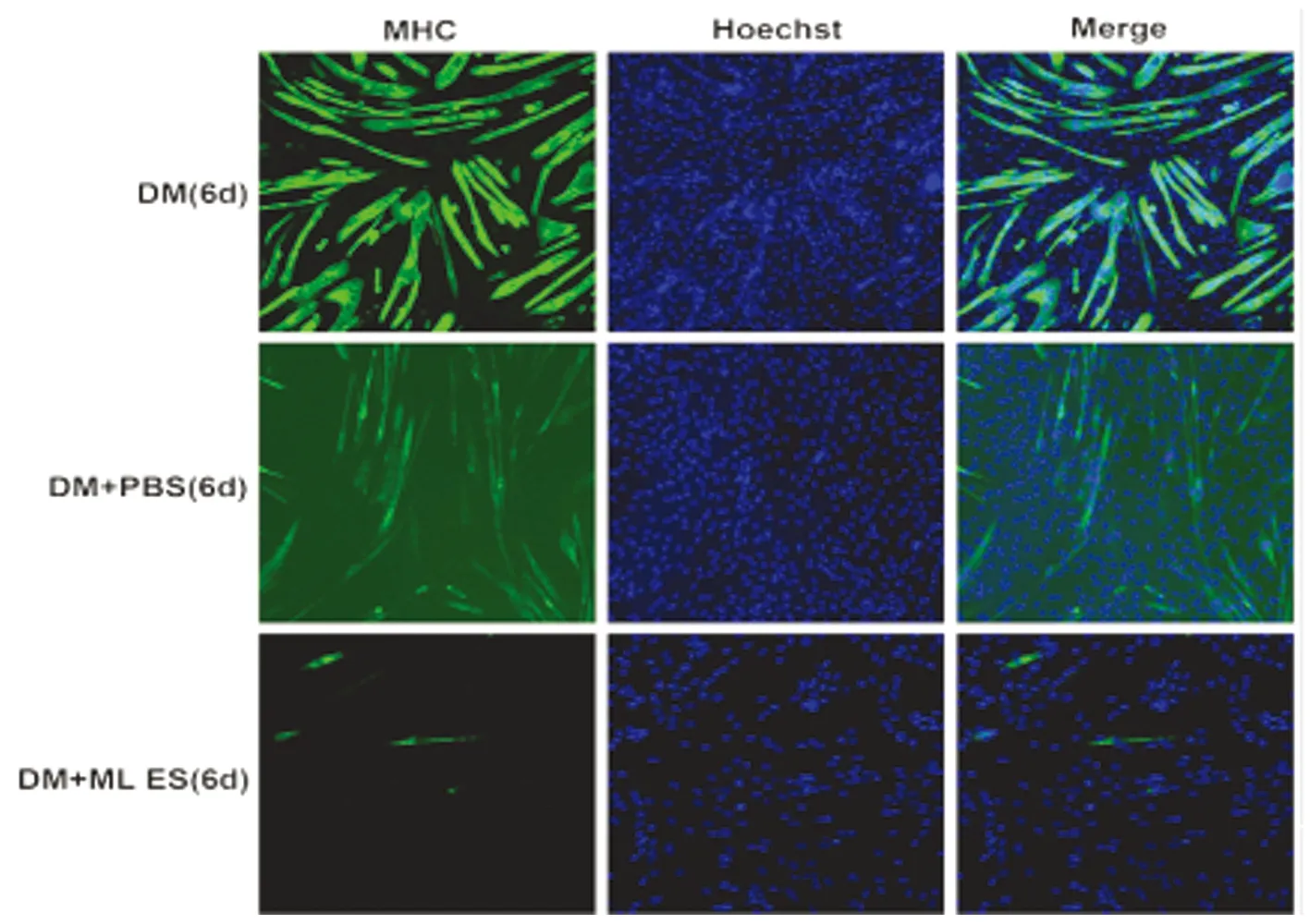
图3与肌幼虫排泄分泌物处理的巨噬细胞共培养对C2C12成肌细胞MHC表达的影响
Fig.3Effectofco-culturedmacrophagestreatmentwithESproductsfrommusclelarvaeofT.spiralisontheexpressionofMHCofC2C12myoblast
损伤肌肉的修复完全依靠于卫星细胞,这些细胞位于基底膜,正常情况下是静止的,当组织受到损伤时这些细胞被激活、增殖、分化、融合成新的肌管[3]。在这个过程中,巨噬细胞及其释放的因子被认为起到了重要的作用[4]。在肌肉组织的损伤修复过程中,首先巨噬细胞被经典激活,这些经典激活的巨噬细胞去清理坏死的肌肉碎片同时释放促炎性细胞因子如TNF-α和白血病抑制因子(LIF)来促进卫星细胞的增殖,而且这些因子可以下调MyoD和Myogenin的表达,抑制肌细胞的分化[5-6]。

图4与肌幼虫排泄分泌物处理的巨噬细胞共培养对C2C12成肌细胞MyoD,Myogenin与MHC表达的影响
Fig.4Effectofco-culturedmacrophagestreatmentwithESproductsfrommusclelarvaeofT.spiralisontheexpressionofMyoD,MyogeninandMHCinC2C12myoblast
本研究应用共培养技术,成功构建了J774A.1巨噬细胞-C2C12成肌细胞共培养模型,在分化条件下,观察ML ES处理的巨噬细胞在共培养体系中对小鼠成肌细胞C2C12的成肌调节因子(MRFs)和肌球蛋白重链(MHC)表达的影响。MyoD作为成肌细胞分化的早期标志物,在分化的早期12 h表达上调[7]。中晚期Myogenin对成肌细胞的终末分化进行调节,在分化期间持续表达[8];MHC则为终末分化标记物。细胞免疫荧光以及Western blot结果表明在分化条件下,与对照组比较,与ML ES处理的巨噬细胞共培养能够抑制其成肌调节因子MyoD、Myogenin和MHC的表达,即在共培养模型中,ML ES产物处理的巨噬细胞抑制了生肌进程。结论表明,在旋毛虫入侵后的肌肉组织修复及保姆细胞的形成过程中,巨噬细胞发挥了重要且复杂的角色,且ES产物处理后的巨噬细胞释放的分化抑制因子对宿主肌肉组织修复及旋毛虫包囊形成是非常重要的。
参考文献:
[1]Andrade MA, Siles-Lucas M, Lopez-Aban J, et al.Trichinella: Differing effects of antigens from encapsulated and non-encapsulated species oninvitronitric oxide production[J]. Vet Parasitol, 2007, 143(1): 86-90.
[2]Shariati F, Perez-Arellano JL, Lopez-Aban J, et al.Trichinella: Differential expression of angiogenic factors in macrophages stimulated with antigens from encapsulated and non-encapsulated species[J]. Exper Parasitol, 2009, 123(4): 347-353.
[3]Chilosi M, Poletti V, Zamo A, et al. Aberrant repair and fibrosis development in skeletal muscle[J]. Am J Pathol, 2003, 162(5): 1495.
[4]Tidball JG, Wehling-Henricks M. Macrophages promote muscle membrane repair and muscle fibre growth and regeneration during modified muscle loading in miceinvivo[J]. J Physiol, 2007, 578(1): 327-336.
[5]Kurek JB, Nouri S, Kannourakis G, et al. Leukemia inhibitory factor and interleukin-6 are produced by muscle cells in diseases and regenerating skeletal muscle[J]. Muscle Nerve, 1996, 19: 1291-1301.
[6]Kodelja V, Muller C, Tenorio S, et al. Differences in angiogenic potential of classically vs alternatively activated macrophages[J]. Immunobiology, 1997, 197: 478-493.
[7]Li YP, Liang BS. The advance in role of MyoD in muscle formation mechanism[J]. Int J Orthop, 2008, 28(1): 37-40. (in Chinese)
李永平,梁炳生. MyoD肌形成作用机制研究进展[J]. 国际骨科学杂志,2008,28(1): 37-40.
[8]He Q, Wang LF. The function of the Bhlh protein family[J]. Foreign Med Sci Sect Pathophysiol Clin Med, 2004, 24(6): 545-546. (in Chinese)
贺强, 王立峰. bHLH蛋白家族的功能[J]. 国外医学·生理、病理科学与临床分册,2004,24(6): 545-546.

