一测多评法测定清开灵注射液中的绿原酸类成分
张 倩, 张加余, 董鲁艳, 张红霞, 乔延江, 卢建秋*
(1. 北京中医药大学科研实验中心,北京 100029;2. 北京中医药大学中药学院,北京 100102)
清开灵注射液是由八味药组成的大复方,含有多种化学成分,主要包括环烯醚萜类、黄酮类、有机酸类等。其中绿原酸作为有机酸类成分的代表,具有抑菌、抗病毒、解热消炎等作用,一般被当作金银花药材及制剂的定性、定量指标。目前有关清开灵注射液中有机酸类成分的测定大多以绿原酸为测定指标[1-3]。然而《中国药典》2010年版和清开灵注射液质量标准草案中并没有对其进行质量控制。本课题组在前期工作中发现注射液及相关药味中含有多种绿原酸类成分[4-5],该类成分分子结构中存在酯键、不饱和双键及多元酚,在提取、贮存过程中,受温度、pH等的影响会通过水解和分子内酯基迁移而发生异构化[6-8],导致该类成分制备难度较大、成本较高。而王智民课题组提出的用于多成分质量控制的“一测多评”法[9],克服了对照品不易得、检测成本较高的难题,并成功应用于丹参[10]、三黄片[11]等常用中药及制剂的成分定量测定,同时该法被《中国药典》2010年版采纳收录。为了更好地控制清开灵注射液产品质量,实现多指标质量控制,本研究采用“一测多评”法对清开灵注射液中6种绿原酸类成分进行测定,并对不同厂家、同一厂家不同批号的产品进行质量评价。
1 仪器与试药
Agilent 1100 高效液相色谱仪(美国Agilent 公司);Waters2695_2998高效液相色谱仪(美国Waters公司);R200D型电子分析天平(德国Sartorius公司);Millipore Synergy UV型超纯水机(美国Millipore公司)。
绿原酸对照品(批号:110753-200413)购于中国食品药品检定研究院;新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C对照品(纯度分别为99.3%、99.8%、99.2%、98.9%、99.3%)均购于成都普瑞法科技有限公司;8个厂家清开灵注射液(编号分别为F1、F2、F3、F4、F5、F6、F7、F8),F6厂的11批清开灵注射液(批号分别为211005A、211405A、210905A、211605A、211505A、212005A、211705A、211305A、211105A、211205A、211805A),均为市售产品。甲酸为分析纯,乙腈为色谱纯,水为超纯水。
2 方法与结果
2.1 基本原理[9]在一定范围(线性范围)内,成分的量(质量或浓度)与检测器响应成正比,即f=W/A(W表示成分的量,A表示响应值)。在多指标(s,a,b…,i…)质量评价时,可以用样品中某一典型成分(有对照品供应,价廉易得、稳定性较好)为内参物(s),建立该成分与其他成分(a,b…,i…)之间的相对校正因子,通过相对校正因子计算其他成分的量,此即“一测多评”法(QAMS)。
相对校正因子(fsi)的计算公式为:
(1)
式中Ai为样品中待测成分i的峰面积,Ci为质量浓度;As为样品中内参物s的峰面积,Cs为质量浓度。
2.2 溶液制备
2.2.1 对照品溶液的配制 分别取新绿原酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C对照品适量,精密称定,加甲醇制成质量浓度分别为37.20、63.60、43.20、22.20、32.80、43.20 μg/mL的混合对照品贮备液,于4 ℃冰箱中储存。
2.2.2 供试品溶液的配制 取各批次清开灵注射液,用0.45 μm微孔滤膜滤过, 取续滤液,即得。
2.3 色谱条件 色谱柱为Agilent Zorbax SB-C18(250 mm×4.6 mm,5 μm);柱温为30 ℃;流动相为0.1%甲酸水(A)-乙腈(B),线性梯度洗脱(0~15 min,0~10% B;15~22 min,10%~12% B;22~45 min,12%~18% B; 45~55 min,18%~23% B);体积流量为0.5 mL/min;检测波长为327 nm;进样量为10 μL。结果如图1所示。
2.4 方法学考察
2.4.1 线性范围 精密吸取上述混合对照品溶液,用甲醇稀释至6个不同质量浓度(1#、2#、3#、4#、5#、6#),进样分析,每个质量浓度进样3次,取平均值,以质量浓度对峰面积均值进行回归处理,得到6种成分的线性回归方程,结果见表1。
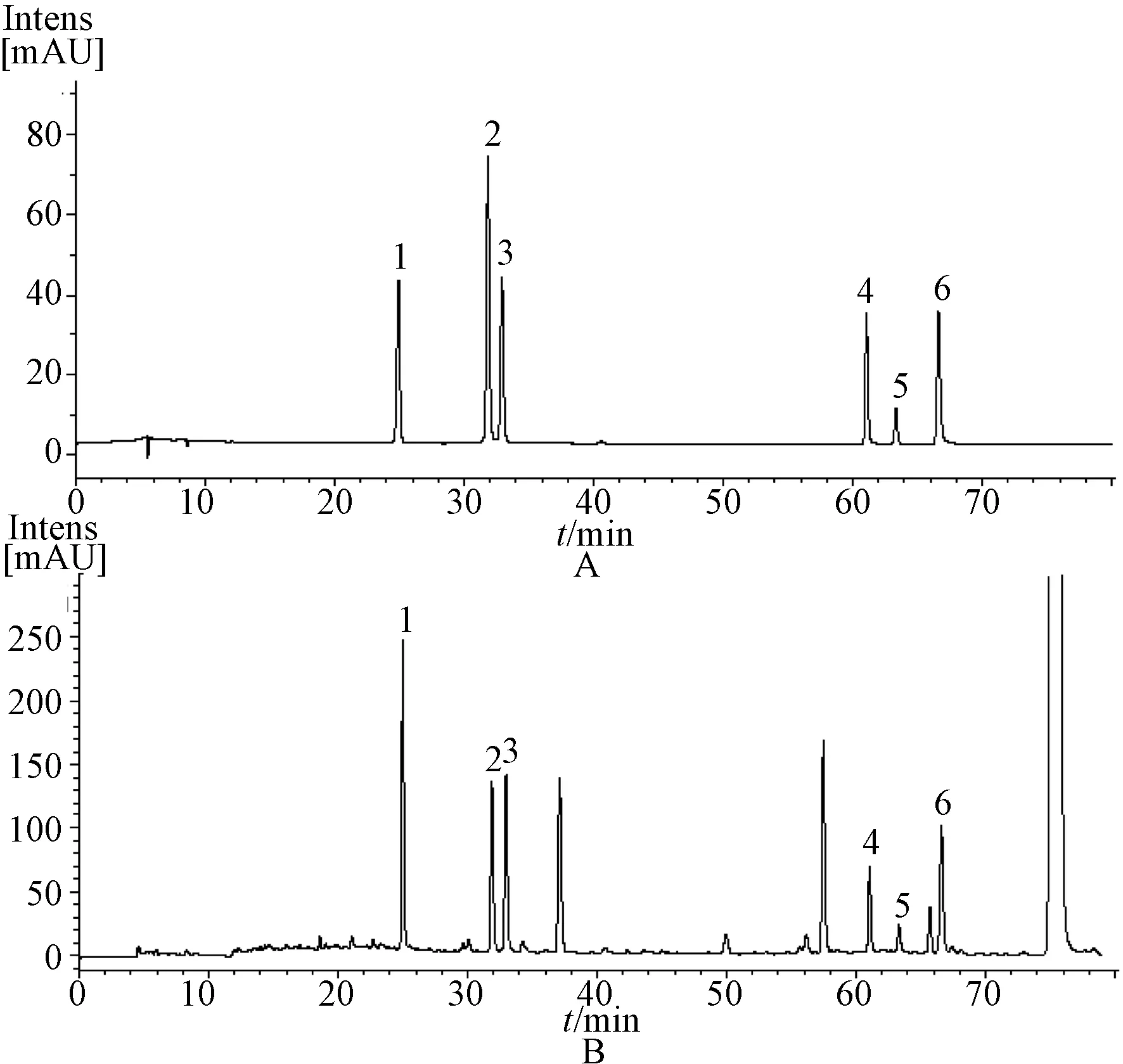
1. 新绿原酸 2. 绿原酸 3. 隐绿原酸 4. 异绿原酸B 5. 异绿原酸A 6. 异绿原酸C1.neochlorogenic acid 2.chlorogenic acid 3.cryptochlorogenic acid 4. Isochlorogenic acid B 5. Isochlorogenic acid A 6. Isochlorogenic acid C
2.4.2 精密度考察 取同一混合对照品溶液连续进样6次,记录各成分的峰面积,结果6种绿原酸类成分峰面积的RSD均<3%,表明仪器的精密度良好。
2.4.3 稳定性考察 取同一批号清开灵注射液(010705A),按“2.1.2”项下制备供试品溶液,分别在0、2、4、6、8、10 h进样测定,计算各成分的量,结果6种绿原酸类成分的RSD均<3%,表明供试品溶液在10 h内,各成分较稳定。
2.4.4 重复性考察 取同一批号清开灵注射液(010705A),按“2.1.2”项下方法平行制备6份,进样测定,计算各成分的量,结果6种绿原酸类成分的RSD均<3%,表明该方法的重复性良好。
2.4.5 加样回收率考察 取含有量已知的同一批号清开灵注射液(010705A)6份,每份2.5 mL,分别精密加入新绿原酸、绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C质量浓度分别为17.60、9.30、15.20、3.60、1.48、4.02 μg/mL的混合对照品溶液2.5 mL,混匀,按上述色谱条件进行测定,计算各成分的量,结果6种成分的回收率在98.71%~102.05%。
2.5 相对校正因子的确定
2.5.1 待测成分相对校正因子的计算 根据公式(1),以绿原酸为内参物,分别计算其他5种成分的相对校正因子,结果见表2。
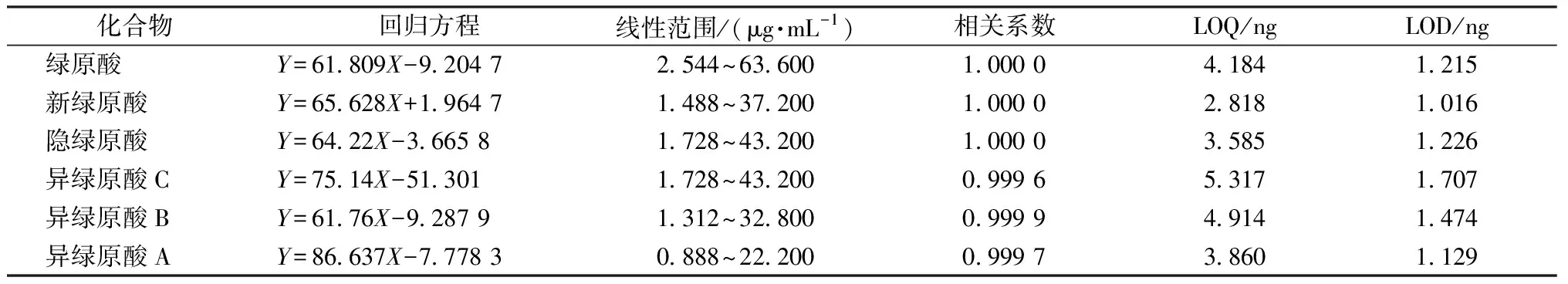
表1 线性关系结果
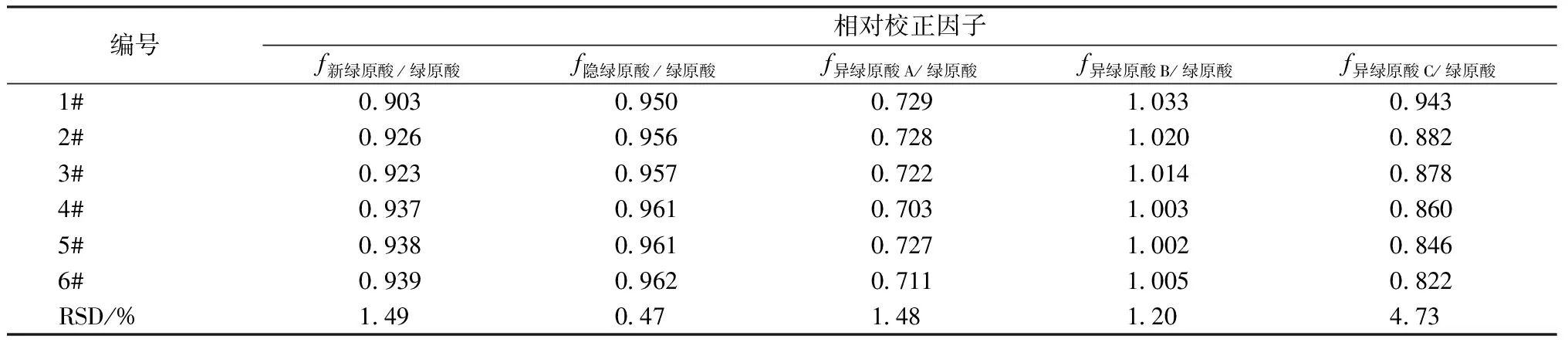
表2 相对校正因子计算结果(n=2)
2.5.2 校正因子的重现性考察 采用Zorbax SB-C18色谱柱,分别考察了Agilent 1100和Waters 2695_2998液相色谱系统;采用Agilent 1100液相色谱仪,考察了3种不同型号的色谱柱(Zorbax SB-C18、BDS Hypersil C18、Phenomenex Luna);采用Agilent 1100液相色谱仪、Zorbax SB-C18柱,分别考察了不同柱温(25、30、35 ℃)、不同体积流量(0.5、0.6、0.8 mL/min)对绿原酸类成分相对校正因子的影响,结果各成分的相对校正因子的重现性良好(RSD<5%),结果见表3。
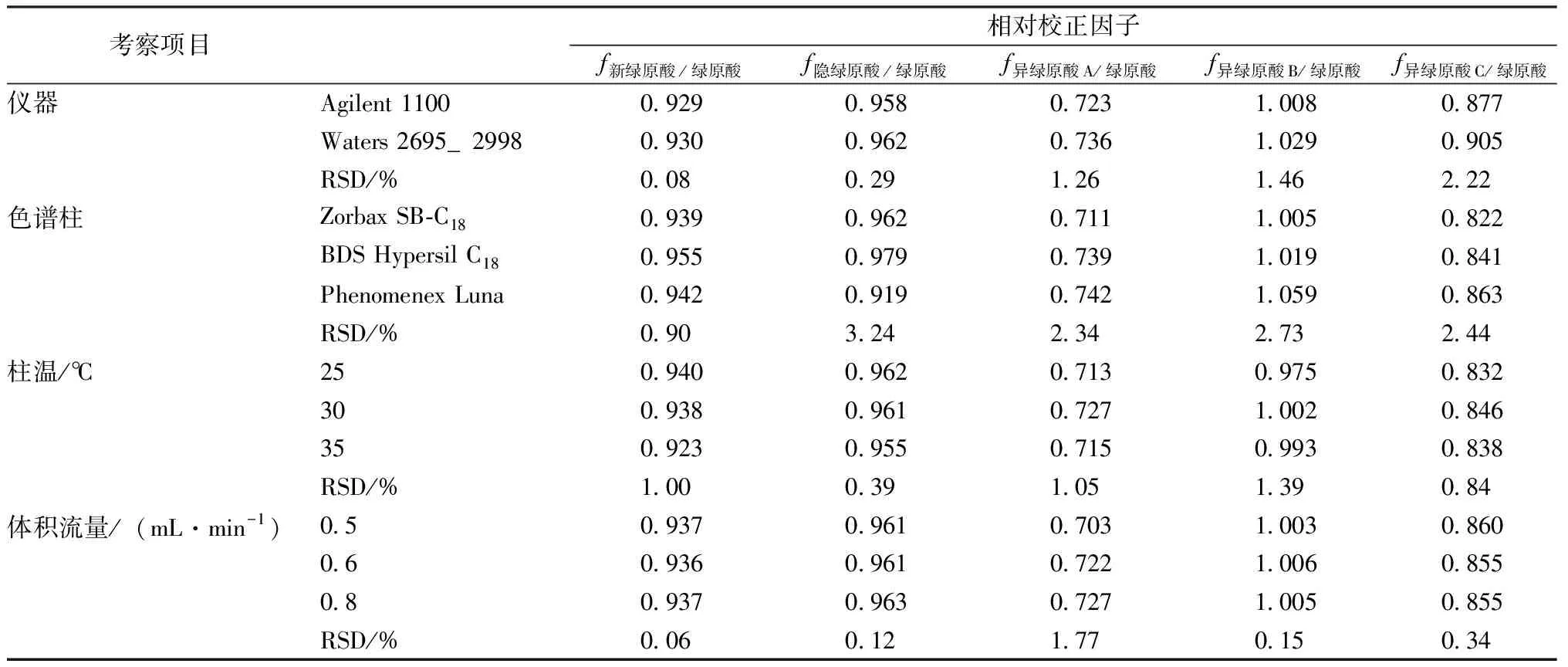
表3 相对校正因子重现性考察结果(n=2)
2.5.3 相对校正因子的确定 根据《一测多评法建立的技术指南》[9],综合上述影响相对校正因子的因素,将各次试验获得的相对校正因子取平均值,最终确定新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B及异绿原酸C的相对校正因子分别为0.934、0.958、0.722、1.011、0.860。
2.6 待测色谱峰的定位 本研究采用相对保留值法进行绿原酸类成分色谱峰的定位。结果表明相对保留值的波动较小,其RSD均小于5%,结果见表4。
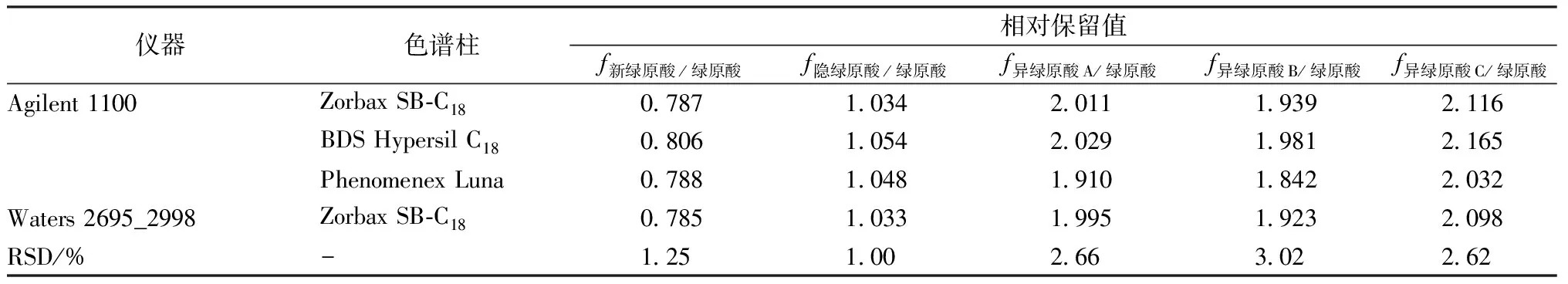
表4 各成分的相对保留值(n=2)
2.7 “一测多评”法与外标法测定结果的比较 分别精密吸取“2.1.2”项下不同厂家及同一厂家不同批次的清开灵注射液10 μL注入高效液相色谱仪,测定。采用外标法和“一测多评”法计算清开灵注射液中6种绿原酸类成分的量,结果见表5~6。
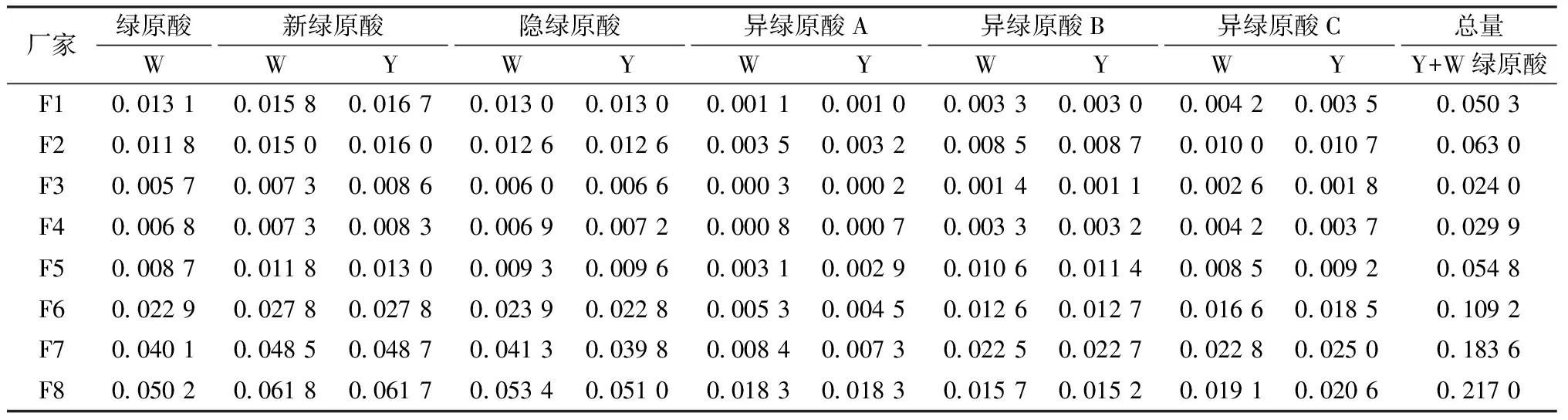
表5 8个厂家注射液中的绿原酸类成分测定结果(mg·mL-1,n=2)
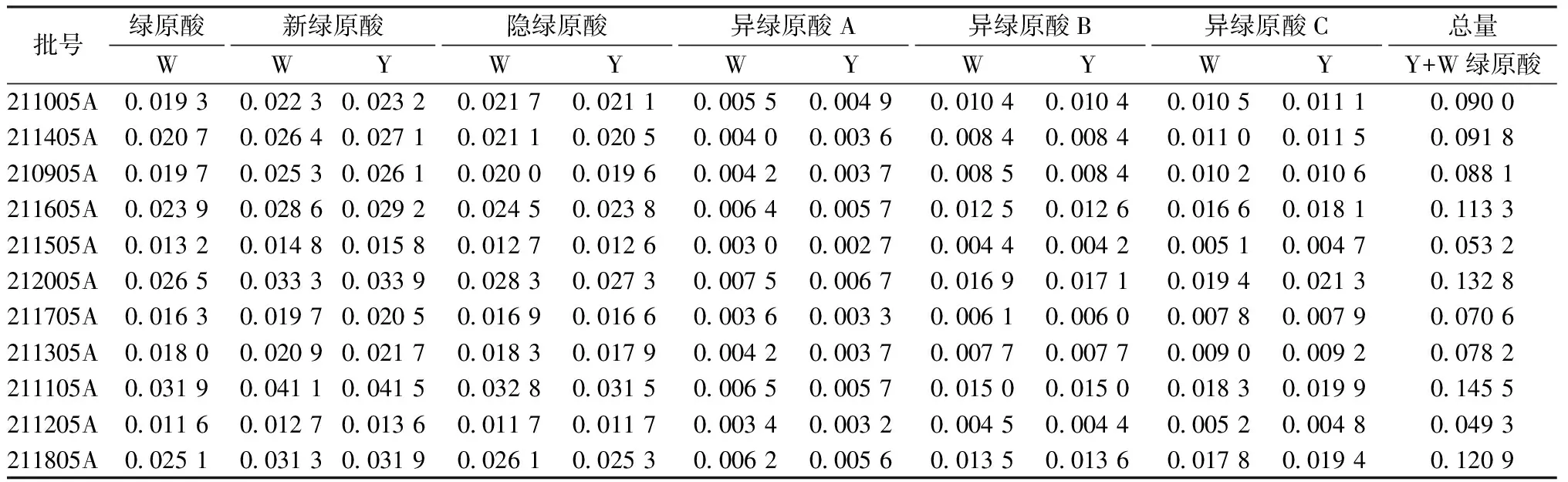
表6 同一厂家(F6)不同批次注射液中的绿原酸类成分测定结果(mg·mL-1,n=2)
外标法与“一测多评”所测结果经t检验和Pearson相关分析,两种方法测得的成分量没有显著性差异。
8个厂家注射液中绿原酸类成分的量存在较大差异,其中异绿原酸C和异绿原酸B量的最低值与最高值相差分别达14倍和20倍之多,其他4种成分相差约7~10倍。同一厂家不同批次绿原酸类成分的量也存在一定差异,各成分量最低值与最高值相差约3~4倍。
3 讨论
3.1 相对于其他5种有机酸类成分,绿原酸常作为金银花药材及含金银花的中药制剂中主要指标性成分,且该成分比较常见、价廉易得,因此选取绿原酸作为内参物,建立该成分与其他5种有机酸的相对校正因子。
3.2 采用“一测多评”法进行多成分的质量评价,各成分相对校正因子的获得和待测成分色谱峰的定位至关重要。本实验针对影响相对校正因子重现性的仪器、色谱柱、柱温、体积流量进行了考察,结果均表明本实验所获得的相对较正因子具有较好的可靠性。在进行待测成分色谱峰定位时,分别对相对保留值和保留时间差进行了考察,结果利用保留时间差进行定位时,新绿原酸和隐绿原酸的RSD大于10%,不符合要求。但采用相对保留值结果良好,6种成分的RSD均小于5%,最终选择相对保留值作为定位色谱峰的依据。
3.3 不同厂家的注射液中绿原酸类成分的量差异较大,可能是由于产品的原药材不同或生产工艺不同造成的。为保证清开灵注射液的质量,应对其生产工艺进行统一,加强原药材的质量控制及中间体、成品的监测。
参考文献:
[1] 曹 进, 徐 燕, 王义明, 等. 多波长高效液相色谱法测定清开灵注射液中3种有效成分[J]. 药物分析杂志, 2004, 24(1): 8-11.
[2] 周海燕, 李 丹. 高效液相色谱法测定清开灵注射液中绿原酸含量[J]. 中国药业, 2011, 20(1): 36-37.
[3] 武彦舒, 金 城, 张 倩, 等. 清开灵注射液中10种有效成分的同时测定及其质量相关性研究[J]. 光谱学与光谱分析, 2009, 29(11): 3112-3116.
[4] 张 倩, 张加余, 隋丞琳, 等. HPLC-DAD-ESI-MS/MS研究金银花水提工艺中绿原酸类成分的变化规律[J]. 中国中药杂志, 2012, 37(23): 14-18.
[5] Zhang Jiayu, Zhang Qian, Li Ning,etal. Diagnostic fragment-ion-based and extension strategy coupled to DFIs intensity analysis for identification of chlorogenic acids isomers inFlosLoniceraeJaponicaeby HPLC-ESI-MSn[J].Talanta, 2013, 104: 1-9.
[6] Ma Yuanchun, Wang Xiaoqian, Hou Feifei,etal. Rapid resolution liquid chromatography(RRLC) analysis and studies on the stability of Shuang-Huang-Lian preparations[J].JPharmBiomedAnal, 2011, 54(2): 265-272.
[7] Makiko T, Kazuko N, Seiichiro I,etal. Changes in caffeic acid derivatives in sweet potato (IpomoeabatatasL.) during cooking and processing[J].JPharmBiomedAnal, 2006, 70(1): 172-177.
[8] 顾利红, 朱品业. 日光和温度对绿原酸供试液稳定性的影响[J]. 中成药, 1999, 21(11): 568-569.
[9] 王智民, 钱忠直, 张启伟, 等. 一测多评法建立的技术指南[J]. 中国中药杂志, 2011, 36(6): 657-658.
[10] 李 倩, 刘 伟, 罗祖良, 等. 一测多评法测定丹参中丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ、二氢丹参酮Ⅰ的含量[J]. 中国中药杂志, 2012, 37(6): 824-828.
[11] 吉丽娜, 冯伟红, 王智民, 等.“一测多评”法与外标法测定三黄片中4种黄芩黄酮类成分[J]. 中成药, 2012, 34(11): 2128-2133.