施用不同生物有机肥对连作黄瓜枯萎病防治效果及其机理初探
袁玉娟, 胡 江, 凌 宁, 仇美华, 沈其荣, 杨兴明*
(1 南京农业大学江苏省固体废弃物资源化高技术研究重点实验室, 江苏南京 210095; 2 南通农业职业技术学院,江苏南通 226007)

利用优质的有机肥作为介质,加入功能型拮抗菌进行二次固体发酵,研发一种新型的生物有机肥(bio-organic fertilizer, BIO)。通过足量的有机物质提供生防菌以足够的营养与能源物质,帮助生防菌在土壤中定殖和繁殖,充分发挥生防菌促进作物生长和拮抗某些土传病原微生物等作用。本试验通过施用菌株SQR9和T37二次固体发酵获得的生物有机肥,采用营养钵育苗方法检验BIO控制连作障碍地黄瓜枯萎病及促进黄瓜生长的能力,并对二菌株在黄瓜根际的定殖情况进行观察,初步揭示了这两株拮抗菌的生防机理。
1 材料和方法
1.1 试验材料
1.1.1 供试菌株 试验中所用的拮抗菌和病原菌均为本实验室筛选,其中拮抗真菌为哈茨木霉属(Trichodermaharzianum) T37、 拮抗细菌为枯草芽孢杆菌属(Bacillussubtilis)SQR9以及菌株SQR9的GFP标记菌株SQR9-G。病原菌为尖孢镰刀菌黄瓜专化型(FOC)。

1.1.3 黄瓜品种 “津春4号”(天津黄瓜研究所)。
1.1.4 供试土壤和肥料 营养钵育苗土壤为未种植过黄瓜的健康水稻土;大盆土壤为黄瓜枯萎病发病土壤(采自江苏徐州铜山县)。供试微生物有机肥(本实验室自行研制)为氨基酸有机肥料和猪粪按1 ∶1比例混合发酵而成。氨基酸有机肥料含有机质44.2%、 氨基酸8.0%、 N 4.4%、 P2O52.3%、 K2O 0.67%和水分28.5%;猪粪堆肥含有机质30.4%、 N 2.01%、 P2O53.7%、 K2O 1.1%和水分28.5%。
1.2 盆栽试验

1.2.2 黄瓜种子准备 黄瓜种子用0.02%的氯化汞消毒5分钟,无菌水冲洗三次,放置在无菌的纱布中30℃催芽。


盆栽试验处理: 1) CK (CK营养钵+CK盆钵);2) OF (OF营养钵+OF盆钵);3) BIOⅠ(BIOⅠ营养钵+ BIOⅠ盆钵);4) BIOⅡ (BIOⅡ营养钵+ BIOⅡ盆钵);5) BIOⅢ(BIOⅢ营养钵+ BIOⅢ盆钵)。
1.2.4 统计方法 黄瓜移苗后,早晚观察记录植株生长状况。每隔20 d取样,分别取根际土和土体土进行分析。每天记录发病的植株数量,在试验结束时计算累积发病率。发病率(%)=发病株数/(发病株数+健康株数)×100[8]
1.2.5 计算黄瓜根际土中FOC的数量 在试验结束前,采用real-time PCR的方法检测根际土中病原菌FOC的数量。每个处理随机抽取5个盆钵,采集黄瓜根际土样。将黄瓜的根轻轻地剥离出来,抖动植株的根,大的土壤颗粒被抖落,将粘结比较紧密的土壤从植物的根上剥落收集起来作为黄瓜的根际土。荧光定量PCR 扩增反应体系[9]为25μL,SYBR® Premix ExTaqTM(2×) (TakaRa) 混合液13 μL,上下游引物各0. 5 μL,DNA 模板2 μL,双蒸水9 μL。荧光定量PCR 扩增条件[9]: 95℃ 2 min,94℃ 15 s,58℃ 15 s,72℃10 s,40个循环。
1.3 生防菌SQR9和T37的根表定殖能力测定
1.3.1 菌液制备 SQR9-G菌液制备: 取-70℃保存的SQR9菌液在LB固体加卡纳霉素的抗性平板上活化,取单菌落接种于3 mL LB加卡纳霉素的液体培养基中,37℃过夜培养。再以1%的接种量转接于100 mL LB加卡纳霉素的液体培养基中,37℃、 170 r/min震荡培养24 h。细菌终浓度为7.3×109cfu/mL。
T37菌液制备: 接种木霉菌株T37于PDA斜面培养基,25℃培养,进行菌种活化。取培养好的木霉菌斜面,加入适量无菌水,刮下分生孢子打散,倒入灭菌的三角瓶中,制成1×107个cfu/mL浮液,作为接种物。按0.5%的比例接种至装有50 mL种子培养基的250 mL三角瓶中,25℃、 130 r/min震荡培养6 d。然后将成熟种子接种至装有100 mL发酵培养基的500 mL三角瓶中,25℃、 180 r/min震荡培养10 d。孢子终浓度为8.2×108cfu/mL。
1.3.2 定殖试验[7]SQR9-G定殖试验: 无菌条件下,在无机培养基中加入0.5 mL菌液,将催芽后的黄瓜种子置于培养基中,15 d后收集黄瓜植株根系制片,分别在荧光显微镜和电镜下进行观察。
T37定殖试验: 采用蛭石,加入10 mL菌液,再将催芽后的黄瓜种子置于蛭石中,定时定量浇水,然后15 d取黄瓜植株根系制片,在电镜下进行观察。
2 结果与分析
2.1 不同处理对黄瓜枯萎病发病率的影响
在黄瓜移植后62 d,各处理的发病率见图1。CK发病率达到100%,施用没有拮抗菌强化的有机肥处理(OF)发病率为88.2%,单独采用菌株SQR9强化的处理BIOⅠ发病率达到51.0%,而单独采用哈茨木霉T37强化的处理BIOⅡ和两个菌株一起强化的处理BIOⅢ,可以将发病率控制在19.6%和13.7%。该结果表明,哈茨木霉T37较枯草芽孢杆菌SQR9能更好地防治黄瓜枯萎病,尤其是施用两个功能菌一起强化的生物有机肥效果更显著。
2.2 不同处理对黄瓜干重的影响
不同有机肥处理对黄瓜的生物量的影响如图2所示,与CK和OF相比,处理BIOⅠ、 BIOⅡ和BIOⅢ的黄瓜干重有显著的提高;处理OF、 BIOⅠ、 BIOⅡ和BIOⅢ的黄瓜干重分别比CK增加了52%、 155%、 146%和158%。BIOⅠ、 BIOⅡ和BIOⅢ表现出了良好的促生能力,SQR9单独强化的BIOⅠ略高于T37单独强化的BIOⅡ,而经SQR9和T37共同强化的BIOⅢ并没有显示出比BIOⅠ或BIOⅡ显著的促生效果。
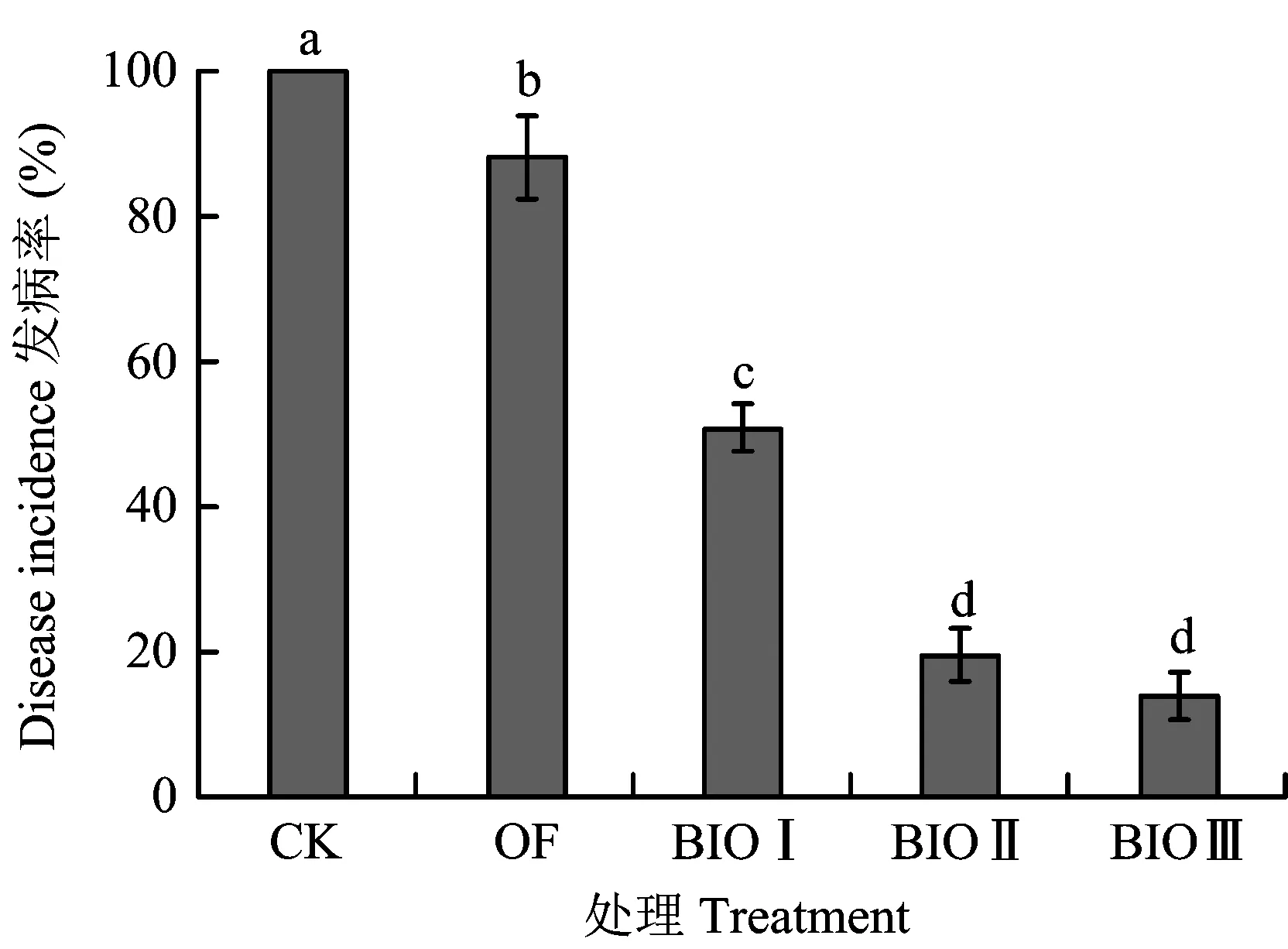
图1 不同处理对黄瓜发病率的影响Fig.1 Effect of different treatments on the Fusarium wilt incidence of the cucumber plants[注(Note): 柱上不同字母表示差异显著(P<0.05)Different letters above the bar mean significant differences at the 0.05 level.]

图2 不同处理对黄瓜干重的影响Fig.2 Effect of different treatments on the dry weight of the cucumber plants[注(Note): 柱上不同字母表示差异显著(P<0.05)Different letters above the bar mean significant differences at the 0.05 level.]
2.3 不同处理对植株高度的影响
从植株的生长高度来看,不同处理也存在显著差异(图3)。处理OF、 BIOⅠ、 BIOⅡ和BIOⅢ的地上部株高分别为CK的1.44、 2.20、 2.18和2.53倍;处理BIOⅠ和BIOⅢ的地下部高度较CK分别增加了0.55和1.20倍,而CK、 OF和BIOⅡ间差异不显著。结果表明,施用BIOⅠ和BIOⅢ能显著促进植株生长。
2.4 不同处理对尖孢镰刀菌数量的影响
尖孢镰刀菌黄瓜专化型是黄瓜枯萎病的致病菌,土壤中尖孢镰刀菌的数量直接影响到枯萎病的发病情况。由表1可以看出连作土壤中病原菌达到×107copies/g,土,施用普通有机肥能使病原菌的数量降低一个数量级左右,约为×106copies/g,土,施用BIOⅠ土壤中病原菌为×105copies/g,土;而BIOⅡ和BIOⅢ处理能显著降低土壤中病原菌的数量,均降低到×103copies/g,土。
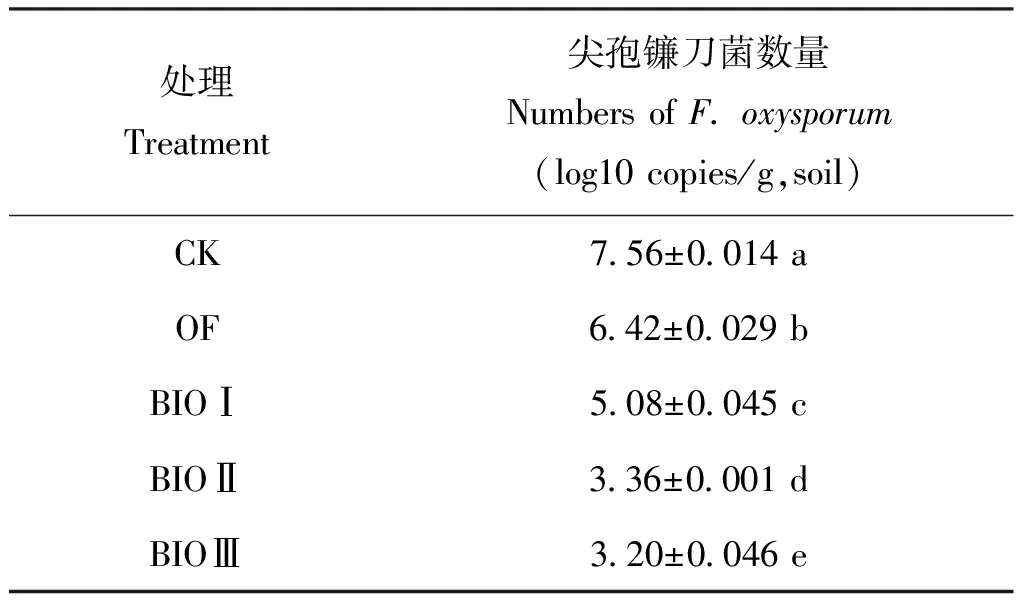
表1 不同处理对黄瓜根际尖孢镰刀菌数量的影响Table 1 Effect of different treatment on numbers of Fusarium oxysporum f. sp. cucumerinum in cucumber rhizosphere
注(Note): 数值后小写字母表示处理间达5%显著水平 Values followed by small letters mean significant differences atP<0. 05.
2.5 菌株SQR9根际定殖
为了更好地了解枯草芽孢杆菌SQR9在黄瓜根系的行为,我们采用GFP标记的SQR9-G,研究了该菌株在黄瓜根际的定殖情况。培养15 d后,图4-A为荧光显微镜拍摄的图片,由图片可清晰地观察到黄瓜根表附着大量的SQR9-G,并在根表形成大量菌斑;图4-B为电镜拍摄的图片,同样能够反映该菌体在黄瓜根系有效定殖,在根表形成生物膜。拮抗菌在植物根系的定殖是其实现预定的生防效果的保证,而SQR9在黄瓜根系良好的定殖情况,是解释其促进植物生长、 抑制病原菌数量的机理之一。
2.6 生防木霉T37根际定殖
培养15 d后,由图5-A扫描电子显微镜拍摄的图片,可以清晰地看到T37的菌丝附着在黄瓜根表,并产生了大量的附着胞子。冷冻处理后可以更清晰地观察到T37缠绕在黄瓜根表(图5-B)。
3 讨论
枯草芽抱杆菌通过成功定殖至植物根际、 体表或体内,与病原菌竞争植物周围的营养,分泌抗菌物质以抑制病原菌生长,同时诱导植物防御系统抵御病原菌入侵,从而达到生防的目的[10]。木霉菌对植物病原真菌的拮抗作用包含多种机制,一般认为有竞争作用、 重寄生作用及抗生作用[11]。国内外很多研究同时证明,枯草芽孢杆菌[12-14]和木霉[15-17]不仅能防治土传病害,而且还能作为促生菌来促进作物生长。本研究中使用了本实验室筛选的两株高效拮抗菌株(枯草芽孢杆菌SQR9和哈茨木霉T37),比较了单一菌株和复合菌株复合有机肥制成的几种不同生物有机肥防治土传黄瓜枯萎病的效果,结果发现施用经单一菌株(SQR9或T37)或混合菌株制成的生物有机肥料都能够有效地控制连作障碍地黄瓜枯萎病,其中复合菌株制成的生物有机肥(BIOⅢ)能将发病率控制在13.7%(图1)。从生物量看(图2),施用BIO处理的植株,生物量显著高于CK和OF处理,相对于CK处理,BIOⅢ处理提高了1.5倍。这说明SQR9和T37对黄瓜的生长都有一定的促进作用。另外,从植株高度看,施用BIO处理的植株,无论是地上部还是地下部,都显著高于CK和OF处理。结果证明,SQR9和T37都能够有效促进黄瓜生长。较BIOⅡ处理,BIOⅠ和BIOⅢ处理无论是地上部还是地下部的植株高度都有相对的提高,其原因可能是枯草芽孢杆菌SQR9相对于木霉T37更能够促进黄瓜作物的生长。
单一的菌株制剂[18-21]或者纯有机肥产品[22-25]对连作土壤中枯萎病的防治效果都很有限。本研究采用拮抗菌菌株与优质氨基酸有机肥二次固体发酵制成的新型生物有机肥,集成了拮抗菌和有机肥的优点,不仅抑制病原菌生长,减少枯萎病的发生,同时提供充足的养分,促进作物生长。产品几乎对环境没有副作用,基本符合农业可持续发展的要求。试验中所用有机肥不仅提供充足养分供植物生长需要,而且提供足够养分供拮抗菌生长,从而提高拮抗菌的竞争能力。吴洪生等[26]研究表明芽孢杆菌和有机肥复合后制成的生物有机肥能抑制西瓜枯萎病;张慧等[27]研究指出,施用拮抗棉花黄萎病的生物有机肥使棉花黄萎病的病情指数显著降低;Saravanan T等[28]报道在土壤中使用荧光假单胞杆菌和苹果渣混合物能很好地抑制香蕉枯萎病;张树生等[29]用枯草芽孢杆菌SQR5和多粘芽孢杆菌SQR21混合强化的有机肥料能有效防治黄瓜枯萎病。这与本研究得出的各种生物有机肥与传统的有机肥相比,对土传黄瓜枯萎病的防治效果更为明显(图1)的结果相一致。因此,利用多株拮抗菌复合有机肥制成的生物有机肥能够有效提高生防菌株的防治效果,并且这将成为生物防治土传病害的重要趋势之一,然而不同生防菌之间是如何协同作用的,还有待进一步的研究。
引入植物根部的生防菌最终能否发挥防病促生的效果,很大程度上取决于该菌在不断伸展的植物根围的定殖能力,定殖能力强弱决定着生防的成功与失败[30]。本研究中也通过荧光显微镜和电镜观察发现生防菌SQR9和T37能在黄瓜根系表面大量的定殖。结果还发现SQR9还能在根表形成生物膜,这与前人报道的多粘芽孢杆菌在植物根际定殖方式相似[31]。本研究中还采用了营养钵育苗施用BIO的方式,我们认为这种施用方式更适合生防制剂的生态行为[7],它能较好地发挥根际施肥的优势,使有益拮抗微生物在黄瓜苗期就定殖于植株根际。施用的BIO中含有足量的有机物质供给功能微生物以足够的能源物质,使这些功能微生物易于在土壤中定殖,形成优势群落[32]。功能微生物一旦成为优势群落,就能分泌足够量的具有特定生物活性的次生代谢物质(植物激素、 抗生素等),在植物根系表面形成有效的“生物防御层”[31],抑制病原菌的生长,保护黄瓜根系免受病原菌的侵入,从而降低了黄瓜枯萎病的发病率。
由于能在黄瓜植株根表形成“生物防御层”,移入盆钵土壤后黄瓜根系定能有效抵御尖孢镰刀菌病原菌的侵入,并能显著降低根表尖孢镰刀菌的数量。我们通过real-time PCR方法对黄瓜根际病原菌计数(表1)后发现: 在黄瓜根际,BIOⅠ处理、 BIOⅡ处理和BIOⅢ处理的FOC数量显著低于CK处理,说明BIO提供的拮抗菌能够占领病原菌的生态位,抑制了FOC的生长[31]。经过BIOⅢ处理后,FOC数量可以下降到103水平。BIOⅡ处理和BIOⅢ处理的病原菌数量没有显著的差异,病原菌数量都低于BIOⅠ,这种结果可能是由于哈茨木霉T37有更好的定殖能力。对比发病率和病原菌数量的结果,可以发现发病率高的处理根际病原菌的数量也高,反之亦然。发病率的高低取决于根际土壤的尖孢镰刀菌数量[33]。
参考文献:
[1] Feng D T, Li B D. The development of resistance breeding of cucumber and theFusariumoxysporumf. sp.cucumerinum[J]. China Vegetables, 1994, (5): 56-58.
[2] 易齐. 嫁接换根防治保护地黄瓜枯萎病[J]. 病虫测报, 1992, 12(1): 38-39.
Yi Q. Grafting and change roots to prevent and control the cucumber wilt in protected soil[J]. Plant Pest Forecasts, 1992, 12(1): 38-39.
[3] Booth C. The Genus Fusarium. CMI. Kew, Surrey, England, 1971: 222-231.
[4] 彭埃天, 宋晓兵, 凌金锋, 等. 香蕉枯萎病菌4号生理小种分子检测与枯萎病生物防治研究进展[J]. 果树学报, 2009, 26(1): 77-81.
Peng A T, Song X B, Ling J Fetal. Advances in research on molecular detection and biological control ofFusariumoxysporumf. sp. cubense race 4[J]. J. Fruit Sci., 2009, 26(1): 77-81.
[5] Ozaktan H, Bora T. Biological control ofFusariumoxysporumf. sp. melonis by the formulations ofFluorescentpseudomonads[J]. J. Turkish Phytopathology, 2000, 29(2-3): 133-149.
[6] 殷晓敏, 陈弟, 郑服丛. 尖镰孢枯萎病生物防治研究进展[J]. 广西农业科学, 2008, 39(2): 172-178.
Yin X M, Chen D, Zheng F C. Advance in biological control ofFusariumoxysporum[J]. Guangxi Agric. Sci., 2008, 39(2): 172-178.
[7] Ning L, Xue C, Huang Q Wetal. Development of a mode of application of bioorganic fertilizer for improving the biocontrol efficacy toFusariumwilt[J]. BioControl, 2010, 55: 673-683.
[8] 武英, 侯翠丽, 林晓兰, 等. 黄瓜枯萎病田间药效试验[J]. 福建热作科技, 2006, 31 (3): 12-14.
Wu Y, Hou C L, Lin X Letal. Chemical control of the cucumberFusariumwilt[J]. Fujian Sci. Tech Trop. Crops, 2006, 31 (3): 12-14.
[9] 赵爽, 罗佳, 凌宁, 等. 基因宏阵列和荧光定量PCR方法对西瓜枯萎病害土壤中尖孢镰刀菌的快速检测和定量[J]. 土壤学报, 2010, 47 (4): 704-706.
Zhao S, Luo J, Lin Netal. Quick check and quantification ofFusariumoxysporumin soil with macroarray and real-time PCR method[J]. Acta Pedol. Sin., 2010, 47 (4): 704-706.
[10] 黄曦, 许兰兰, 黄荣韶, 等. 枯草芽抱杆菌在抑制植物病原菌中的研究进展[J]. 生物技术通报, 2010, (l) 24-29.
Huang X, Xu L L, Huang R Setal. Advances of B. Subtilis in inhibiting phytopathogenic fungi and bacteria[J]. Biotech. Bull., 2010, (1): 24-29.
[11] 辛雅芬, 商金杰, 高克祥. 拮抗木霉菌的生防机制研究进展[J]. 东北林业大学学报, 2005(4): 88-91.
Xin Y F, Shuang J J, Gao K X. Advances of biological controlling mechanism to antogonize Trichoderma[J]. J. Northeast Forestry U., 2005(4): 88-91.
[12] 陈卫良, 龚鸿飞, 林福呈, 等. 拮抗细菌BacillussubtilisA30对水稻病原菌的抑制作用[J]. 浙江农业大学学报, 1997, 23(6): 649-654.
Chen W L, Gong H F, Lin F Cetal. The antagonistic activities ofBacillussubtillisA30 to rice pathogens[J]. J. Zhejiang Agric Uni., 1997, 23(6): 649-654.
[13] Asaka O, Shoda M. Biocontrol ofRhizoctoniasolanidamping-off of tomato withBacillussubtillisRB14[J]. Appl. Environ. Microbio., 1996, 62(11): 4081-4085.
[14] Leifert C, Li H, Chidburee Setal. Antibiotic production and biocontrol activity byBacillussubtillisCL27 andBacilluspumilusCL45[J]. J. Appl. Bacteriol, 1995, 78(2): 97-108.
[15] Datnoff L E, Nemec S, Pernezny K. Biological control of Fusarium crown and root rot of tomato in Florida usingTrichodermaharzianumandGlomusintraradices[J]. Biol. Control, 1995, 5(3): 427-431.
[16] Duffy B K, Simon A, Weller D M. Combination of Trichoderma koningii withFluorescentPseudomonadsfor control of take-all on wheat[J]. Phytopathology, 1996, 86(2): 188-194.
[17] Coley-Smith J R, Ridout C J, Mitchell C M, Lynch J M. Control of bottom rot disease of lettuce(Rhizotonia solam) using preparations ofTrichodermaviride,T.harzianumor tolclofos-methyl[J]. Plant Pathology, 1991, 40(3): 359-366.
[18] 马艳, 赵江涛, 常志州, 等. 西瓜内生枯草芽孢杆菌BS211的 拮抗活性及盆栽防效[J].江苏农业学报, 2006, 22(4): 388-393.
Ma Y, Zhao J T, Chang Z Zetal. Antagonistic activity of an endophytic strain BS211 ofBacilliussubtilis and its biocontrol efficacy againstFusariumWiltof watermelon[J]. Jiangsu J. Agric. Sci., 2006, 22(4): 388-393.
[19] 葛慈斌, 刘波, 朱育菁, 等. 生防菌NH-BS-2000对西瓜枯萎 病原菌抑制作用的研究[J]. 厦门大学学报(自然科学版), 2004, 43(8): 88-90.
Ge C B, Liu B, Zhu Y Jetal. Study on the inhibition of antagonistic bacteria, NH-BS-2000 againstFusariumoxysporumin watermelon[J]. J. Xiamen Uni.(Natural Sci. Edn.), 2004, 43(8): 88-90.
[20] 王伟, 赵谦, 杨微. 木霉对土传病原尖孢镰刀菌的拮抗作用[J]. 中国生物防治, 1997, 46-47.
Wang W, Zhao Q, Yang W. Antagonism ofTrichodermaVirideT 2 against soil borneFusariumpathogens[J]. Chin. J. Biol. Control, 1997, 46-47.
[21] 庄敬华, 高增贵, 杨长城, 等. 绿色木霉菌T23对黄瓜枯萎病 防治效果及其几种防御酶活性的影响[J]. 植物病理学报, 2005, 35 (2): 179-183.
Zhuang J H, Gao Z G, Yang C Cetal. Biocontrol ofFusariumwilt and induction of defense enzyme activities on cucumber byTrichodermaviridestrain T23[J]. Acta Phytopathologica Sin., 2005, 35 (2): 179-183.
[22] 张树生, 杨兴明, 黄启为, 等. 施用氨基酸肥料对连作条件下 黄瓜的生物效应及土壤生物性状的影响[J]. 土壤学报, 2007, 44 (4): 689-694.
Zhang S S, Yang X M, Huang Q Wetal. Effect of application of amino acid fertilizer on biological properties of cucumber plants and soil microorganisms under continuous mono-cropping[J]. Acta Pedol. Sin., 2007, 44 (4): 689-694.
[23] Claire S W, Sabine H, Claude A. Increased soil suppressiveness toFusariumwilt of flax after addition of municipal solid waste compost[J]. Soil Biol. Biochem., 1996, 28(9): 1207-1214
[24] Fulton H R. Organic fertilizers and cotton wilt control[J]. Science, 1927, 66(1704): 193-194.
[25] Kavroulakisa N, Constantinos E, Ntougiasa S.etal. Local and systemic resistance against fungal pathogens of tomato plants elicited by a compost derived from agricultural residues[J]. Physiol. Molecular Plant Pathology, 2005, 66 (5): 163-174.
[26] Wu H S, Yang X M, Fan J Qetal. Suppression ofFusariumwilt of watermelon by a bio-organic fertilizer containing combinations of antagonistic microorganisms[J]. BioControl, 2009, 54: 287-295.
[27] 张慧. 防治棉花黄萎病微生物有机肥的研制及其生物效应[D]. 南京农业大学硕士学位论文, 2008.
Zhang H. Development of microbial organic fertilizer to controlVerticilliumwilt of cotton and its biological effect[D]. Ms Thesis of Nanjing Agric. U., 2008.
[28] Saravanan T, Muthusamy Metal. Development of integrated approach to manage theFusarialwilt of banana[J]. Crop Protec., 2003, 22(9): 1117-1123.
[29] Zhang S S, Waseem Razaetal. Control ofFusariumwilt disease of cucumber plants with the application of a bioorganic fertilizer[J]. Biol. Fertil. Soils, 2008, 44: 1073-1080.
[30] 张炳欣, 张平, 陈晓斌. 影响引入微生物根部定殖的因素[J]. 应用生态学报, 2000, 11(6): 951-953.
Zhang B X, Zhang P, Chen X B. Factors influencing the colonization of micro-organisms introdued in root.[J]. Chin. J. Appl. Ecol., 2000, 11(6): 951-953.
[31] 凌宁, 王秋君, 杨兴民, 等. 根际施用微生物有机肥防治连作 西瓜枯萎病研究[J]. 植物营养与肥料学报, 2009, 15(5): 1136-1141.
Ling N, Wang Q J, Yang X Metal. Control ofFusariumwilt of watermelon by nursery application of bio-organic fertilizer[J]. Plant Nutr. Fert. Sci., 2009, 15(5): 1136-1141
[32] 杨兴明, 徐阳春, 黄启为, 等. 有机(类)肥料与农业可持续发展和生态环境保护[J]. 土壤学报, 2008, 45(5): 926-932.
Yang X M, Xu Y C, Huang Q Wetal. Organic fertilizers and the sustainable development of agriculture and ecological environment protection[J]. Acta Pedol. Sin., 2008, 45(5): 926-932.
[33] Timmusk S, Grantcharova N, Wagner E G.Paenibacilluspolymyxainvades plant roots and forms biofilms[J]. Appl. Environ. Microb., 2005, 71(11): 7292-7300.

