尿毒症皮肤瘙痒多因素分析
梁云川 刘娜 刘英权
皮肤瘙痒属于尿毒症患者临床常见并发症之一,轻者引发不适,重者可能致皮肤抓破感染,引发其它病症而加重病情。统计表明,皮肤瘙痒在尿毒症行血液透析患者中的发生率可高达60% ~90%[1],已经越来越成为临床关注的研究课题之一。目前学界对于尿毒症发生皮肤瘙痒的机制尚不明确,但已有报道认为其与皮肤干燥、神经病变、肥大细胞、过敏反应、甲状旁腺功能亢进等诸多因素相关[2]。本文探讨甲状旁腺激素(PTH)、二价离子、血浆白蛋白(Alb)等实验室指标与尿毒症皮肤瘙痒的相关性。
1 资料与方法
1.1 一般资料 选取我院2012年1~12月间血液净化中心行血液透析治疗的尿毒症患者58例作为研究对象,男35例,女23例;年龄25~76岁,平均年龄(48.2±7.2)岁。根据临床是否发生皮肤瘙痒将患者分组,瘙痒组32例,男21例,女11例;年龄25~74岁,平均年龄(47.3±6.8)岁;原发病:高血压肾病12例,慢性肾小球肾炎16例,梗阻性肾病2例,多囊肾2例。无瘙痒组26例,男18例,女8例;年龄26~76岁,平均(48.4 ±7.6)岁;原发病:高血压肾病 8 例,慢性肾小球肾炎12例,梗阻性肾病2例,多囊肾4例。2组年龄、性别比、原发病比较差异无统计学意义(P>0.05),具有可比性。
1.2 排除标准 (1)合并有系统性红斑狼疮、冠心病、糖尿病等其他系统性疾病患者;(2)合并有银屑病、皮炎、湿疹等其他皮肤类疾病患者;(3)主观不愿意接受本研究涉及的相关实验室指标检查患者。
1.3 方法 采用前瞻性研究方法,于透析前分别留取入选患者空腹静脉血进行相关实验室指标测定,包括:PTH、肌酐(Scr)、血清尿素氮(BUN)、血红蛋白(Hb)、Alb、磷离子(P3+)、镁离子(Mg2+)、钙离子(Ca2+)等。
1.4 统计学分析 应用SPSS 18.0统计软件,计量资料以表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 PTH和蛋白水平 2组患者PTH和蛋白水平检测结果,瘙痒组PTH水平明显高于无瘙痒组,Hb和Alb水平明显低于无瘙痒组,2组比较差异有统计学意义(P<0.01)。见表1。
表1 2组患者PTH和蛋白水平实验室指标检测结果比较±s
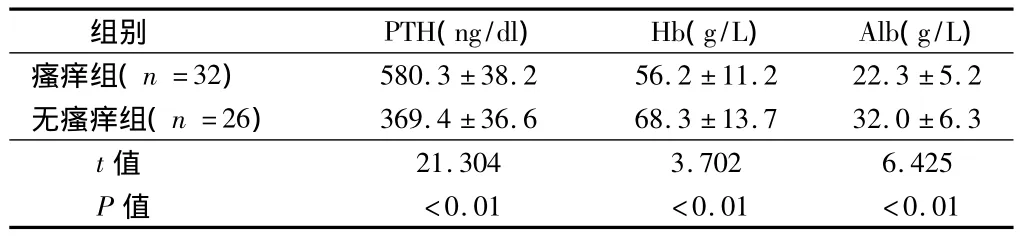
表1 2组患者PTH和蛋白水平实验室指标检测结果比较±s
组别 PTH(ng/dl) Hb(g/L) Alb(g/L)瘙痒组(n=32)580.3 ±38.2 56.2 ±11.2 22.3 ±5.2无瘙痒组(n=26) 369.4 ±36.6 68.3 ±13.7 32.0 ±6.3 t值21.304 3.702 6.425 P值 <0.01 <0.01 <0.01
2.2 P3+和二价离子 2组患者P3+和Ca2+、Mg2+实验室指标检测结果,瘙痒组患者P3+、Mg2+含量均明显高于无瘙痒组,Ca2+明显低于无瘙痒组,2组比较差异有统计学意义(P<0.01)。见表2。
表2 2组患者P和二价离子实验室指标检测结果比较mmol/L,±s

表2 2组患者P和二价离子实验室指标检测结果比较mmol/L,±s
组别 P3+ Mg2+ Ca2+瘙痒组(n=32)2.2 ±0.6 1.3 ±0.3 1.2 ±0.3无瘙痒组(n=26) 1.0 ±0.4 0.8 ±0.2 2.1 ±0.4 t值8.735 7.279 9.499 P值 <0.01 <0.01 <0.01
2.3 肾功能指标 2组患者肾功能指标经实验室检测结果比较,2组Scr和BUN水平比较差异无统计学意义(P>0.05)。见表3。
表3 2组患者肾功能指标实验室检测结果比较±s
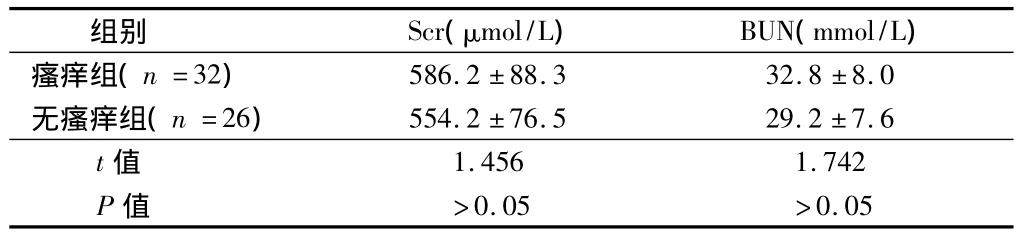
表3 2组患者肾功能指标实验室检测结果比较±s
组别 Scr(μmol/L) BUN(mmol/L)瘙痒组(n=32)586.2 ±88.3 32.8 ±8.0无瘙痒组(n=26) 554.2 ±76.5 29.2 ±7.6 t值1.456 1.742 P值 >0.05 >0.05
3 讨论
皮肤瘙痒在尿毒症患者中十分常见,尤其是行维持性血液透析患者发生皮肤瘙痒的可能性更高[3]。当然,瘙痒感及瘙痒程度受患者主观感知和耐受程度的影响,然而,皮肤瘙痒的发生仍然直接影响到了患者的生活质量,甚至可能因此而影响患者情绪和对原发症治疗的信心,出现抑郁、轻生等念头[4,5]。
诸多报道指出甲状旁腺功能亢进可能是引发尿毒症患者皮肤瘙痒的一个重要因素[6],多年来临床研究显示,切除甲状旁腺的尿毒症患者其皮肤瘙痒的症状明显减轻或消失,提示PTH水平的变化与尿毒症皮肤瘙痒相关。尿毒症患者机体内多存在离子失衡问题,可能对甲状旁腺产生反射性刺激,造成功能性亢进,释放PTH,使其在血液中浓度升高。而PTH分泌量的提高又对蛋白质和氨基酸的利用产生影响,使蛋白质的合成受限,致Hb和Alb水平下降。另外,透析过程中也可能造成蛋白质丢失。蛋白质含量的下降易造成机体的营养不良,引发皮肤干燥和色素沉着,表皮过度角化,进而出现瘙痒症状。因而Hb水平和Alb水平改变可能与皮肤瘙痒的诱发有关。
尿毒症患者存在慢性肾功能不全,肾小管的P3+、Mg2+清除率明显受限,肾小球滤过率下降,因而易造成磷排泄减少致高磷血症和高镁血症,实验室检测则表现为瘙痒患者血中P3+、Mg2+高于无瘙痒患者。但在Ca2+的检测方面目前仍有争议,有报道认为尿毒症患者机体对钙的吸收减少,故而钙经肠道的排出量增加,因软组织钙化而引发低钙血症[7];也有研究认为,由于血液透析液的置换作用,使患者血液中的Ca2+浓度增加;本组研究结果显示Ca2+水平增高。一方面,血液中二价离子的浓度提升与瘙痒的发生及程度呈正相关[8];另一方面该类离子均属于大分子,易导致皮肤瘙痒。因此,P3+及二价离子含量的变化与皮肤瘙痒具有相关性。在本组研究中还发现,肾功能相关检测指标Scr和BUN在2组间比较差异无统计学意义,说明皮肤瘙痒与尿毒症患者的肾功能无明显相关性。
综上所述,尿毒症患者PTH水平、蛋白水平和离子水平与皮肤瘙痒的发病具有相关性,但皮肤瘙痒的发生与尿毒症患者肾功能尚无明确的相关性。
1 刘瑞,赵静,柯昌云.尿毒症皮肤瘙痒的发病机制及中西医治疗.中国老年保健医学,2012,10:56-58.
2 杨双莲.中西医结合治疗尿毒症皮肤瘙痒的临床效果分析.中国现代医生,2010,48:110-111.
3 马卫国.息风止痒汤辅助治疗尿毒症皮肤瘙痒的临床观察.湖北中医杂志,2012,34:44-45.
4 王京军,任可,周昆.解表祛风止痒颗粒治疗尿毒症患者皮肤瘙痒.中国新药与临床杂志,2010,29:691-692.
5 崔秀娴,国春玲,杨庆春.紫外线光疗仪照射治疗56例尿毒症患者皮肤瘙痒的临床观察.中外医疗,2010,13:99-100.
6 邢洁.尿毒症患者皮肤瘙痒症发病机制与治疗进展.浙江中西医结合杂志,2011,21:137-140.
7 陈国富,黄韬韬.尿毒症皮肤瘙痒的西医研究进展.医学美学美容,2012,12:192-193.
8 王勤,高瑾,蒋凤,等.连续多次HDF与HD+HP对尿毒症皮肤瘙痒的疗效比较.西南国防医药,2012,22:1189-1190.

