右美托咪定对七氟醚所致幼鼠学习障碍和抑制突触蛋白表达的影响
焦林波 刘永哲 马丽 潘宁玲
七氟醚是小儿麻醉常用的吸入麻醉药,具有入睡和苏醒迅速,气道刺激小等优点。但吸入麻醉药异氟醚和七氟醚可引起幼年大脑广泛的神经细胞凋亡,突触功能缺陷和持续认知功能障碍[1]。右美托咪定是一种高选择性的α2受体激动剂,具有镇静、镇痛的作用,可用于小儿的术前用药、术后镇痛、镇静。一定剂量的右美托嘧啶可以减轻7日幼年大鼠脑内异氟醚所致的神经细胞凋亡,具有神经保护的作用[2,3]。突触功能与学习认知密切相关,突触素(Synaptophysin)和突触后致密物-95(post synaptic density 95,PSD-95)是两种典型的突触相关蛋白,直接或间接地反映突触活性、突触形态变化及突触的生物学功能。本实验以7日幼鼠为研究对象,研究右美托咪定能否减轻七氟醚所致幼年大鼠长期学习记忆障碍和对海马突触蛋白表达的影响。
1 材料与方法
1.1 一般材料 健康清洁级7日龄Sprague-Dawley(SD)幼鼠90只(军事医学科学院实验动物中心),雌雄不限,体重12~20 g。Ohmeda210麻醉机(Datex-Ohmeda公司,芬兰),F-MCI气体监测仪(Datex-Ohmeda公司,芬兰),Morris水迷宫(中国医学科学院药物研究所),七氟醚(雅培制药有限公司,英国),右美托咪定(江苏恒瑞医药股份有限公司,批号:13082832)。
1.2 方法
1.2.1 分组:经北京军区总医院动物伦理委员会批准,90只大鼠随机分为对照组(n=15),七氟醚组(n=25),右美托咪定组(n=25)和七氟醚+右美托咪定组(n=25)。均有母鼠母乳喂养,21日龄断奶,随后雌雄分笼喂养,给予清洁饮食及饮水,室温维持在22℃,每日予以12 h光照,12 h黑暗环境。对照组不接受麻醉,其中5只大鼠用于Western Blot分析,5只大鼠用于RT-PCR分析,5只大鼠用于Morris水迷宫行为学测定。其余每组中10只用于Western Blot分析,10只用于RT-PCR分析,时间点为麻醉后1 d和7 d,每个时间点5只;剩余5只大鼠用于Morris水迷宫测定,检测时间点为麻醉后5周(42日龄)。
1.2.2 模型制作:将七氟醚组大鼠放置于自制麻醉箱(30 cm×15 cm×15 cm)内,麻醉箱有两个侧孔,一侧连接麻醉机,用麻醉气体挥发罐控制麻醉气体输出浓度,另一侧接气体监测仪持续监测流出气体中麻醉气体浓度。七氟醚吸入浓度为2%,氧气流量为2 L/min,麻醉时间为4 h。右美托咪定组大鼠按照25 μg/kg进行腹腔注射。七氟醚+右美托咪定组在腹腔注射25 μg/kg右美托咪定后将大鼠放置麻醉箱内吸入2%七氟醚,时间为4 h。在麻醉过程中用新生儿脉搏血氧饱和度(SpO2)探头贴于大鼠腹壁,监测SpO2设心率。各组大鼠皮肤红润,呼吸平稳,未出现死亡现象。预实验表明,吸入麻醉4 h后大鼠的血气分析显示血糖、氧分压、酸碱度等指标正常。麻醉结束后大鼠自然苏醒,并与母鼠同窝饲养。
1.2.3 取材:在麻醉后1 d和7 d,将大鼠断头处死,在冰块上快速取出双侧海马,置于液氮中4 h,-70℃保存。
1.2.4 Western Blot分析:海马组织内按 1 mg∶10 μl加入裂解液,匀浆10 min、4℃ 12 000 g离心10 min之后取上清,BCA法蛋白定量。根据目的蛋白的相对分子质量,配制12%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶,根据蛋白浓度调整上样量,保持40 μg一致。浓缩、电泳分离后转移至 PVDF膜。转移后的PVDF置于5%脱脂奶粉(PBS配置)中封闭,37℃轻摇 2 h,洗膜 3次,分别加入 β-actin(1∶5 000,Chemicon公司,美国)、一抗兔抗鼠突触素单克隆抗体或兔抗鼠PSD-95多克隆抗体(1∶400,Abcam公司,英国)杂交反应于4℃轻摇过夜,洗膜2次,每次15 min,加入二抗辣根过氧化物酶(HRPO)偶联的鼠抗兔 IgG 抗体(1∶5 000,Chemicon 公司,美国),杂交反应室温轻摇1 h,洗膜6次,每次5 min,加入LumiGOL化学发光底物(Chemicon公司,美国)反应5 min后保鲜膜包裹,暗室进行X线胶片曝光、显影和定影。将得到的X胶片上的实验结果采用Kodak Image Station系统扫描。应用Image J分析软件进行半定量分析,与内参的灰度比值作为突触素、PSD-95和p-mTOR的表达水平。
1.2.5 RT-PCR:采用 Trizol提取海马组织总 RNA,紫外分光光度计260/280 nm测定RNA浓度和纯度,琼脂糖电泳检测RNA完整性。500 ng总RNA在25 μl反应体系内进行cDNA逆转录。cDNA保存于-20℃备用。内参照采用β-actin,突触素、PSD-95和mTOR引物序列为:
突触素:(sense)5’-TGCCATCTTCGCCTTTGCTA-3’(antisense)5’-TTGGTAGTGCCCCCTTTGAC-3’(174 bp)
PSD-95:(sense)5’-CCCCCAGACATCACAACCTC-3’(antisense)5’-GATGGATCACGATCCGCCTT-3’(184 bp)
mTOR:(sense)5’-TGTCGAGAGGCAACAACCTC-3’(antisense)5’-TTGTTGGCTGCATTGTGACG-3’(298 bp)
扩增产物经琼脂凝胶电泳,紫外灯下照像,在图像分析系统上进行密度扫描,用突触素,PSD-95和mTOR的基因扩增产物的密度与β-actin基因扩增产物比值表示基因表达水平。
1.2.6 行为学检测:4组剩余大鼠在麻醉后5周时进行Morris水迷宫试验测定空间学习记忆能力。Morris水迷宫由直径150 cm,高60 cm的圆形水池和一个可移动的高30 cm,直径15 cm的平台组成,水池内水位至平台上1.5 cm。实验为期5 d,分别于上午和下午各进行4次实验,并记录大鼠寻找平台的时间(逃避潜伏期),找到平台后允许动物在平台上停留30 s;如果大鼠在120 s内未找到平台,记为120 s。每日8次成绩的平均值为当日成绩。测试过程中保持实验室内灯光、物品等空间参照物摆放位置不变,水温保持在(25.0 ±1.0)℃,以排除干扰因素。
1.3 统计学分析 应用SPSS 13.0统计软件,计量资料以表示,组内比较采用单因素方差分析,post-hoc采用LSD法比较每组不同时间点之间的差异,组间比较采用双因素方差分析(药物与时间),post-hoc采用Bonferroni法进行组间不同时间点的比较,P<0.05为差异有统计学意义。
2 结果
2.1 行为学检测 对照组、右美托咪定组和七氟醚+右美托咪定组大鼠随着训练次数的增加,逃避潜伏期呈逐渐下降的趋势,在训练的第3天开始趋于稳定,训练第3、4、5天平均逃避潜伏期无显著性差异(P>0.05),但明显低于第2天的成绩(P<0.05);七氟醚组大鼠学逃避潜伏期在训练第4天趋于稳定,训练第4、5天平均逃避潜伏期无显著差异(P>0.05),显著低于第2天的成绩(P<0.05);4组的稳定平均逃避潜伏期无差异(P>0.05),但学习质量与其余3组相同,右美托咪定和七氟醚+右美托咪定麻醉对大鼠的学习认知功能并不产生影响。组间双因素方差分析显示,只有时间因素存在组间差异(P<0.01),药物因素并无组间差异,即七氟醚、右美托咪定和七氟醚+右美托咪定对大鼠的训练成绩具有相同的影响。见图1。
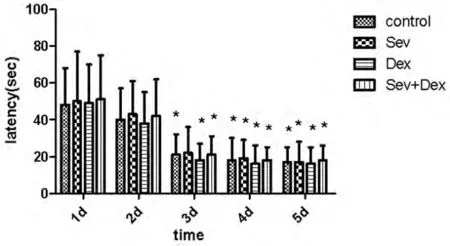
图1 不同药物对大鼠水迷宫训练平均逃避潜伏期的影响注:与第2 天比较,*P <0.05
2.2 Western Blot结果
2.2.1 突触素蛋白水平:与对照组相比,七氟醚麻醉后1 d和7 d突触素水平显著降低(P<0.01);右美托咪定麻醉后7 d突触素水平显著降低(P<0.01),1 d时无显著变化;七氟醚和右美托咪定共同作用后各时点突触素水平均无显著差异(P>0.05)。组间双因素方差分析显示,时间和药物均影响对突触素的表达;与七氟醚组相比,右美托咪定和七氟醚+右美托咪定麻醉后1 d和7 d突触素表达均显著增高(P<0.05)。见图2。

图2 不同药物对幼鼠海马内突触素蛋白表达的影响注:与对照组比较,*P <0.01;与七氟醚组相比,#P <0.05
2.2.2 PSD-95蛋白水平:与对照组相比,七氟醚和右美托咪定麻醉后1 d和7 d PSD-95水平均显著下降(P<0.01);七氟醚+右美托咪定麻醉后1 d PSD-95水平无显著变化,7 d时显著下降(P<0.01)。组间双因素方差分析显示,药物和时间对PSD-85水平均有显著影响(P<0.05,0.01);与七氟醚组相比,右美托咪定组在1 d和7 d时均无显著变化,而七氟醚+右美托咪定组在1 d和7 d时均显著增加(P<0.05)。见图3。

图3 不同药物对幼鼠海马内PSD-95蛋白表达的影响注:与对照组比较,*P <0.01;与七氟醚组相比,#P <0.05
2.2.3 p-mTOR蛋白表达水平:与对照组相比,七氟醚麻醉后1 d p-mTOR水平无显著变化,7 d水平显著降低(P<0.01);右美托咪定麻醉后1 d和7 d pmTOR水平均显著降低(P<0.05,0.01);七氟醚 +右美托咪定麻醉后1 d和7 d p-mTOR水平均显著降低(P<0.05)。组间双因素方差分析显示,只有时间因素具有组间差异(P<0.01),药物因素组间无显著差异(P>0.05),即三种药物组合对p-mTOR蛋白的影响相同。见图4。
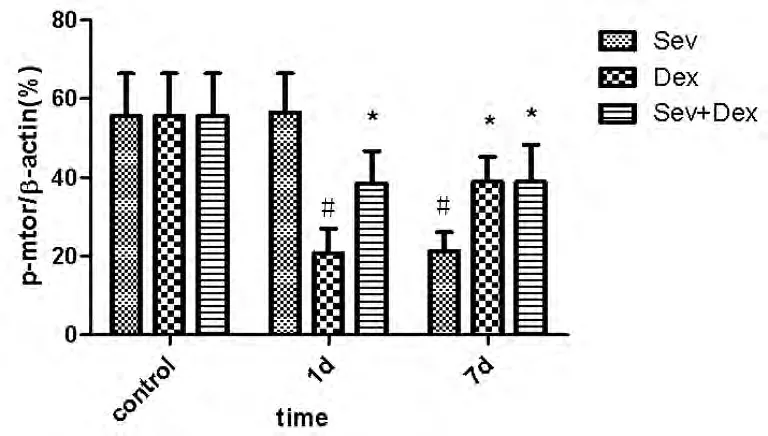
图4 不同药物对大鼠新生海马内p-mTOR蛋白表达的影响注:与对照组比较,*P <0.05,#P <0.01
2.3 RT-PCR 结果
2.3.1 突触素 mRNA表达水平:与对照组相比,七氟醚组、右美托咪定组和七氟醚+右美托咪定组麻醉后1 d和7 d突触素 mRNA水平均显著降低(P<0.01)。组间双因素方差分析显示,药物和时间均影响突触素mRNA的表达水平;以七氟醚组相比,右美托咪定和七氟醚+右美托咪定麻醉后1 d突触素mR-NA表达均无显著影响,但7 d时均显著增高(P<0.01)。见图5。

图5 不同药物对幼鼠海马内突触素mRNA表达的影响注:与对照组比较,*P <0.01;与七氟醚组相比,#P <0.01
2.3.2 PSD-95 mRNA表达水平:与对照组相比,七氟醚组和右美托咪定组麻醉后1 d和7 d、七氟醚+右美托咪定组麻醉后7 d PSD-95 mRNA水平均显著降低(P<0.01)。组间比较双因素方差分析显示,药物和时间均影响PSD-95 mRNA表达水平;与七氟醚组相比,右美托咪定组麻醉后7 d PSD-95 mRNA表达水平显著增高(P<0.01),但1 d时无显著变化;右美托咪定+七氟醚组麻醉后1 d和7 d PSD-95 mRNA表达水平均显著增高(P<0.01)。见图6。
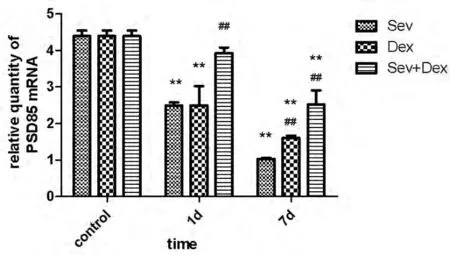
图6 不同药物对幼鼠海马内PSD-95mRNA表达的影响注:与对照组比较,*P <0.01;与七氟醚组相比,#P <0.01
2.3.3 mTOR mRNA表达水平:与对照组相比,七氟醚组麻醉后1d mTOR mRNA水平无显著变化,7 d时显著降低(P<0.01),右美托咪定组和七氟醚+右美托咪定组麻醉后1 d和7 d mTOR mRNA水平均显著降低(P<0.01)。组间双因素方差分析显示,只有时间因素具有组间差异(P<0.01),药物因素组间无显著差异,即三种药物组合对mTOR mRNA水平的影响相同。见图7。

图7 不同药物对幼鼠海马内mTOR mRNA表达的影响注:与对照组比较,*P <0.01
3 讨论
每年越来越多的新生儿和婴幼儿在全麻下接受检查和手术,在此时期人类的神经系统仍在飞速成长,以突触形成为特征。2003年,Jevtovic-Todorovic等[4]发现,在7日龄大鼠中联合使用术中麻醉药物(咪唑安定和异氟醚),可引发大鼠神经元细胞的死亡并引起脑功能长期受损。2周岁内接受手术和麻醉的儿童发生成年后行为异常的机率增加,提示麻醉可能是后续出现学习障碍和行为异常的重要因素[5]。因此,研究全麻药物对大脑发育的影响显得尤为重要。
人类的神经系统在出生是并未完全发育成熟,出生后仍在飞速成长,以突触形成为特征[6]。出生至7 d是大鼠脑神经元最敏感,极易受到损伤,该时期也是啮齿类动物颗粒细胞生成的高峰期[7],国内外多采用此时期的大鼠做为研究对象探讨损伤因素对神经损伤及认知功能发育的影响。新生大鼠七氟醚最低肺泡有效浓度(MAC)约为2%[8],因此,本实验选用了7日龄大鼠吸入1MAC七氟醚。
幼年阶段,右美托咪定对中枢神经信号系统具有营养作用,可激活细胞生存信号如Ras-Raf-pERK通路[9-11],该通路激活后可抑制NMDA拮抗剂所导致的神经细胞凋亡,具有神经保护作用[12]。右美托咪定还可以增加成年大鼠中枢缺血损伤后抗凋亡蛋白mdm2和bcl-2的表达[13],在体外可以上调脑源性神经营养因子和 pERK 信号通路[10,14,15],还可剂量依赖型的减轻异氟醚引起的7 d大鼠海马神经元损伤,抑制capase-3表达,改善异氟醚所起的认知功能缺陷,25 μg/kg的保护作用最强[2]。因此,本实验中采用了腹腔注射25 μg/kg的剂量。
学习和记忆是脑的高级机能,神经突触可塑性是由神经活性引起的神经元之间信息传递效能的增强或减弱,被认为是学习和记忆能力重要的细胞基础。突触可塑性主要表现在突触功能和结构上的修饰和改变,包括调节突触前递质的合成、储存、释放、突触后膜上的受体数量,蛋白的磷酸化程度,及其一些相关突触蛋白的丢失等[16,17]。突触素是位于突触囊泡上的囊泡吸附蛋白,是突触前神经元功能的一种标记蛋白[18],可调节突触囊泡的释放、转运以及增强递质与突触后膜受体结合等过程,在突触可塑性调节中发挥重要作用,与动物学习记忆功能密切相关[19]。PSD-95是突触后致密区最丰富的蛋白之一,能影响突触及神经元的可塑性,以及神经递质和其他神经营养因子的合成,并参与了学习记忆的调节过程,敲除PSD-95基因的小鼠神经细胞LTP的产生明显减少,突触可塑性受损,学习和记忆功能出现障碍[20];阿尔茨海默病患者脑内神经淀粉样变性导致突触结构发生改变,突触素和PSD-95的含量减少,记忆和认知功能功能障碍[21,22]。本实验结果表明,七氟醚和右美托咪定均可显著抑制幼鼠海马内突触素和PSD-95的蛋白表达和mRNA水平,右美托咪定对突触素的抑制程度明显弱于七氟醚,并显著减轻七氟醚的抑制作用,使突触素和PSD-95的蛋白和mRNA水平升高,其保护机制可能是右美托咪定通过激活α2受体和咪唑啉Ⅱ受体,上调pERK表达,达到抗凋亡和调节突触可塑性的作用[3,23]。
研究表明,异氟醚和七氟醚可引起7日龄幼鼠海马和皮层神经元凋亡,前者的诱导凋亡显著高于后者,这种作用是具有浓度依赖型和暴露时间依赖性的,42日龄时水迷宫实验中表现均无异于对照组[1],可能的原因是全麻药浓度过低,均为1MAC,在这个浓度下,异氟醚和七氟醚对行为学均会产生一定的影响,尤其是异氟醚,对幼鼠海马依赖的记忆都会产生显著影响,但不会引起长期的空间记忆和空间工作能力的改变[24]。本研究中也采用了1MAC七氟醚,三种药物组合对大鼠成年后的学习质量均无影响,但我们还是发现七氟醚组大鼠的学习速度下降,但七氟醚+右美托咪定组大鼠的学习速度无显著变化,说明行为学上右美托咪定可改善七氟醚对学习速度的影响。
mTOR是一种丝氨酸/苏氨酸蛋白激酶,它能调控细胞的生长和增殖。在非增殖性组织中,mTOR对于轴突的导向、树突的发育和树突棘的形态发生发挥着重要的作用[25],可调节突触可塑性,影响学习和记忆[26]。与突触可塑性调节相关的蛋白如:CamKIIα、PSD-95、离子型谷氨酸受体NMDA受体和AMPA受体的亚基作为mTOR通路的靶基因,mTOR通路的活化直接上调这些蛋白的表达进而调节突触的可塑性[27]。本实验发现,三种药物组合均显著抑制幼鼠海马内pmTOR蛋白和 mTOR mRNA水平,且组间无差异,与PSD-95的表达相符,说明七氟醚和右美托咪定可能通过抑制mTOR通路,影响突触蛋白的表达,但右美托咪定可能是通过另外的机制发挥其保护作用,有待研究。
综上所述,右美托咪定可以减轻七氟醚所致幼鼠长期学习记忆障碍和对海马突触蛋白的抑制作用,这种保护作用并不是通过p-mTOR途径发挥作用的。
1 Liang G,Ward C,Peng J,et al.Isoflurane causes greater neurodegeneration than an equivalent exposure of sevoflurane in the developing brain of neonatal mice.Anesthesiology,2010,112:1325-1334.
2 Sanders RD,Xu J,Shu Y,et al.Dexmedetomidine attenuates isofluraneinduced neurocognitive impairment in neonatal rats.Anesthesiology,2009,110:1077-1085.
3 Sanders RD,Sun P,Patel S,et al.Dexmedetomidine provides cortical neuroprotection:impact on anaesthetic-induced neuroapoptosis in the rat developing brain.Acta Anaesthesiol Scand,2010,54:710-716.
4 Jevtovic-Todorovic V,Hartman RE,Izumi Y,et al.Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits.J Neurosci,2003,23:876-882.
5 Kalkman G,Peelen L,Moons KG,et al.Behavior and development in children and age at the time of first anesthetic exposure.Anesthesiology,2009,110:805-812.
6 Ikonomidou C,Bosch F,Miksa M,et al.Blockade of NMDA receptors and apoptotic neurodegeneneration in the developing brain.Science,1999,283:70-74.
7 Jiang W,Duong TM,de Lanerolle NC.The neuropathology of hyperthermic seizures in the rat.Epilepsia,1999,40:5-19.
8 Wang QJ,Li KZ,Yao SL,et al.Different effects of isoflurane and sevoflurane on cytotoxicity.Chin Med J(Engl),2008,121:341-346.
9 Winzer-Serhan UH,Leslie FM.Expression of alpha2A adrenoceptors during rat neocortical development.J Neurobiol,1999,38:259-269.
10 Wang Q,Lu R,Zhao J,et al.Arrestin serves as a molecular switch,linking endogenous alpha2-adrenergic receptor to SRC-dependent,but not SRC independent,ERK activation.J Biol Chem,2006,281:25948-25955.
11 Philipp M,Brede ME,Hadamek K,et al.Placental alpha(2)-adrenoceptors control vascular development at the interface between mother and embryo.Nat Genet,2002,31:311-315.
12 Hansen HH,Briem T,Dzietko M,et al.Mechanisms leading to disseminated apoptosis following NMDA receptor blockade in the developing rat brain.Neurobiol Dis,2004,16:440-453.
13 Engelhard K,Werner C,Eberspacher E,et al.The effect of the alpha 2-agonist dexmedetomidine and the N-methyl-D-aspartate antagonist S(+)-ketamine on the expression of apoptosis regulating proteins after incomplete cerebral ischemia and reperfusion in rats.Anesth Analg,2003,96:524-531.
14 Dahmani S,Paris A,Jannier V,et al.Dexmedetomidine increases hippocampal phosphorylated extracellular signal-regulated protein kinase 1 and 2 content by an alpha 2-adrenoceptor-independent mechanism:Evidence for the involvement of imidazoline I1 receptors.Anesthesiology,2008,108:457-466.
15 Dahmani S,Rouelle D,Gressens P,et al.Effect of dexmedetomidine on brain derived neurotrophic factor expression in rat hippocampal slices(abstract).Anesthesiology,2006,105:A681.
16 Rapoport SI.In vivo imaging for evaluating synaptic integrity in Alzheimer disease.Psychol Neuropsychiatr Vieil,2005,3:97-106.
17 Trinchese F,Fa M,Liu S,et al.Inhibition of calpains improves memory and synaptic transmission in a mouse model of Alzheimer disease.J Clin Invest,2008,118:2796-2807.
18 Wiedenmann BFranke WW.Identification and localization of synaptophysin,an integral membrane glycoprotein of Mr 38,000 characteristic of presynaptic vesicles.Cell,1985,41:1017-1028.
19 Ding Y,Li J,Lai Q,et al.Functional improvement after motor training is correlated with synaptic plasticity in rat thalamus.Neurol Res,2002,24:829-836.
20 Mattar PA,Holmes KD,Dekaban GA.The NR1-4 C-terminus interferes with N-methyl-D-aspartate receptor-mediated excitotoxicity:evidence against a typical T/SXV-PDZ interaction.Neuroscience,2005,132:281-298.
21 Gylys KH,Fein JA,Yang F,et al.Synaptic changes in Alzheimer’s disease:increased amyloid-beta and gliosis in surviving terminals is accompanied by decreased PSD-95 fluorescence.Am J Pathol,2004,165:1809-1817.
22 Dickson DW,Crystal HA,Bevona C,et al.Correlations of synaptic and pathological markers with cognition of the elderly.Neurobiol Aging,1995,16:285-298.
23 Dahmani S,Paris A,Jannier V,et al.Dexmedetomidine increases hippocampal phosphorylated extracellular signal-regulated protein kinase 1 and 2 content by an alpha 2-adrenoceptor-independent mechanism:evidence for the involvement of imidazoline I1 receptors.Anesthesiology,2008,108:457-466.
24 Satomoto M,Satoh Y,Terui K,et al.Neonatal exposure to sevoflurane induces abnormal social behaviors and deficits in fear conditioning in mice.Anesthesiology,2009,110:628-637.
25 Choi YJ,Di Nardo A,Kramvis I,et al.Tuberous sclerosis complex proteins control axon formation.Genes Dev,2008,22:2485-2495.
26 Tang SJ,Reis G,Kang H,et al.A rapamycin-sensitive signaling pathway contributes to long-term synaptic plasticity in the hippocampus.Proc Natl Acad Sci U S A,2002,99:467-472.
27 Takei N,Inamura N,Kawamura M,et al.Brain-derived neurotrophic factor induces mammalian target of rapamycin-dependent local activation of translation machinery and protein synthesis in neuronal dendrites.J Neurosci,2004,24:9760-9769.

