脂多糖对幼年哮喘大鼠Toll样受体4及气道炎症的作用
马力 王亚亭
支气管哮喘简称哮喘,是严重威胁公共健康的慢性肺部炎症性疾病。因环境因素对其发病起着重要的作用,故Strachan提出了卫生假说。Toll样受体(Toll like receptor,TLR)的发现为卫生假说提供了理论依据。TLR4主要识别革兰阴性菌的脂多糖(lipopolysaccharide,LPS)成分,参与调节Th0细胞向 Th1或 Th2细胞增殖分化[1]。其中Th1应答对哮喘有保护作用,Th2能促进哮喘气道变态反应性炎症的形成。本课题针对不同浓度脂多糖对哮喘大鼠肺组织Toll样受体4表达及气道炎症的影响进行研究。
1 材料与方法
1.1 实验动物 清洁级雄性健康SD大鼠50只,体重130~150 g;4~6周龄,由安徽医科大学动物中心提供。随机将其分为对照组(A)、哮喘组(B)、地塞米松组(C)低剂量LPS组(D1)及高剂量LPS组(D2)共5组,每组10只。
1.2 实验方法
1.2.1 SD大鼠哮喘模型建立、样品的留取与保存
1.2.1.1 动物模型的复制:B组大鼠第1、第8天予以OVA/Al(OH)3混合液1 ml[含 Al(OH)3100 mg和OVA 1 mg]腹腔注射致敏,第15天予以1%OVA雾化激发30 min,持续3 d。A组以0.9%氯化钠溶液代替OVA进行致敏与激发。C组:待腹腔注射1 ml含100 μg地塞米松1 h后在致敏和激发。D1组、D2组在致敏阶段每隔2 d 予以 1 ml含 0.1 μg、100 μg E.coil LPS腹腔注射,激发阶段待每次予以相同剂量浓度E.coil LPS腹腔注射1 h后在进行激发。
1.2.1.2 样品的留取与保存:末次激发后1 d,腹腔注射麻醉采用10%水合氯醛溶液400 mg/kg,打开腹腔,腹主动脉取血,离心 10 min,3 000 r/min,吸取血清,-80℃储存备用。胸腔打开,肺组织分离,左主支气管结扎,右肺经气管行灌洗,分4次注入10 ml0.9%氯化钠溶液,轻轻按摩肺组织,30 s后回收灌洗液,回收率超过80%,然后离心10 min,3 000 r/min,取上清-80℃储存备用。细胞沉淀用于细胞总数与分类计数。左肺近肺门组织切取,4%多聚甲醛固定,原位杂交标本固定2~3 h,HE染色和细胞凋亡检测标本固定5~6 h后,转入70%乙醇,常规石蜡包埋切片[2]。
1.2.2 试验方法:通过光镜观察肺组织病理变化及支气管肺泡灌洗液(Bronchoalveolar lavage fluid,BALF)中嗜酸性粒细胞(Eosinophils,EOS)计数,酶联免疫吸附试验、原位杂交法及末端脱氧核苷酰基转移酶介导性dUTP切口末端标记法(Terminal deoxynucleotidyl transferase-mediated dUTP nick end,TUNEL)对各组大鼠肺组织TLR4mRNA表达,血清OVA-sIgE含量及EOS凋亡进行检测。
1.3 统计学分析 应用SPSS 17.0统计软件,计量资料以表示,采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 对哮喘大鼠肺组织的病理变化 高倍镜下观察HE染色肺组织切片,A组肺间质视野清晰,肺组织形态良好,可见肺泡管、小支气管,未见明显炎症细胞浸润。B组肺间质及肺泡腔内、支气管及血管周围大量炎症细胞浸润,支气管黏膜下水肿,黏膜皱褶增多,粘液腺增生。与B组比较,C组和D2组上述现象明显减轻,D1组无明显变化。见图1~5。
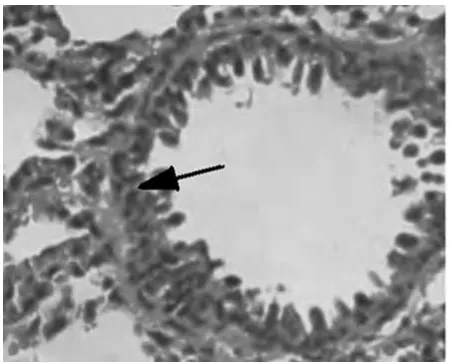
图1 A组大鼠肺组织无炎症细胞浸润(光镜×200)
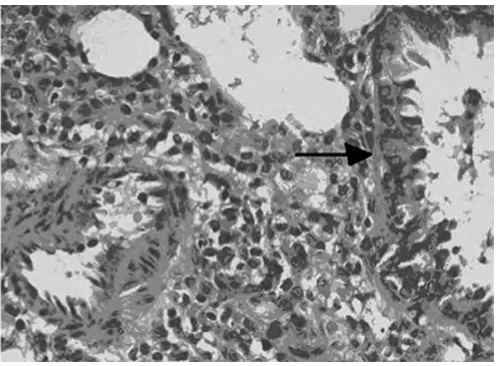
图2 B组大鼠肺组织炎症细胞浸润(光镜×200)
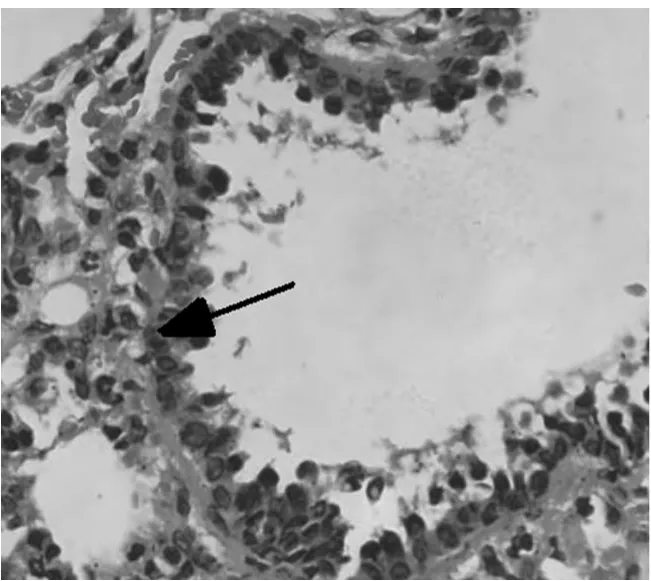
图3 C组大鼠肺组织少量炎症细胞浸润(光镜×200)
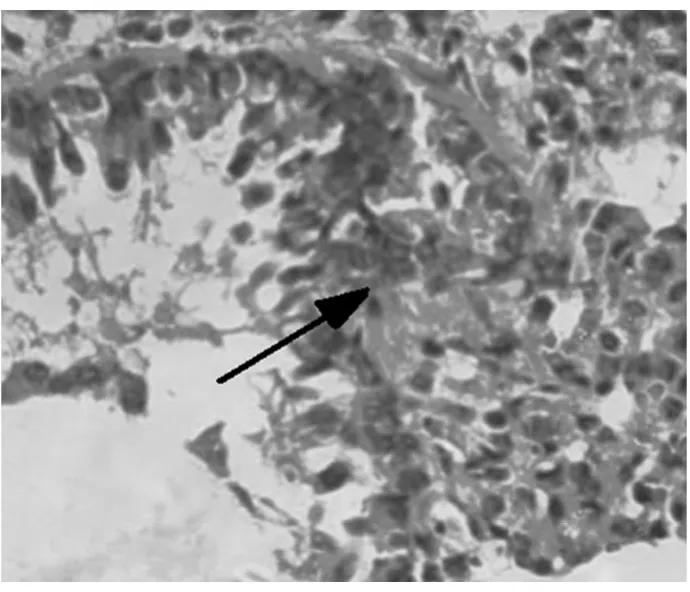
图4 D1组大鼠肺组织炎症细胞浸润(光镜×200)

图5 D2组大鼠肺组织少量炎症细胞浸润(光镜×200)
2.2 对哮喘大鼠炎性细胞的改变 BALF中细胞总数、EOS计数及EOS百分比:B组均明显高于A组(P<0.01);C组和D2组均明显低于B组(P<0.01);D1组与B组均差异无统计学意义(P>0.05)。见表1。
表1 5组大鼠BALF中细胞总数、EOS计数及EOS百分比比较±s

表1 5组大鼠BALF中细胞总数、EOS计数及EOS百分比比较±s
注:与 B 组比较,*P <0.01
组别 细胞总数(×109/L) EOS计数(×107/L) EOS百分比(%)A 组 2.00 ±0.11* 1.13 ±0.16* 0.56 ±0.05*B 组 4.28 ±0.08 34.43 ±1.42 8.03 ±0.19 C 组 2.41 ±0.04* 4.84 ±0.49* 2.01 ±0.18*D1 组 4.33 ±0.07 34.59 ±0.76 7.99 ±0.08 D2 组 2.31 ±0.05* 4.33 ±0.67* 1.87 ±0.25*
2.3 对哮喘大鼠OVA-sIgE含量的影响 OVA-sIgE含量:C组、D2组与A相比有明显差异(P<0.01),但较B组有明显降低(P<0.01)。D1组与B组比较无统计学差异(P>0.05)。见表2。
表2 5组大鼠血清OVA-sIgE含量比较μg/ml,±s

表2 5组大鼠血清OVA-sIgE含量比较μg/ml,±s
注:与 B 组比较,*P <0.01;与 A 组比较,#P <0.01
组别OVA-sIgE A 组 14.72 ±1.69*B 组 82.33 ±2.93 C 组 44.62 ±2.72*#D1 组 84.38 ±2.31 D2 组 42.12 ±2.90*#
2.4 对哮喘大鼠肺组织TLR4mRNA表达及EOS凋亡的影响 TLR4mRNA表达能力:A组与B组差异无统计学意义(P>0.05);C组、D1组、D2组均明显高于B组(P<0.01);D1组明显低于 D2组(P<0.01)。EOS凋亡率:B组和D1组有少许核深染为棕褐色的凋亡细胞。A组、C组、D2组较B组增多(P<0.05 或 <0.01)。见表3、4。
表3 5组大鼠TLR4mRNA表达比较±s

表3 5组大鼠TLR4mRNA表达比较±s
注:与 B 比较,*P <0.01;与D1 组比较,#P <0.01;与 C 组比较,△P <0.01
组别 TLR4mRNA(A值)A组24.60 ±0.48 B 组 25.74 ±1.75 C 组 34.38 ±1.48*D1 组 29.44 ±2.27*D2 组 39.18 ±1.30*#△
表4 5组大鼠肺组织EOS凋亡率比较%,±s

表4 5组大鼠肺组织EOS凋亡率比较%,±s
注:与 B 组比较,*P <0.05,#P <0.05;与 C 组比较,△P <0.01
组别 EOS 凋亡率A 组 8.86 ±0.72*B 组 7.13 ±0.98 C 组 13.34 ±0.61#D1 组 7.14 ±0.64 D2 组 14.66 ±0.85#△
3 讨论
哮喘是威胁公共健康常见的一种慢性肺部疾病,多种炎性细胞浸润是其的一种重要特征[3]。郑燕妮等[4]表明脂多糖来源的髓源抑制性细胞可能通过抑制Th2过度免疫应答和上调小鼠外周血Treg细胞比例,从而减轻哮喘小鼠气道炎症。LPS浓度对Th1/Th2炎症反应具有一定的影响。低剂量LPS可增强Th2敏感性,高剂量LPS可增强Th1反应,表在过敏性炎症反应中LPS具有独特的双向作用[5]。本文通过高倍镜来观察HE染色肺组织切片,结果A组肺间质视野清晰,肺组织形态良好,可见肺泡管、小支气管,未见明显炎症细胞浸润。B组肺间质及肺泡腔内、支气管及血管周围大量炎性细胞浸润,支气管黏膜下水肿,粘膜皱褶增多,粘液腺增生。与B组比较,C组和D2组上述现象明显减轻,D1组无明显变化。本文又通过对BALF中炎症细胞总数及分类计数,结果B组均明显高于A组(P<0.01);C组和D2组均明显低于B组(P<0.01);D1组与B组均差异无统计学意义(P>0.05)。研究说明地塞米松和高剂量LPS能缓解哮喘大鼠气道炎性细胞浸润,而低剂量LPS无此功能。该结果与肺组织病理改变相符。
人群调查表明IgE水平升高与哮喘的增加相关,IgE水平的升高会导致气道黏膜水肿、气道平滑肌痉挛、粘液分泌亢进,从而诱发气道高反应性[6]。Rodriguez等[7]表明,LPS 通过活化 TLR4,可激活天然免疫,抑制致敏小鼠IgE介导的变态反应、EOS募集、肺内炎症、粘液分泌增多及气道高反应性。本文通过ELISA法检测大鼠血清OVA-sIgE水平,结果C组、D2组与A相比有明显差异(P<0.01),但较B组有明显降低(P<0.01)。D1组与B组比较无统计学差异(P>0.05)。本研究表明哮喘组大鼠特异性IgE抗体水平较明显升高,这与哮喘的特征相一致。高剂量LPS可降低血清OVA-sIgE水平,而低剂量LPS对血清OVA-sIgE水平无影响,进一步证实LPS对哮喘的影响具有剂量相关性。
动物实验表明,小剂量LPS小鼠模型可使支气管肺泡灌洗液中嗜酸性粒细胞增多,Th2免疫反应增强,而对照小鼠及TLR4基因缺陷小鼠,却无Th2免疫反应增强[8]。结果说明,Th2应答需TLR4信号,在机体向Th2免疫反应发展中TLR4有着重要的作用。李鸿佳等[9]研究表明低剂量 LPS(0.1 mg/L)诱导哮喘小鼠AM的TLR4高表达,使肺部炎症加重,而高剂量LPS(100 mg/L)可能会减轻变态反应症状。本研究中,TLR4mRNA的细胞胞浆着色呈棕黄色,主要表达于平滑肌细胞,肺巨噬细胞,支气管上皮细胞及EOS等。C组、D1组、D2组均明显高于B组(P<0.01);D1组明显低于D2组(P<0.01)。本研究表明,在免疫系统中TLR4对LPS反应有着重要的作用,LPS能诱导哮喘大鼠肺组织TLR4mRNA表达的上调。低剂量LPS与高剂量LPS均能提高TLR4mRNA表达能力,且随LPS浓度的增高TLR4mRNA表达逐渐增加,而单纯OVA不能刺激TLR4 mRNA表达增强。
嗜酸性粒细胞(Eosinophils,EOS)是哮喘发病机制中主要效应细胞,诱导哮喘患者EOS的凋亡可缓解哮喘病情的严重程度,且不会因细胞死亡而发生局部炎症反应[10]。本研究中,B组和D1组有少许核深染为棕褐色的凋亡细胞。A组、C组、D2组较B组增多(P<0.05或<0.01)。研究说明LPS影响哮喘发展的机制与诱导EOS凋亡有关。
综上所述,高剂量脂多糖能降低血清中OVA-sIgE水平,上调TLR4表达,诱导哮喘大鼠肺组织EOS凋亡;低剂量脂多糖虽激活TLR4信号通路,却不能缓解哮喘的气道炎症。可见,对哮喘大鼠使用高剂量LPS进行干预,在哮喘的防治中,可达到地塞米松的治疗效果。
1 谷元廷,吴河水,徐建波,等.全肝缺血再灌注小鼠肺泡巨噬细胞Toll样受体2/4的表达.郑州大学学报:医学版,2006,41:1047-1049.
2 Celedon JC,Milton DK,Ramsey CD,et al.Exposure to dust mite allergen and endotoxin in early life and asthma and atopy in childhood.Allergy Clin Immunol,2007,120:144-149.
3 Shi L,Wang JS,Liu XM,et al.Upregulated functional expression of Toll like receptor 4 in mesenchymal stem cells induced by lipopolysaccharide.Chin Med J(Enql),2007,120:1685-1688.
4 郑燕妮,于化鹏,陈新,等.脂多糖诱导髓源抑制性细胞对哮喘小鼠气道炎症的影响及其机制.中华医学杂志,2012,92:3147-3150.
5 Hemelaers L,Louis R.Eotaxin:a important chemokine in asthma.Re Med Liege,2006,61:223-226.
6 杨玲,许以平,曹玲仙,等.不同浓度肽聚糖、脂多糖、聚肌胞苷酸对过敏性支气管哮喘患者嗜碱性粒细胞释放能力的作用.上海医学,2008,31:853-855.
7 Rodriguez D,Keller AC,Faquim-Mauro EL,et al.Bacterial lipopolysaccharide signaling through Toll-like receptor 4 suppresses asthma-like responses via nitric oxide synthase 2 activity.J Immunol,2003,171:1001-1008.
8 Eswarappa SM,Basu N,Joy O,et al.Folimycin(concanamycin A)inhibits LPS-induced nitric oxide production and reduces surface localization of TLR4 in murine macrophages.Innate Immun,2008,14:13-24.
9 李鸿佳,王淑娟,李艳丽,等.不同剂量脂多糖预处理对哮喘小鼠肺部炎症的影响的研究.细胞与分子免疫学杂志,2008,24:1008-1010.
10 Hemelaers L,Louis R.Eotaxin:a important chemokine in asthma.Re Med Liege,2006,61:223-226.

