反刍动物饲料碳水化合物和蛋白质组分划分及消化道代谢规律
潘晓花 杨 亮 杨 琴 熊本海
多年来,反刍动物饲料营养价值的评定主要集中在碳水化合物和蛋白质的组分含量、它们在瘤胃内降解和流通规律以及到达后肠道的消化代谢的研究。目前已有的饲料营养价值评定体系主要包括 Weende 体系[1]、Van Soest体系[2]、康奈尔净碳水化合物和蛋白质体系(Cornell Net Carbohydrate and Protein System,CNCPS)[3]和 NRC(2001)体系[4]。其中 Weende体系和 Van Soest体系是传统的饲料营养价值评价方法及其改进版,两者均是静态地研究饲料营养成分,不能反映反刍动物瘤胃动态降解的特征;NRC(2001)体系[4]既吸收了CNCPS在2001年以前的先进理论与技术,又保留了NRC对动物营养物质需要量的研究特色,综合了饲料和动物因素评定饲料营养价值。CNCPS依据降解速率(Kd)的不同将碳水化合物和蛋白质进行划分并不断细分,同时建立了各组分瘤胃动态降解的模型,使得饲料的营养价值评价更加精确。本文对CNCPS中碳水化合物和蛋白质组分的划分及变化、各组分在瘤胃内及后肠道降解规律以及最新的研究成果进行概述,以便更系统地了解CNCPS饲料营养价值评定体系,更加精确地评价饲料营养价值,为更好地优化反刍动物饲粮配方提供参考价值。
1 CNCPS概述
CNCPS是美国康奈尔大学科学家提出的一种反刍动物饲料营养价值评定体系。自CNCPS第1版于 1992—1993 年以 4 篇系列论文[3,5-7]的形式问世后,经过不断改进和完善已发展至CNCPS 6.1[8-10]版本。CNCPS 能够真实反映饲料中的碳水化合物和蛋白质在瘤胃内的降解率、消化率、外流数量以及能量、蛋白质的吸收效率情况,并建立了相应的数学模型。基于CNCPS子模型可以估测不同饲粮特性和环境条件下饲料的消化代谢规律以及动物的生长和产奶性能[11]。
2 碳水化合物和蛋白质组分的划分与计算
碳水化合物是奶牛饲粮组成的重要部分,一般经瘤胃内微生物降解及后肠段的消化吸收而为机体提供能量及营养物质,且其含量和结构对奶牛瘤胃健康、机体代谢以及生产性能产生重要的影响。一般碳水化合物分为纤维性碳水化合物(FC,即纤维素、半纤维素和木质素)和非纤维性碳水化合物(NFC,包括有机酸、单糖、寡糖、果糖、果胶、β-葡聚糖和淀粉)[12],其中饲粮中 NFC 含量和组分的平衡是反刍动物饲粮配制时需要考虑的重要因素。而不同饲料NFC含量及组分构成方面存在差异,同时NFC不同组分因在瘤胃内的Kd、降解程度及降解产物等方面存在差异[13-14],进而会影响到动物生产性能。饲粮中部分蛋白质进入瘤胃后经瘤胃微生物作用降解释放寡肽、氨基酸和氨,而其余部分蛋白质则未受降解进入真胃和小肠。瘤胃内蛋白质降解量受其化学特性,尤其是非蛋白氮和真蛋白质含量、真蛋白质部分的物理和化学特性的影响,此外蛋白质的来源和加工方法的不同也影响其消化代谢[4]。因此,深入研究不同碳水化合物和蛋白质组分的划分、各组分的构成成分及其在瘤胃及后肠段的消化代谢特点显得尤为重要。
2.1 碳水化合物和蛋白质组分的划分
CNCPS根据饲料化学组成、物理特性、瘤胃降解度以及后肠段消化特点,将碳水化合物进行了划分,并且经历了一个逐渐细化的过程。从Sniffen 等[6]至 CNCPS5.0[11],碳水化合物划分为 4部分:CA主要为糖类、有机酸和寡糖,是快速降解部分;CB1为淀粉和果胶,是中速降解部分;CB2为可利用的细胞壁,在瘤胃内缓慢降解;CC为不可利用的纤维,在瘤胃内不被降解。但CA主要是糖类的概括方法过于粗略,忽略了有机酸的作用,且草料和青贮饲料中含有大量的有机酸,而有机酸促进微生物生长的效率低于糖类;同时青贮饲料中乳酸含量较高,与有机酸不同,乳酸可用于合成微生物蛋白[15-16],若忽略 CA 中的有机酸含量而将快速溶解部分全部归类为糖类,则会过高地估计微生物的生长[17]。因此,CNCPS6.1 及 Lanzas等[18]将碳水化合物进一步细分为8部分:CA1(乙酸、丙酸和丁酸等挥发性脂肪酸)、CA2(乳酸)、CA3(有机酸)、CA4(糖类)、CB1(淀粉)、CB2(可溶性纤维)、CB3[可利用中性洗涤纤维(NDF)]和CC(不可利用NDF),这一新碳水化合物划分体系更加接近瘤胃发酵特性,能更精确地评定饲料品质和饲粮NFC的构成。
根据蛋白质在瘤胃内的降解及流通特性,CNCPS将蛋白质划分为3部分,即PA[非蛋白氮(NPN)]、PB(真蛋白质)和 PC(结合蛋白质)[19]。根据瘤胃降解率的不同,PB又细分为PB1、PB2和PB3 3个亚单位。PA(主要是氨、肽和氨基酸)和PB1溶于缓冲溶液,并且PA在瘤胃内快速转化为氨,其中青贮饲料与切短的牧草的可溶性粗蛋白质(soluble crude protein,SolCP)基 本 是 PA[20]。PB1是能溶于缓冲溶液的蛋白质,属于快速降解部分[19],大多数干草中PB1含量较少,大约占Sol-CP的5%,而精料中PB1含量大约为干粗饲草的2倍[20-21]。PB2是不溶于缓冲液而溶于中性洗涤剂的蛋白质,属于中速降解部分,部分可以进入后部消化道而被动物消化利用,如谷物中的谷蛋白。PB3是指中性洗涤剂中不溶蛋白质(insoluble protein in ND,NDIP),但可以在酸性洗涤剂溶解,因其与细胞壁结合而在瘤胃中降解缓慢,大部分经过瘤胃而进入后部消化道被吸收利用。牧草、发酵谷物与谷物副产品中含有大量的 PB3[21]。PC含有与木质素结合的蛋白质、单宁蛋白质复合物和其他高度抵抗微生物和哺乳动物酶类的成分,是在酸性洗涤剂中不被溶解的蛋白质(insoluble protein in AD,ADIP),在瘤胃中不能被瘤胃细菌降解,其全部流入后肠道但不能被消化。青贮牧草、干燥苜蓿、柑橘渣、玉米酒糟和啤酒糟中含有相当多的PC[22]。综上所述,瘤胃内降解的蛋白质包括全部的PA,大部分PB1、PB2和少量的PB3;过瘤胃蛋白质包括全部的PC以及少量的PB1、PB2和大量的PB3。
2.2 碳水化合物和蛋白质组分的计算
根据CNCPS模型中的计算方法,参照Sniffen等[6]、Tylutki等[8]、Lanzas等[18]的报道,将碳水化合物和蛋白质组分计算公式汇总至表1。
其中,CHO为总碳水化合物,按照 NRC(2001)[4]所 提 供 的 方 法 计 算;按 照 AOAC(1990)[23]的 方 法 测 定 干 物 质 (DM;AOAC 930.15)、粗灰分(ash,AOAC 942.05)、粗脂肪(EE;AOAC 954.02)、粗 蛋 白 质 (CP;AOAC 984.13)、木质素(AOAC 973.18)和糖类(AOAC 968.28)含量;真蛋白质和非蛋白氮含量利用三氯乙酸方法测定[24];NDIP和ADIP含量参照Licitra等[24]的方法,采用凯氏定氮仪分别测定不溶于中性洗涤剂和酸性洗涤剂的残渣中粗蛋白质含量;SolCP含量参照Roe等[25]的方法测定;NDF含量采用Van Soest等[2]的方法测定;挥发性脂肪酸和乳酸含量参照Fussell等[26]气相色谱分析方法测定;淀粉含量采用试剂盒(Megazyme Total Starch Assay Kit,爱尔兰)测定。
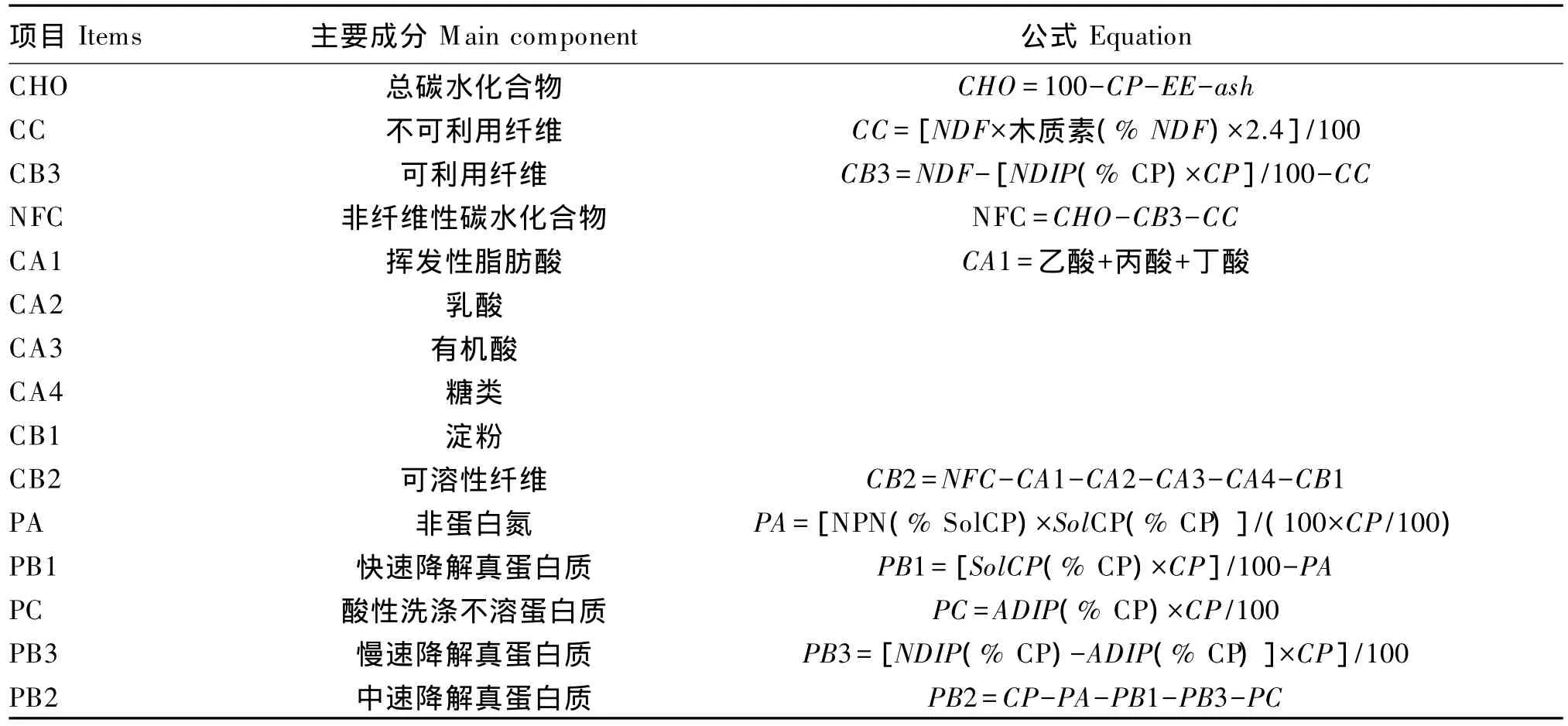
表1 CNCPS碳水化合物和蛋白质组分计算公式(干物质基础)Table 1 Equations for carbohydrate and protein fractions in CNCPS(DM basis) %
2.3 CNCPS6.1评价常用饲料碳水化合物和蛋白质结构特征
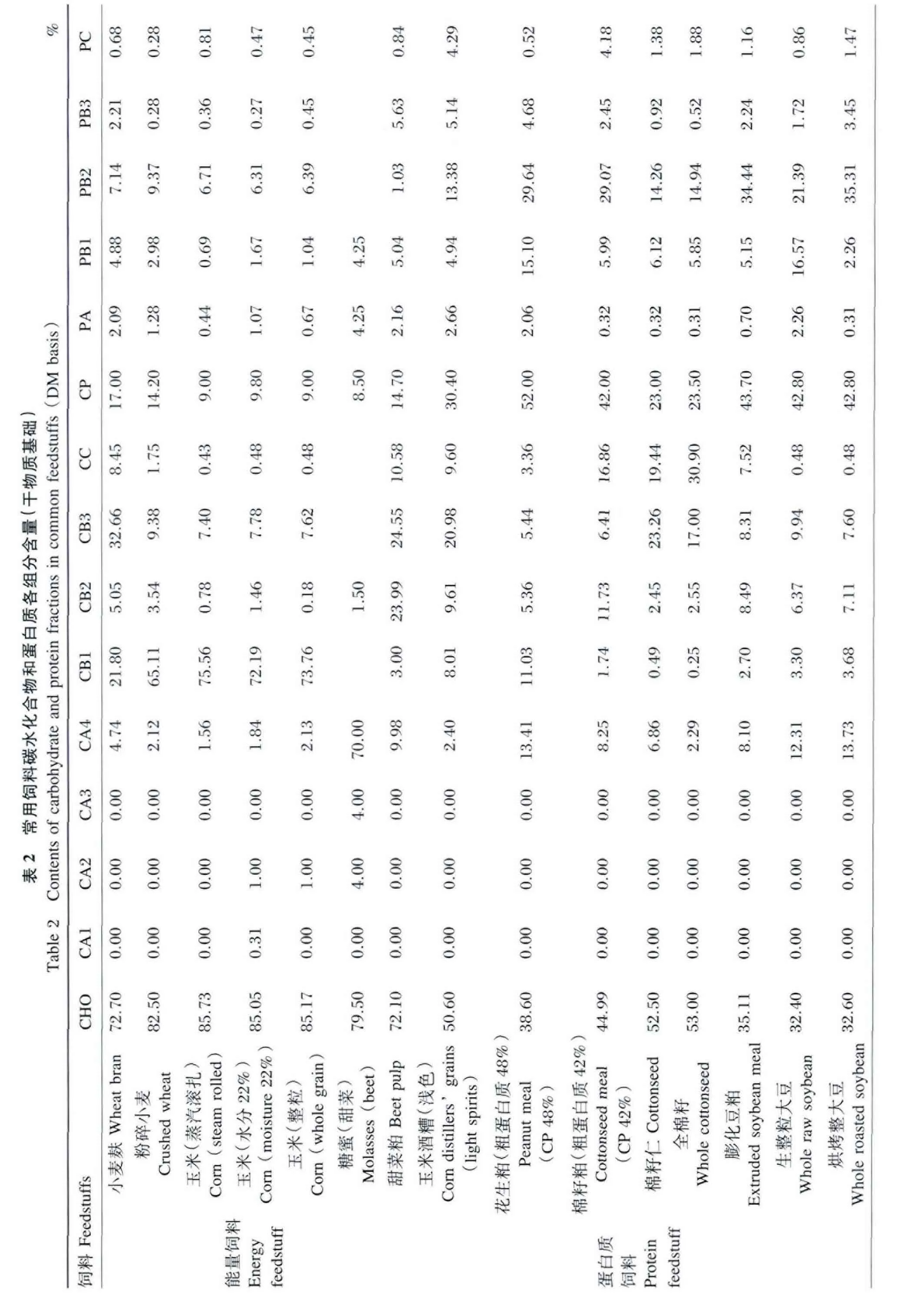
根据CNCPS6.1数据库中饲料常规营养成分含量及表1计算公式,计算得到奶牛饲料中常用饲料碳水化合物和蛋白质各组分含量(表2)。可以看出,不同饲料的碳水化合物和蛋白质组分及结构存在差异:碳水化合物和蛋白质是干物质的主要组成成分,两者之和约占干物质的80.00%~97.00%(例 如 玉 米 酒 糟 81.00%,粉 碎 小 麦96.70%)。其中,谷实类饲料及粗料的碳水化合物含量丰富,占干物质的60.00%~85.00%。
玉米、小麦等谷物类能量饲料的碳水化合物主要是以淀粉(CB1)为主,而糖蜜及甜菜粕中碳水化合物主要存在形式是糖类(CA4),小麦麸因其含有较高的植物细胞壁而以CB3为主,由于糖类及淀粉进入瘤胃后迅速被瘤胃细菌降解利用,而CB3降解缓慢,致使不同类型饲料在瘤胃内Kd不同。然而,玉米经青贮后,其 CB1含量为34.78%,显 著 低 于 高 水 分 (22.0%)玉 米(72.19%),原因是淀粉在青贮过程中降解。谷物类能量饲料蛋白质部分以PB2为主。
蛋白质饲料中玉米酒糟的碳水化合物以CB3为主;而棉籽粕及全棉籽因其外壳木质素含量较高,以难消化降解的CB3和CC为主,其中全棉籽中CC含量高达30.90%;大豆及大豆粕中的CA4、CB1、CB2高于棉籽粕,而CB3和CC相对低于棉籽粕,说明大豆粕及大豆类饲料在瘤胃内更易降解。蛋白质饲料的蛋白质以PB1和PB2为主,且蛋白质各部分含量受加工方式的影响,如整粒生大豆中 PA、PB1和 PB2的含量分别为2.26%、16.57%和21.39%,经烘烤加工后各部分含量发生改变,分别为 0.31%、2.26%和35.31%,其易降解部分降低,难以降解部分提高,因而可提高大豆在瘤胃内的稳定性,导致过瘤胃蛋白质的增加。
?
?
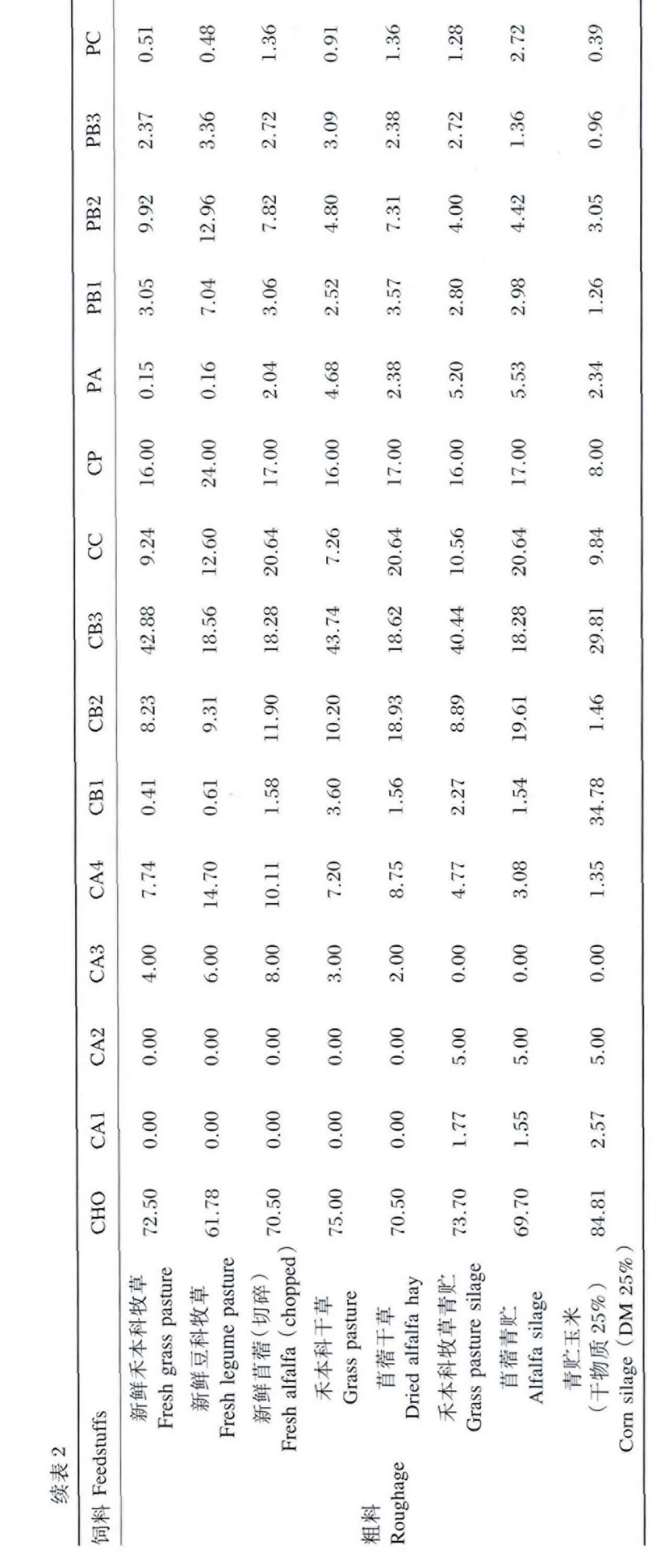
粗料因饲料种类不同而存在差异。新鲜禾本科牧草中CB3丰富,含量达42.88%。新鲜苜蓿以及新鲜豆科牧草 CB3含量分别为 18.28%和18.56%,而不能被消化利用的CC含量分别高达20.64%和12.60%。CA3主要存在于新鲜牧草中,且干燥后CA3含量降低,可能原因是CA3发生了分解。饲草经青贮加工后,碳水化合物组成发生变化,糖类、淀粉发生分解产生乳酸进而产生挥发性脂肪酸。一般青贮饲料中CA1含量为1.50%~2.50%,同时乳酸是其主要的有机酸成分,含量高达5%~15%[27]。而青贮饲草中的CA3含量降解至0,粗料经青贮处理后各组分比例发生改变。
综上所述,饲料碳水化合物和蛋白质各组分含量受饲料种类、加工方式以及贮存类型的影响,因此有必要针对不同状态下的饲料进行分析,以便更好地了解饲料的营养状况。
3 碳水化合物和蛋白质组分在瘤胃及肠道内降解规律
3.1 在瘤胃内的降解规律
与单胃动物消化不同,饲料中的一部分碳水化合物和蛋白质会在瘤胃中被微生物降解,为微生物提供能量及合成微生物蛋白,进而流入小肠被消化吸收利用。由于不同碳水化合物及蛋白质组分的结构不同,其在瘤胃内Kd存在差异。各组分被降解的数量由各自的Kd和流通速率(Kp)共同决定。因此,研究碳水化合物和蛋白质各组分在瘤胃及肠道内的降解规律,对于准确预测饲料有效营养成分具有重要意义。
随着新研究成果的发现,CNCPS不断发展与完善,所得到的碳水化合物和蛋白质组分Kd发生了变化(表3)。CNCPS6.1增加了碳水化合物CA1、CA2、CA3组分及其Kd;CA4和蛋白质各组分的 Kd发生改变,如前期版本 CA4的 Kd为300%/h~500%/h,是基于单一糖类、单一瘤胃细菌体外发酵的研究结果[5],与瘤胃真实代谢状况不符,Molina等[16]采用混合糖类培养多种瘤胃细菌,得出 CA4的 Kd为 40%/h~60%/h;PA的 Kd由 10 000%/h降 至 200%/h,原 因 是 Kd为10 000%/h意味着在36 s内非蛋白氮被瘤胃微生物摄取利用是不切实际的,该值应为非蛋白氮在瘤胃内的溶解速率[28]。此外,各组分的 Kd在一定范围内变化,原因是不同饲料的化学成分不同。如 CA4 的 Kd在 10.0%/h~40.0%/h 变化,原因是其糖类组成存在差异,葡萄糖和蔗糖的Kd为40.0%/h,因此以葡萄糖和蔗糖为主的饲料中CA4的 Kd 设为 40.0%/h[16]。而乳清粉等乳制品副产品中糖类主要是乳糖,因乳糖促进微生物生长的效率较葡萄糖低[29],其 Kd 为 30.0%/h,得到乳清粉CA4的Kd为30.0%/h。青贮饲料糖类一般是阿拉伯糖以及果胶和半纤维素降解产物,微生物利用效率更低,Kd为 20.0%/h。
从 Sniffen 等[6]、Fox 等[11]到 CNCPS6.1,Kd计算公式发生变化(表4)。Sniffen等[6]根据饲料颗粒大小的不同采用校正因子(adjust factor,Af)公式校正粗料Kp(Kp of forages,Kpf)和精料 Kp(Kp of concentrate,Kpc),但缺少液体原料Kp(Kp of liquid,Kpl)的计算公式。而Kpl可能影响可溶性营养物质的消化[30]、发酵产物的外流[31]、过瘤胃蛋白质含量[11]以及微生物的生长[32]。因此,Fox 等[11]发表的 CNCPS5.0 增加了 Kpl的计算公式,校正因子采用物理有效NDF(physical effective neutral detergent fiber,peNDF)进 行 计 算。CNCPS6.1 采用 Seo 等[33]关于 Kpf、Kpc 和 Kpl的计算公式,并摒弃了 CNCPS5.0中peNDF这一校正因子,原因是采用校正因子可能会过高估计小颗粒饲料的过瘤胃量,同时与前期版本按照固体Kd估测可溶性组分CA、PA和PB1流通量不同,CNCPS6.1按照液体Kd公式计算,这与奶牛瘤胃发酵特性更加相符[30]。另外,CNCPS与 NRC(2001)体系中Kd的计算公式存在差异。
基于CNCPS各组分Kd和饲料Kd的研究,饲料各组分在瘤胃内降解量可用公式计算[8],如CA1瘤胃降解量(ruminally degraded CA1,RDCA1)和过瘤胃量(ruminally escaped CA1,RECA1)分别为:
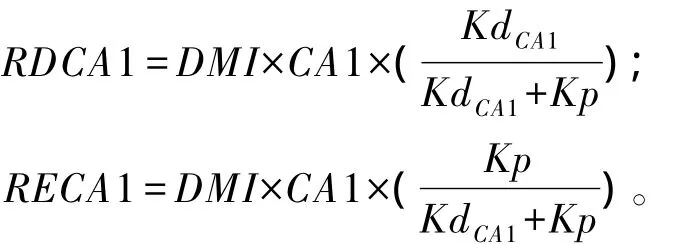
式中:DMI为某一饲料的干物质采食量;Kd可查找CNCPS6.1数据库获得;Kp可根据表4中的公式计算。其他组分的计算公式同样。根据上述碳水化合物和蛋白质组分瘤胃降解量和过瘤胃量的计算公式,可得饲料中碳水化合物瘤胃降解量(RDCHO)和过瘤胃量(RECHO)以及蛋白质瘤胃降解量(RDP)和过瘤胃量(REP)的计算公式 如下:
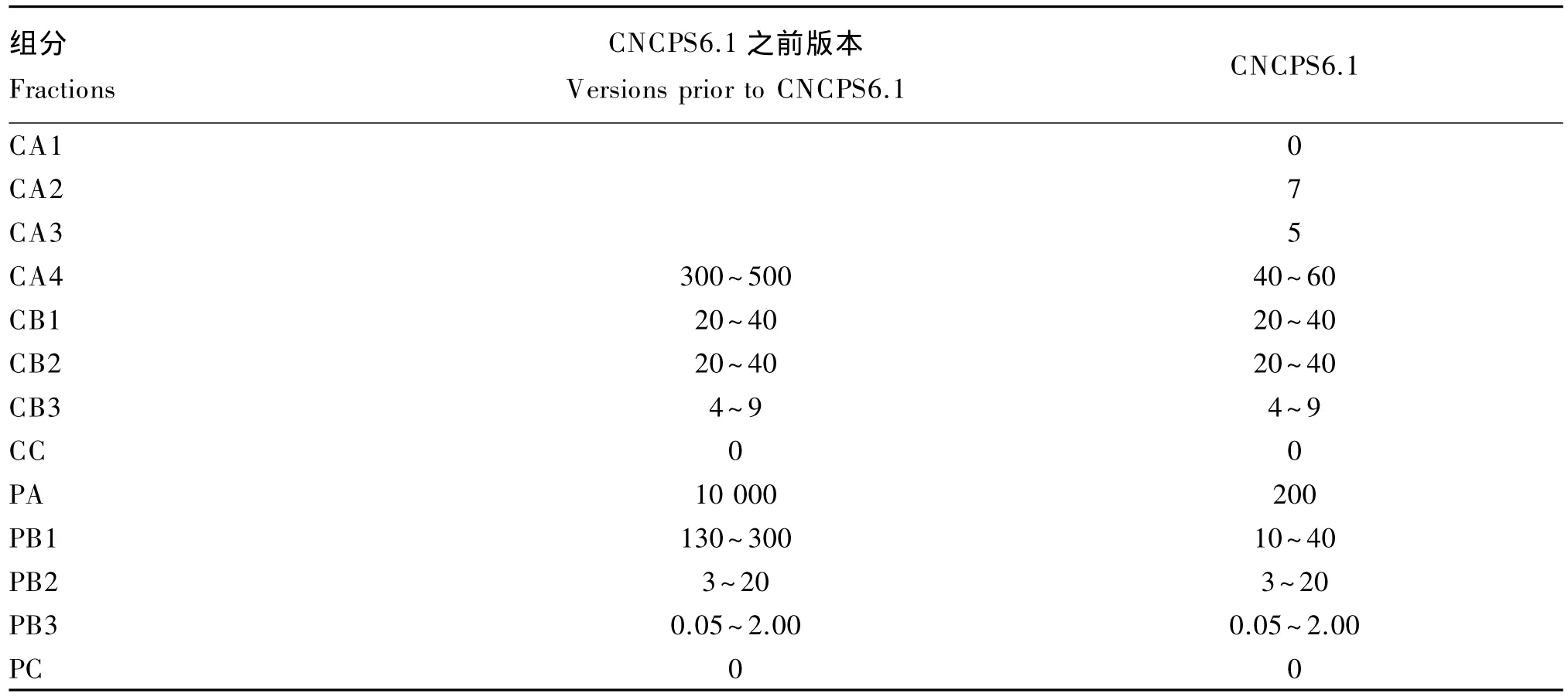
表3 CNCPS6.1及之前版本关于碳水化合物和蛋白质组分降解速率的对比Table 3 The comparison of degradation rates of carbohydrate and protein fractions between CNCPS6.1 and versions prior to it[10]%/h

表4 CNCPS不同版本中Kp计算公式的变化及与NRC(2001)体系的对比Table 4 Changes of Kp equation in different CNCPS versions and the comparison with NRC(2001)system
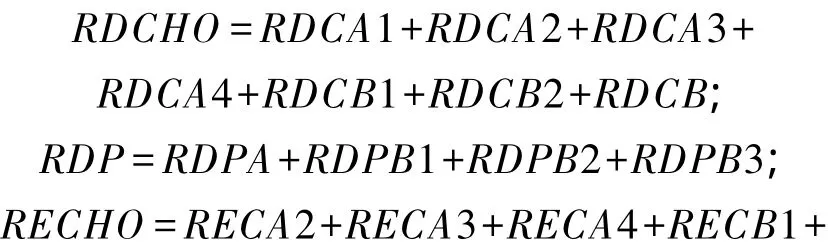

3.2 在肠道内的降解规律
碳水化合物中部分乳酸和有机酸能通过瘤胃进入小肠。CA1、CA2、CA3和CA4的小肠消化率均为100%,但不同饲料的CB1及CB2小肠消化率存在差异,在50%~97%的范围内变化。由于小肠内缺乏消化纤维素和半纤维素的酶,纤维素和半纤维的降解主要依靠纤维降解菌,因此CB3部分的小肠消化率仅为20%[6]。CC不被降解利用,小肠消化率为 0。蛋白质组分 PA、PB1、PB2和PB3的小肠消化率,前3部分均为100%,第4部分为 80%[11]。
3.3 消化代谢规律的其他研究
近年来,基于CNCPS碳水化合物和蛋白质组分划分研究饲料消化代谢规律的试验常有报道。例如,Zhao等[34]选用3只绵羊采用3×3拉丁方设计,研究了十二指肠可利用真蛋白质(utilizable true protein,uTP,g/d)与 CNCPS蛋白质各组分摄入量(g/d)之间的关系,发现它们之间存在如下强相关的线性关系:
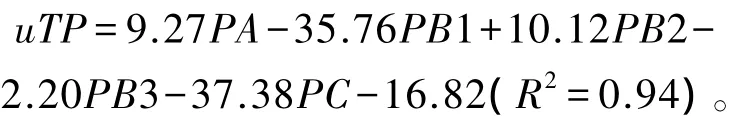
王燕等[35]建立了利用CNCPS预测奶牛饲料的小肠可利用粗蛋白质(utilizable true protein,uCP)含量的数学模型:1)所有饲料uCP含量与CNCPS各蛋白质组分含量的关系方程为uCP=-4.11+6.48PA+7.73PB1+5.72PB2+8.26PB3+5.11 PC(R2=0.997 0,P<0.01)。2)蛋白质饲料 uCP=12.79+5.47PA+7.04PB1+9.74PB2+8.14PB3(R2=0.998 7,P<0.01)。3)能量类饲料 uCP=14.80+8.55PA+6.27PB2+17.64PB3(R2=0.987 4,P <0.01)。
另外,马桢等[36]建立了肉牛饲粮中碳水化合物和蛋白质全消化道表观消化率与CNCPS各组分之间的回归模型。其中含氮化合物组分对饲粮DM 消化率(Y)的回归公式为:Y=52.91+0.89PA+3.36PB1+0.01PB2+1.57PB3+2.91PC(n=12,R2=0.95,P<0.01);饲粮碳水化合物组分对饲粮 DM消化率 Y'=15.90+0.08CA+2.12CB1+0.28CB2-0.53CC(n=12,R2=0.90,P<0.01)。
3.4 CNCPS6.1 后续的研究进展
按照CNCPS6.1体系,PA包括氨、肽和氨基酸,非蛋白氮在瘤胃内完全降解[18],则PA对小肠中小肽和游离氨基酸的含量无贡献。然而,Choi等[37]研究表明,流向小肠的氨基酸中10%来源于饲粮中的非蛋白氮,Velle等[38]以不同速率向瘤胃内灌注氨基酸发现20%的氨基酸未被降解并流向小肠。因此,Van Amburgh 等[39]和 Higgs等[40]将PA重新划分为PA1(氨)和PA2(可溶性非氨态粗蛋白质),蛋白质部分重新划分为 PA1、PA2、PB1(原 PB2)、PB2(原 PB3)和 PC,PA1和 PA2的计算公式分别如下:
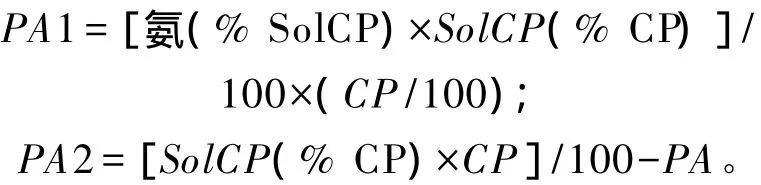
用新的蛋白质划分体系提高了代谢蛋白质的预测量,且与实际产奶量更加一致。PA1、PA2、PB1的 Kd分别为 200%/h、10%/h~40%/h和3%/h~20%/h。
按照表1可得到如下公式:
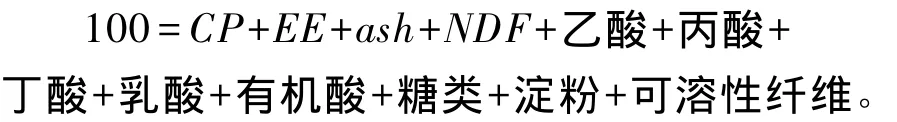
其中可溶性纤维是根据公式计算而得,但粗蛋白质等指标测定的累积误差可能导致可溶性纤维含量的计算值过高或过低,致使上述公式中营养成分干物质之和高于或低于100%的现象[39]。因此,Higgs等[40]对 CNCPS6.1 中75%的饲料营养成分进行了更新,25%的饲料如矿物质、维生素及非常规饲料营养成分基本保持不变。
4 CNCPS与其他饲料营养价值评定体系之间的关系
目前,评价饲料营养成分的体系主要有Weende体系、Van Soest体系、CNCPS以及 NRC(2001)体系。各体系的区别与联系如下:Weende体系即概略养分分析方法,该体系将饲料成分划分为水分、粗蛋白质、粗纤维、粗脂肪、粗灰分、无氮浸出物6大概略成分,目前这种传统方法仍广泛的应用于饲料营养状况的初步评定。由于Weende体系未将粗纤维细分而难以预测微生物生长及其在瘤胃内的降解规律,且无氮浸出物的计算值偏高。因此Van Soest体系是在Weende体系的基础上对粗纤维和无氮浸出物2个指标加以修正,提出了洗涤纤维分析方法,根据其在中性洗涤剂和酸性洗涤剂中溶解度不同将粗纤维细分为纤维素、半纤维素和木质素[41]。Van Soest体系的分析方法是CNCPS中碳水化合物的各部分的细分和测定的基础。CNCPS是在继承Weende体系和Van Soest体系的基础上,考虑了饲料在瘤胃内的消化与Kd以及被吸收的碳水化合物和蛋白质的利用效率等因素,对饲料中的粗蛋白质和碳水化合物又进行了进一步的划分。该体系不仅分析饲料中与Weende体系及Van Soest体系相关的常规营养组分,而且包括真蛋白质、非蛋白氮、Sol-CP、糖类与淀粉等营养组分,并对其进行区分,这更能反映动物对饲料利用的状况。但是,也正是由于该体系对饲料组分划分的精细化程度高,对Kd与Kp的评价与计算复杂,势必影响其实际推广应用。NRC(2001)是在吸收了大量的有关CNCPS先进理论与技术的基础上提出的。既是对CNCPS 2001年以前研究成果的继承,又保留了自己的特色。如基于洗涤纤维系统分析方法,采用粗蛋白质、ADIP、NDIP、粗脂肪、NDF、酸性洗涤纤维(ADF)、木质素和粗灰分描述饲料的营养成分;未采用CNCPS蛋白质5部分的划分方法,将蛋白质简化地分为非蛋白氮和迅速可溶蛋白质(A),完全不消化蛋白质(C)和潜在可降解真蛋白质(B)3部分,并根据瘤胃内分解模式分为RDP和RUP,且运用了 CNCPS 模型估测 RDP 和 RUP[4]。
5 小 结
CNCPS能够基于反刍动物瘤胃生理状况和代谢特点,依据饲料在瘤胃内降解率的不同将碳水化合物和蛋白质进行划分,同时建立各组分瘤胃动态降解的模型,使得对饲料的营养价值评价更加精确,能更好地平衡甚至优化反刍动物饲粮。目前我国反刍动物生产精细化程度不高,饲料的营养价值评定仍然以概略养分分析为基础,采用的蛋白质体系仍以粗蛋白质体系为主。CNCPS指标体系之所以未能得以推广应用,与其对碳水化合物与蛋白质组分划分过细,测定及计算指标较多有关。因此,未来研究中,一方面应以CNCPS为基础,根据我国饲料资源的特点,以科研院所对饲料的精细化分析为依托,建立适应实际生产应用,方便查阅的饲料CNCPS指标数据库;另一方面,加强CNCPS与计算机和饲粮优化技术的融合,尽快开发基于CNCPS指标的反刍动物饲粮配方优化与诊断系统,实现集约化奶牛场的精准养殖。
[1] MORRISON F B.Feeds and feeding[M].22th ed.Clinton:Morrison Publishing Co.,1956.
[2] VAN SOEST P J,ROBERTSON J B,LEWIS B A.Methods for dietary fiber,neutral detergent fiber,and nonstarch polysaccharides in relation to animal nutrition[J].Journal of Dairy Science,1991,74(10):3583-3597.
[3] FOX D G,SNIFFEN C J,O'CONNOR J D,et al.A net carbohydrate and protein system for evaluating cattle diets.Ⅲ.Cattle requirements and diet adequacy[J].Journal of Animal Science,1992,70(1):3578-3596.
[4] NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington,D.C.:National Academy Press,2001.
[5] RUSSELL J B,O’CONNOR J D,FOX D G,et al.A net carbohydrate and protein system for evaluating cattle diets.Ⅰ.Ruminal fermentation[J].Journal of Animal Science,1992,70(11):3551-3561.
[6] SNIFFEN C J,O’CONNOR JD,VAN SOEST PJ,et al.A net carbohydrate and protein system for evaluating cattle diets.Ⅱ.Carbohydrate and protein availability[J].Journal of Animal Science,1992,70(11):3562-3577.
[7] O’CONNOR J D,SNIFFEN C J,FOX D G,et al.A net carbohydrate and protein system for evaluating cattle diets.Ⅳpredicting amino acid adequacy[J].Journal of Animal Science,1993,71(5):1298-1311.
[8] TYLUTKI T P,FOX D G,DURBAL V M,et al.Cornell Net Carbohydrate and Protein System:a model for precision feeding of dairy cattle[J].Animal Feed Science and Technology,2008,143(1/2/3/4):174-202.
[9] HIGGS R J.Nitrogen use efficiency and sustainable nitrogen management in high producing dairy farms[D].Ph.D.Thesis.Ithaca:Cornell University,2009.
[10] VAN AMBURGH M E,CHASE L E,OVERTON T R,et al.Updates to the Cornell Net Carbohydrate and Protein System v6.1 and implications for ration formulation[C]//Cornell Nutrition Conference.Syracuse:[s.n.],2010:144-159.
[11] FOX D G,TEDESCHI L O,TYLUTKI T P,et al.The Cornell Net Carbohydrate and Protein System model for evaluating herd nutrition and nutrient excretion[J].Animal Feed Science and Technology,2004,112(1/2/3/4):29-78.
[12] HALL M B.Challenges with nonfiber carbohydrate methods[J].Journal of Animal Science,2003,81(12):3226-3232.
[13] HALL M B,HEREJK C.Differences in yields of mi-crobial crude protein from in vitro fermentation of carbohydrates[J].Journal of Dairy Science,2001,84(11):2486-2493.
[14] NOCEK J E,TAMMINGA S.Site of digestion of starch in the gastrointestinal-tract of dairy cows and its effect on milk yield and composition[J].Journal of Dairy Science,1991,74(10):3598-3629.
[15] DOANE P H,PELL A N,SCHOFIELD P.The effect of preservation method on the neutral detergent soluble fraction of forages[J].Journal of Animal Science,1997,75(4):1140-1148.
[16] MOLINA D O.Prediction of intake of lactating cows in the tropics and the energy value of organic acids[D].Ph.D.Thesis.Ithaca:Cornell University,2002.
[17] FOX D G,TYLUTKIT P,TEDESCHI,L O,et al.The net carbohydrate and protein system for evaluating herd nutrition and nutrient excretion:model documentation[M].Ithaca:Cornell University,2003.
[18] LANZAS C,SNIFFEN C J,SEO S,et al.A revised CNCPS feed carbohydrate fractionation scheme for formulating rations for ruminants[J].Animal Feed Science and Technology,2007,136(3/4):167-190.
[19] VAN SOEST P J.Nutritional ecology of the ruminant[M].Cornallis:O & B Books,1982.
[20] PICHARD D G.Forage nutritive value.Continuous and batch in vitro fermentations and nitrogen solubility[D].Ph.D.Thesis.Ithaca:Cornell University,1977.
[21] KRISHNAMOORTHY U C,MUSCATO T V,SNIFFEN C J,et al.Nitrogen fractions in selected feedstuffs[J].Journal of Dairy Science,1982,65(2):217-225.
[22] WALDO D R,GOERING H K.Insolubility of proteins in ruminant feeds by four methods[J].Journal of Animal Science,1979,49(6):1560-1568.
[23] AOAC.Official methods of analysis[M].15th ed.Washington,D.C.:Association of Official Analytical Chemist,1990:69-88.
[24] LICITRA G,HERNANDEZ T M,VAN SOEST P J.Standardization of procedures for nitrogen fractionation of ruminant feeds[J].Animal Feed Science and Technology,1996,57(4):347-358.
[25] ROE M B,SNIFFEN C J,CHASE L E.Techniques for measuring protein fractions in feedstuffs[C].Ithaca:Proceedings of the Cornell Nutrition Conference,1990:81-88.
[26] FUSSELL R J,MCCALLEY D V.Determination of volatile fatty acid(C2-C5)and lactic acid in silage by gas chromatography[J].Analyst,1987,112(9):1213-1216.
[27] MCDONALD P,HENDERSON A R,HERON S J E.The biochemistry of silage[M].2th ed.Aberystwyth:Cambrian Printers Ltd.,1991.
[28] VAN AMBURGH M E,ROSS D A,HIGGS R J,et al.Balancing for rumen degradable protein and post-ruminal requirements for lactating cattle using the CNCPS as a basis for evaluation[C]//23rd Annual Florida Ruminant Nutrition Symposium.California:CANC,,2012:17-30.
[29] MCCORMICK M E,REDFEARN D D,WARD J D,et al.Effect of protein source and soluble carbohydrate addition on rumen fermentation and lactation performance of holstein cows[J].Journal of Dairy Science,2001,84(7):1686-1697.
[30] ILLIUS A W,GORDON I J.Prediction of intake and digestion in ruminants by a model of rumen kinetics integrating animal size and plant characteristics[J].Journal of Agricultural Science and Technology,1991,116(1):145-157.
[31] LOPEZ S,HOVELL F D D,DIJKSTRA J,et al.Effects of volatile fatty acid supply on their absorption and on water kinetics in the rumen of sheep sustained by intragastric infusion[J].Journal of Animal Science,2003,81(10):2609-2616.
[32] EUN J S,FELLNER V,GUMPERTZ M L.Methane production by mixed ruminal cultures incubated in dual-flow fermentors[J].Journal of Dairy Science,2004,87(1):112-121.
[33] SEO S,TEDESCHI L O,SCHWAB C G,et al.Development and evaluation of empirical equations to predict feed passage rate in cattle[J].Animal Feed Science and Technology,2006,128(1/2):67-83.
[34] ZHAO G Y,XUE Y,LI Y X,et al.The estimation of duodenal utilizable true protein in sheep fed mixed rations using the nitrogenous fractions of the Cornell Net Carbohydrate and Protein System[J].Small Ruminant Research,2008,76(3):190-194.
[35] 王燕,杨方,陈常栋,等.康奈尔净碳水化合物-蛋白质体系预测小肠可消化粗蛋白含量[J].动物营养学报,2012,24(7):1274-1282.
[36] 马桢,汪春泉,莫放,等.利用净碳水化合物-蛋白质体系组分估测肉牛日粮营养物质全消化道表观消化率研究[J].动物营养学报,2010,22(4):929-933.
[37] CHOI C W,AHVENJARVI S,VANHATALAO A,et al.Quantitation of the flow of soluble non - ammonia nitrogen entering the omasal canal of dairy cows fed grass silage based diets[J].Animal Feed Science and Technology,2002,96(3/4):203-220.
[38] VELLE W,SJAASTAD Ø V,AULIE A,et al.Rumen escape and apparent degradation of amino acids after individual intraluminal administration to cows[J].Journal of Dairy Science,1997,80(12):3325-3332.
[39] VAN AMBURGH M E,FOSKOLOS A,COLLAOSAENZ E A,et al.Updating the CNCPS feed library with new feed amino acid profiles and efficiencies of use:evaluation of model predictions-version 6.5.[C]//Cornell nutrition conference.Syracuse:[s.n.],2013:59-76.
[40] HIGGS R,CHASE L,ROSS D,et al.Evaluating and reefing the CNCPS feed library using commercial laboratory feed databases[C]//Syracuse:74th Cornell nutrition conference for feed manufactures.Syracuse:[s.n.],2012:146-156.
[41] VAN SOEST P J.Development of a comprehensive system of feed analyses and its application to forages[J].Journal of Dairy Science,1967,26(1):119-128.

