饲粮中添加酵母细胞壁对母猪繁殖性能、乳成分和免疫指标的影响
骆光波 苏国旗 胡 亮 罗 毅 玄 玥 方正锋林 燕 徐盛玉 车炼强 吴 德
酵母细胞壁(yeast cell wall,YCW)是将啤酒酵母提取内容物后,经过音波震碎,多次清洗过滤,并在高温和酸、碱处理后离心分离提取,且在特定的温度和压强下进行喷雾干燥而得。YCW占整个细胞干重的20%~30%,其主要成分有:β-葡聚糖、甘露寡糖、糖蛋白和几丁质等[1]。近年来在畜禽上的研究表明,YCW及其成分不仅能促进动物胃肠道中有益微生物的增殖和吸附病原菌,而且能通过提高动物机体先天性或获得性免疫及增强疫苗效价等途径来改善动物的生长性能[1-3]。Che等[4]研究发现,猪繁殖和呼吸综合征病毒(PRRSV)感染的断奶仔猪饲粮中添加甘露寡糖能显著降低仔猪血清中促炎性因子肿瘤坏死因子-α(TNF-α)含量,且增加抗炎性因子白细胞介素-10(IL-10)含量和血清中淋巴细胞数量,从而保障猪只健康和生产性能;研究还表明,YCW能通过缓解断奶仔猪细菌感染,调节先天性免疫力以促进仔猪断奶后生长[5];家禽上的研究也发现,饲粮中添加YCW能有效促进肉鸡早期肠黏膜生长,提高肉鸡体增重和饲料报酬[6],且能改善肉鸡免疫器官发育[7],并降低肉鸡大肠杆菌和沙门氏菌数量,缓解球虫感染后的炎症反应[8]。母猪上的研究表明,从妊娠后期至哺乳期饲喂母猪YCW的成分改善了乳中免疫球蛋白含量和免疫细胞数量,甚至降低了木乃伊胎数[9-10];Czech 等[11]研究发现,妊娠后期和哺乳期饲粮中添加甘露寡糖可提高母猪抗氧化能力。尽管如此,YCW及其成分对母猪繁殖性能影响的报道仍然较少,且在整个繁殖周期(妊娠期和哺乳期)添加YCW对母猪繁殖性能、乳成分和免疫指标尤其是胎盘免疫的影响,还未见报道。因此,本试验通过在母猪妊娠期和哺乳期饲粮中添加YCW,考察YCW对母猪繁殖性能、乳成分和免疫指标的影响。
1 材料与方法
1.1 试验材料
本试验所用YCW是采用新鲜啤酒酵母泥脱水分离、定向酶解、喷雾干燥等工艺生产而成。YCW成分及含量:甘露寡糖 24%、β-葡聚糖39%、粗蛋白质30%、水分6%和粗灰分1%(检测机构:中国科学院广州化学研究所测试分析中心)。
1.2 试验动物与设计
本试验采用单因素试验设计,将80头妊娠1 d的PIC母猪根据胎次、体况相近原则随机分为2组,每组40个重复,每个重复1头母猪,单栏饲养。对照组母猪饲喂基础饲粮,YCW组母猪饲喂在基础饲粮中添加0.2%YCW的试验饲粮。妊娠期饲粮从母猪配种后第1天开始饲喂,直至妊娠第90天,然后换喂哺乳期饲粮至哺乳期第21天试验结束。饲粮是参考NRC(1998)标准和《中国饲料成分及营养价值表》(第20版)配制成粉状全价料的玉米-豆粕型饲粮。母猪妊娠期和哺乳期的基础饲粮组成及营养水平见表1。为了避免商业预混料中功能性寡糖及其类似物对试验的干扰,预混料由四川农业大学动物营养研究所定制。为保证饲粮的新鲜性,所有饲粮每批次在2周内全部饲喂完。
1.3 饲养管理
母猪饲养试验在四川省遂宁市高金丹育生态牧业猪场进行。试验开始时,将在空怀舍配种后的母猪转入妊娠舍的半漏缝地板限位栏中,舍内保持清洁干燥,通风良好,舍内温度保持恒定(25℃左右)。每天饲喂2次,分别在08:00和17:30投料,妊娠前期(妊娠1~30 d)饲喂量为2.0 kg/d,妊娠中期(妊娠 31~ 90 d)饲喂量为2.5 kg/d,妊娠后期(妊娠91 d至分娩)饲喂量为3.0 kg/d,母猪自由饮水;预产期前1周将试验母猪转入彻底消毒的产仔舍,饲养于全漏缝地板限位栏中,舍内保持清洁干燥,通风良好,舍内温度保持恒定(25℃左右),母猪自由饮水。临产前用0.1%的高锰酸钾水溶液将其外阴和乳房清洗消毒,并将每个乳头疏通。分娩当天不喂料,分娩后第 1 天喂 2.0 kg,以后每天增加 0.5 kg,直到第 7天后让母猪自由采食。自由采食阶段每天4次饲喂并保持食槽内饲粮略有剩余。哺乳仔猪采用红外保温灯保暖,第3天开始教槽,每天清洗母猪和仔猪食槽。母猪分娩后仔猪在组内交叉寄养,保证每窝仔猪数基本一致(10或11头),其他饲养管理遵循猪场管理制度;每天记录温度、湿度,观察并记录母猪健康状况。
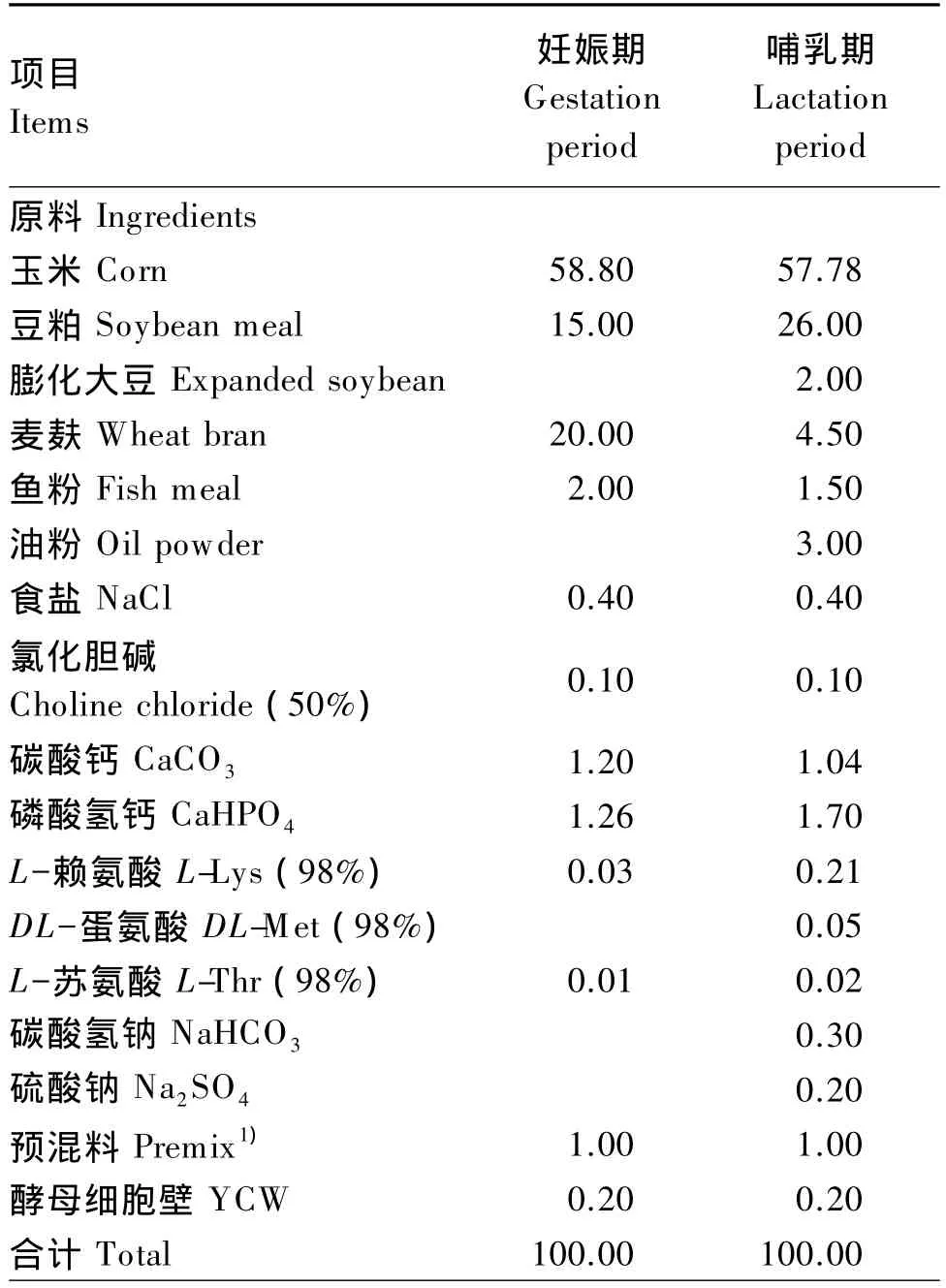
表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of basal diets(air-dry basis) %
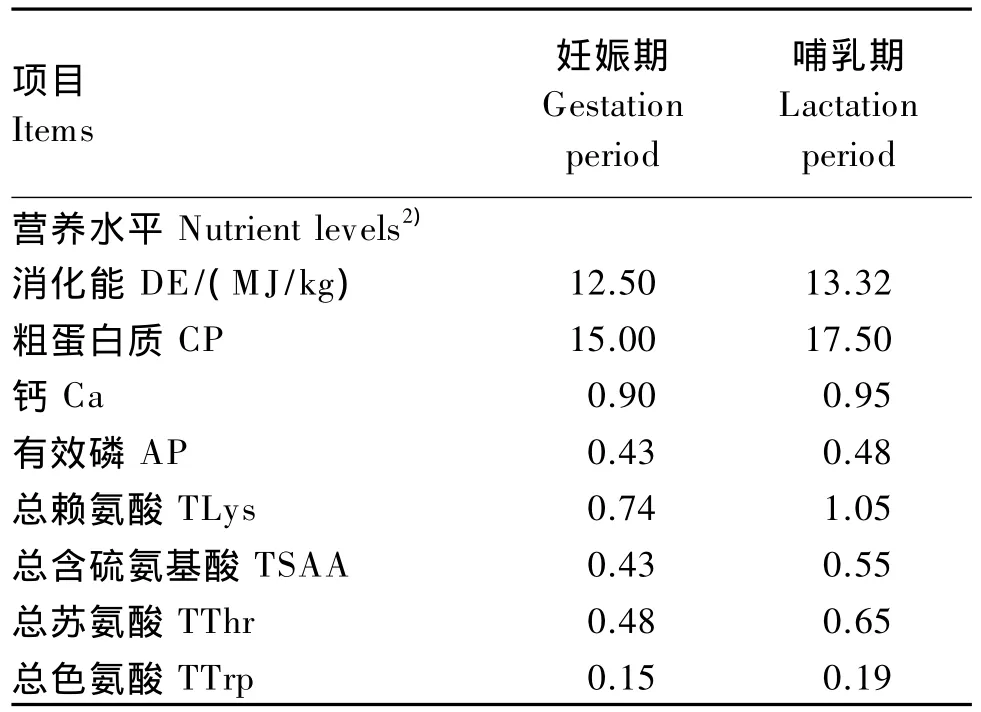
续表1
1.4 样品采集与制备
1.4.1 血清
分别于母猪妊娠第1和90天及分娩当天24 h内、哺乳第10和21天08:00空腹采血。每头母猪耳缘静脉采血10 mL于一次性真空采血管中,静置 10~15 min,离心 15 min(3 000 r/min),取血清分装于1.5 mL离心管中,于-20℃冷冻保存待测。
1.4.2 乳样
分别于母猪分娩当天24 h内、哺乳第10和21天08:00从空腹母猪前、中、后乳头均等收集乳样30 mL左右,装于带盖离心管内,采集常乳时每头母猪耳缘静脉注射1~2个单位催乳素,样品迅速在-20℃冰箱保存待测。
1.5 测定指标与方法
1.5.1 母猪繁殖性能测定
在母猪分娩12 h之内,记录每头母猪的总产仔数、活产仔数、死胎数、木乃伊胎数、仔猪初生个体重、活产仔猪窝重以及宫内生长迟缓仔猪发生率等;宫内生长迟缓仔猪发生率定义为出生体重低于900 g的仔猪数与该组所有活产仔猪数的比值。哺乳第21天时记录每窝仔猪数和个体重。
1.5.2 母猪常乳成分测定
母猪哺乳第10和21天常乳中的乳蛋白、乳脂、乳糖、粗灰分以及非脂固形物的含量用MILK YWAY-CP2快速乳成分自动分析仪检测。
1.5.3 母猪分娩时血清和初乳中的免疫球蛋白含量测定
母猪分娩时血清及初乳中免疫球蛋白A(IgA)、免疫球蛋白 G(IgG)、免疫球蛋白 M(IgM)含量采用酶联免疫吸附测定法,通过BIORAD Model 680酶标仪进行测定,试剂盒购自南京建成生物工程研究所。
1.5.4 母猪胎儿胎盘组织先天性免疫基因表达测定
母猪胎儿胎盘组织样品的总RNA的提取操作流程根据Trizol试剂(美国Invitrogen)的使用说明书进行。样品总RNA的质量和纯度检测方法分别用1%的琼脂糖凝胶电泳和Beckman DU-800核酸自动分析仪检测。目的基因和内参基因采用SYBR一步法反应试剂盒(DRR086A,日本TaKa-Ra)在ABI 7900HT实时荧光定量PCR检测仪上进行测定。目的基因和内参基因引物序列见表2。反应体系为10μL:一步法反应试剂混合液(含酶)5.6μL,上下游引物各 0.4 μL 以及含100 ng DNA模板的水溶液4μL。反转录反应参数:42℃预变性5 min,95℃变性10 s,95℃变性5 s,60℃退火34 s。反应共40个循环:包括95℃变性15 s,60℃退火60 s,95℃反应15 s。扩增结束后进行熔解曲线特异性扩增分析。采用-△△Ct(2-△△Ct)法[12],以内参基因 β-肌动蛋白的扩增效率来校正目的基因的表达。
1.6 数据处理及统计分析
试验数据用Excel 2007进行初步整理,并采用SPSS 17.0统计软件对母猪繁殖性能、常乳成分以及母猪胎儿胎盘基因表达量结果进行独立样本t检验分析;宫内生长迟缓仔猪发生率采用卡方检验(χ2)分析;以 P<0.05 表示差异显著,0.05<P<0.10为差异趋势性判断标准;结果采用平均值±标准误表示。
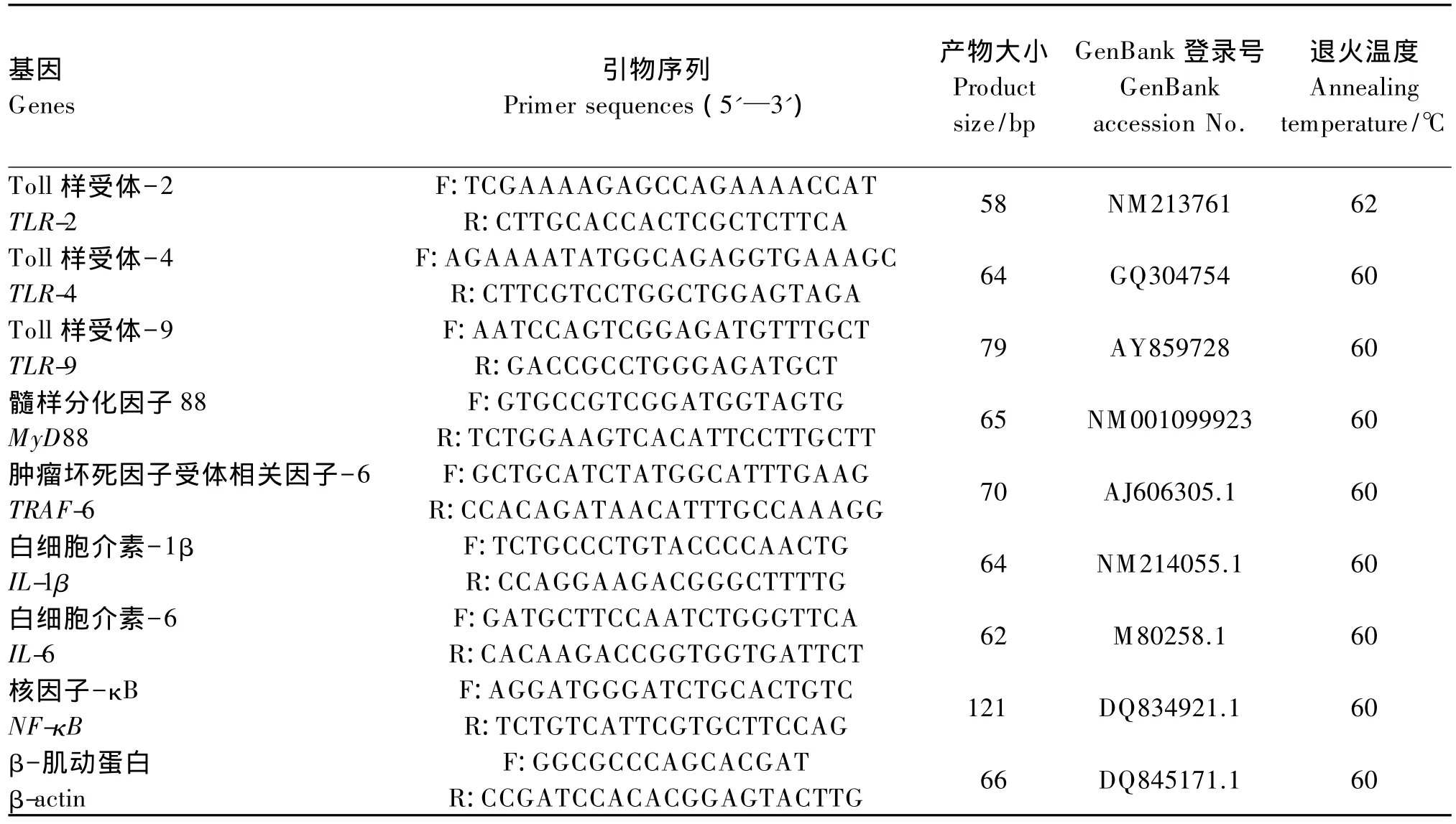
表2 目的基因和内参基因引物序列Table 2 The primer sequences of target and reference genes
2 结 果
2.1 饲粮中添加YCW对母猪繁殖性能的影响
由表3可知,饲喂含YCW饲粮的母猪分娩时死胎数(P=0.03)和宫内生长迟缓仔猪发生率(P=0.01)显著低于对照组,仔猪断奶窝重和窝增重提高(P=0.05);其他繁殖性能指标(总产仔数、活产仔数、活产仔猪窝重、仔猪初生重、断奶仔猪数)在2组间差异不显著(P>0.05);但是,饲喂含YCW饲粮的仔猪断奶体重和仔猪体增重均有改善的趋势(P<0.10)。
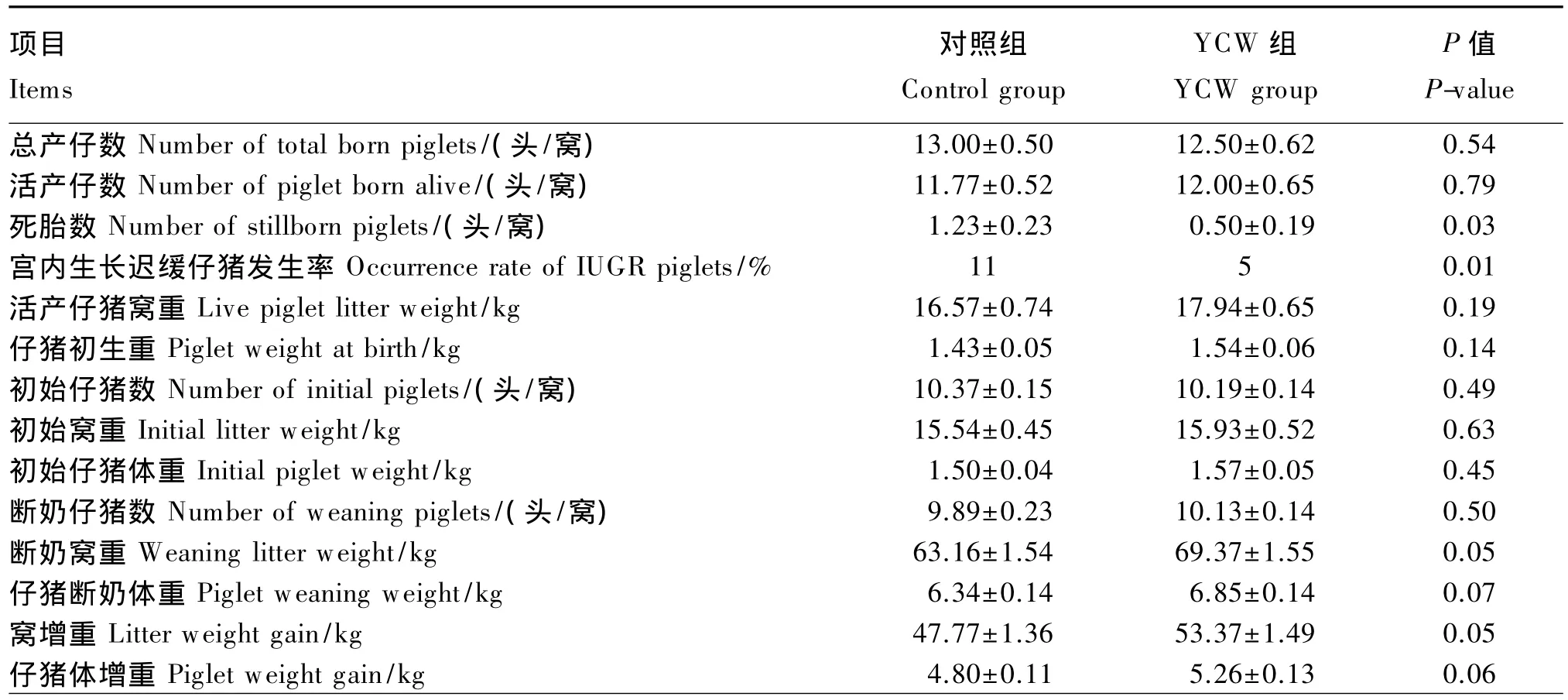
表3 饲粮中添加YCW对母猪繁殖性能的影响Table 3 Effects of dietary YCW on reproductive performance of sows
2.2 饲粮中添加YCW对母猪常乳成分的影响
由表4可知,相比对照组,YCW组母猪哺乳第10天乳中乳蛋白和非脂固形物含量均显著提高(P<0.05),乳糖含量提高了 13.06%(P=0.01);哺乳第21天乳中乳糖含量仍有提高的趋势(P=0.08)。
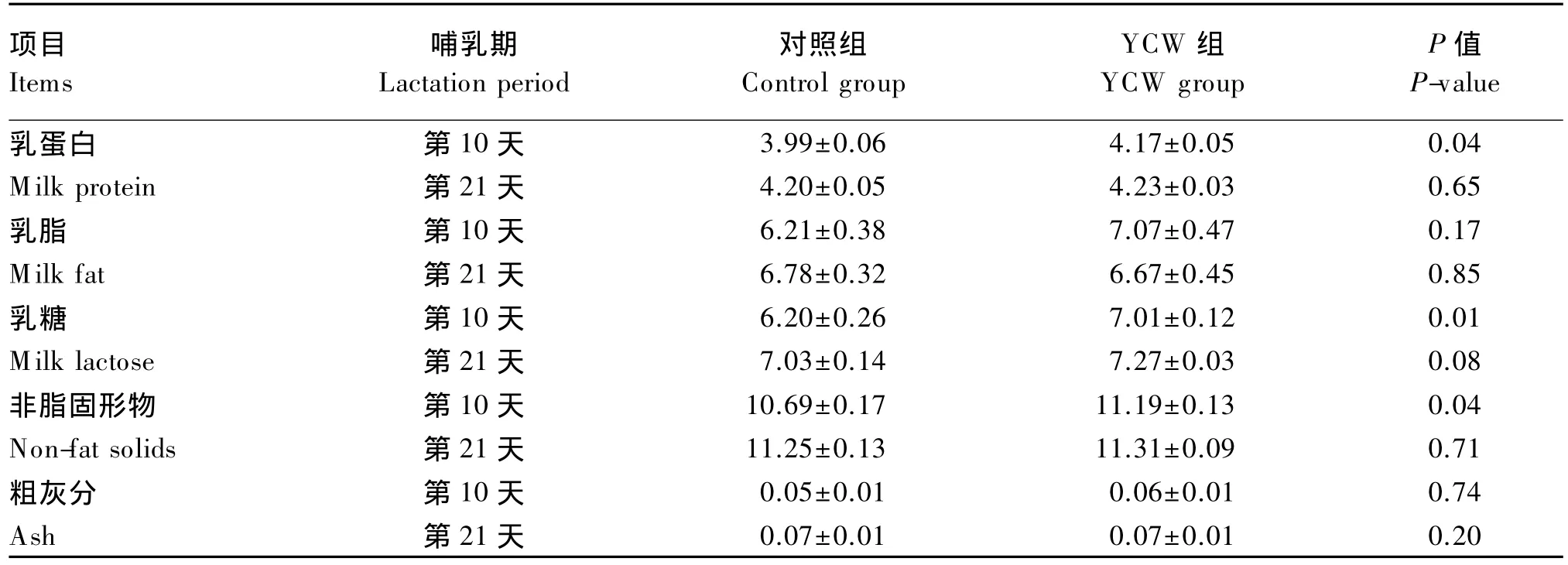
表4 饲粮中添加YCW对母猪常乳成分的影响Table 4 Effects of dietary YCW on milk composition of sows %
2.3 饲粮中添加 YCW 对母猪分娩时初乳和血清中免疫球蛋白含量的影响
由表5可知,YCW组母猪分娩时血清和初乳中IgA、IgG和IgM含量均与对照组差异不显著(P>0.05)。
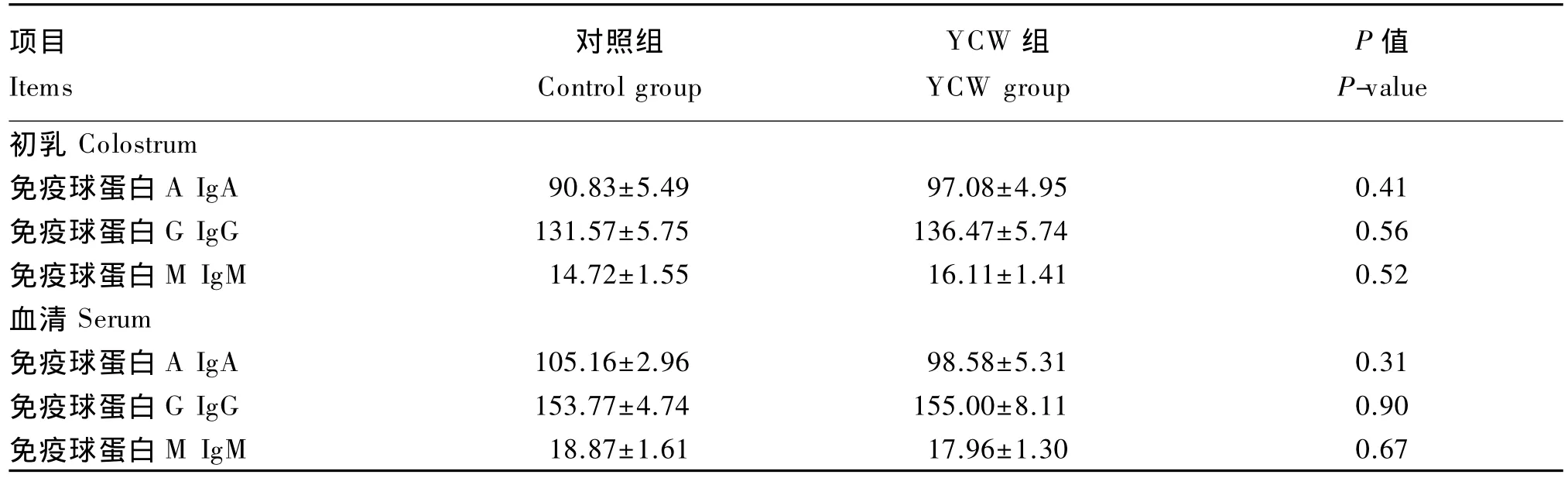
表5 饲粮中添加YCW对母猪分娩时初乳和血清中免疫球蛋白含量的影响Table 5 Effects of dietary YCW on immunoglobulin contents in colostrum and serum of sows ng/mL
2.4 饲粮中添加 YCW 对妊娠母猪胎儿胎盘先天性免疫相关基因表达的影响
由图1可知,饲喂含YCW饲粮的母猪胎儿胎盘中 Toll样受体-2(TLR-2)(P=0.05)和白细胞介素-1β(IL-1β)(P=0.05)基因表达量均低于对照组,且肿瘤坏死因子受体相关因子-6(TRAF-6)基因表达量有降低的趋势(P=0.10)。
3 讨论
随着选育和配种技术的提高,母猪的繁殖性能明显改善,但集约化饲养条件下的母猪健康问题已成为影响繁殖性能的重要因素。妊娠母猪产仔数提高的同时,死胎数、木乃伊胎数和宫内生长迟缓仔猪发生率也随之增加。引起死胎和仔猪发育受阻的原因有非传染性因素(如产程长、产仔数多、产仔较大、母猪胎次较高、体况较差等)[13-14]和传染性因素(如 PRRSV、弓形体感染等)[15],而这些原因或多或少均与母猪自身免疫力有关。本试验中饲喂含YCW饲粮的母猪死胎数和宫内生长迟缓仔猪发生率显著低于对照组,这可能与YCW通过改善肠道免疫屏障功能促进母体健康有关,而维持母猪的健康水平对于胎儿和初生仔猪的存活十分重要[16]。哺乳动物肠黏膜主要通过物理屏障和免疫屏障阻止或降低有害菌进入肠上皮细胞进而影响机体健康,且肠道结构的完整性也与机体健康密不可分。过去的研究表明,YCW可通过甘露寡糖特异结合含有甘露寡糖受体的1型菌毛的致病菌(如大肠杆菌和沙门氏菌等),避免或降低这类致病菌黏附肠道上皮细胞进入机体诱发疾病[1,10];YCW 也可通过维持或改善肠道结构的完整性,增强黏膜免疫能力和抗感染能力[6,17-20]。有意思的是,Ryan等[3]给断奶仔猪饲喂β-葡聚糖时发现β-葡聚糖改善了脂多糖刺激下的仔猪肝脏细胞因子(Toll样受体-4、白细胞介素-6和白细胞介素-10)基因表达模式,认为β-葡聚糖能通过影响肠道先天性免疫延伸至全身免疫系统;这些结果为本试验考察YCW影响母猪胎儿胎盘免疫提供了理论依据。
母猪胎儿胎盘既是胎儿生长发育必需的营养和废物交换的重要器官,也是抵抗外界有毒有害物质侵袭胎儿的免疫屏障[21-22]。本试验结果表明,饲粮中添加YCW影响了胎盘先天性免疫相关Toll样受体信号途径关键基因的表达,从而影响母猪胎儿胎盘先天性免疫反应。Toll样受体是固有免疫中一类重要的病原体模式识别受体,在先天性免疫反应中发挥重要作用,可识别一种或多种特定的微生物病原体或病毒。TRAF-6是TLR-2、4和9共享的胞内下游信号分子,Toll样受体受到外源病原菌或病毒刺激后,通过TRAF-6将胞外刺激信号传递给核因子-κB,并启动细胞核内炎症因子基因的转录表达[23-24]。本试验中,TLR-2 和TRAF-6基因的低表达,提示了YCW具有改善先天性免疫反应,抑制炎症发生的能力;同时,对母猪胎儿胎盘促炎症因子IL-1β基因的检测也表明,YCW组母猪胎儿胎盘IL-1β基因表达显著低于对照组,抑制炎症过度发生。因此,胎儿胎盘免疫力的改善有利于维持胎儿正常的生长发育,从而降低死胎和木乃伊胎的产生。尽管如此,本试验饲粮中添加YCW并没有影响母猪体液免疫,母猪血清IgA、IgG和IgM的含量在2组间没有显著差异。Zhao等[18]在仔猪上的研究也表明,饲粮中添加YCW成分并没有显著改善仔猪断奶后第1、14和28天血清IgG含量和淋巴细胞数量,这可能与YCW的组成、β-葡聚糖和甘露寡糖的分子质量、构象、聚合度、添加剂量、动物等因素有关。
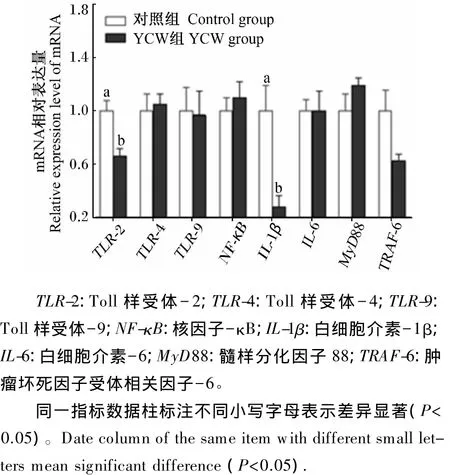
图1 饲粮中添加YCW对母猪胎儿胎盘先天性免疫相关基因表达的影响Fig.1 Effects of dietary YCW on fetal placental innate immunity-related gene expression of sows
本试验中,母猪妊娠期和哺乳期饲喂含YCW饲粮还显著提高了仔猪断奶窝重和窝增重。哺乳开始时各组之间仔猪数及仔猪体重均一致,在断奶仔猪数一致的前提下,仔猪断奶窝重的增加与体增重的提高密切相关。然而,进一步研究发现,YCW组较高的仔猪断奶窝重和体增重可能与母猪乳成分的改善有关。Bradley[25]在妊娠母猪和哺乳母猪饲粮中添加YCW成分甘露寡糖时就发现,甘露寡糖能改变母猪初乳和常乳中白细胞比例,也能改善母猪后代仔猪的免疫系统,提高仔猪断奶后第1周的生长性能,提示了YCW在提高断奶仔猪成活率和体增重方面的应用效果。事实上,本试验结果还发现,饲喂含YCW饲粮的母猪常乳中乳蛋白、乳糖和非脂固形物含量显著高于对照组,说明YCW组的仔猪能摄入较高质量的母乳,从而有利于仔猪生长潜力的发挥。尽管如此,饲粮中添加YCW改善母猪乳成分的具体机制还不清楚,我们认为可能与乳腺健康的改善有关。Newman[26]研究发现,YCW 来源的甘露寡糖能增加肠绒毛膜表面杯状细胞的扩散,并通过刺激肝脏分泌甘露糖结合蛋白来影响免疫系统,这种蛋白能结合细菌和引起宿主免疫系统的补体产生,以增强机体的免疫应答能力,降低致病菌等感染母猪乳房的几率,维持乳腺健康。
4 结论
母猪妊娠期和哺乳期饲粮中添加YCW能显著降低母猪死胎数和宫内生长迟缓仔猪发生率,这可能与YCW改善母猪胎儿胎盘先天性免疫力有关;同时,妊娠期和哺乳期饲粮中添加YCW还能通过改善母猪乳成分,提高哺乳期仔猪生长性能,但具体作用机理仍有待研究。
致谢:感谢唐山拓普生物科技有限公司为本试验提供YCW样品。
[1] KOGAN G,KOCHER A.Role of yeast cell wall polysaccharides in pig nutrition and health protection[J].Livestock Science,2007,109(1):161-165.
[2] LI J,LI D F,XING J J,et al.Effects of β-glucan extracted from Saccharomyces cerevisiae on growth performance,and immunological and somatotropic responses of pigs challenged with Escherichia coli lipopolysaccharide[J].Journal of Animal Science,2006,84(9):2374-2381.
[3] RYAN M T,COLLINS C B,O’DOHERTY J V,et al.Effects of dietary beta-glucans supplementation on cytokine expression in porcine liver[J].Journal of Animal Science,2012,90(Suppl.4):40-42.
[4] CHE T M,JOHNSON R W,KELLEY K W,et al.Mannan oligosaccharide improves immune responses and growth efficiency of nursery pigs experimentally infected with porcine reproductive and respiratory syndrome virus[J].Journal of Animal Science,2011,89(8):2592-2602.
[5] EICHER S D,MCKEE C A,CARROLL J A,et al.Supplemental vitamin C and yeast cell wallβ-glucan as growth enhancers in newborn pigs and as immunomodulators after an endotoxin challenge after weaning[J].Journal of Animal Science,2006,84(9):2352-2360.
[6] SANTIN E,MAIORKA A,MACARI M,et al.Performance and intestinal mucosa development of broiler chickens fed diets containing saccharomyces cerevisiae cell wall[J].The Journal of Applied Poultry Research,2001,10:236-244.
[7] MORALES-LOPEZ R,AUCLAIR E,GARCIA F,et al.Use of yeast cell walls;beta-1,3/1,6-glucans;and mannoproteins in broiler chicken diets[J].Poultry Science,2009,88(3):601-607.
[8] SHANMUGASUNDARAM R,SIFRI M,SELVARAJ R K.Effect of yeast cell product(CitriStim)supplementation on broiler performance and intestinal immune cell parameters during an experimental coccidial infection[J].Poultry Science,2013,92:358-363.
[9] FRANK J W,BRADLEY C L,DAVIS M E,et al.Feeding MOS to sows during gestation and lactation alters immune cells in milk[R]//Arkansas animal science department report 2006.Little Rock:University of Arkansas System,2006:545.
[10] NEWMAN K E,NEWMAN M C.Evaluation of mannanoligosaccharides on the microflora and immunoglobulin status of sows and piglet performance[J].Journal of Animal Science,2001,79(1):189.(Abstr.)
[11] CZECH A,MOKRZYCKA A,GRELA E R,et al.Influence of mannanoligosaccharides additive to sows diets on blood parameters of sows and their piglets[J].Bulletin of the Veterinary Institute in Pulawy,2009,53(1):89-95.
[12] LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[13] KOKETSU Y,DIAL G D.Factors influencing the postweaning reproductive performance of sows on commercial farms[J].Theriogenology,1997,47(7):1445-1461.
[14] VANDERHAEGHE C,DEWULF J,DE KRUIF A,et al.Non-infectious factors associated with stillbirth in pigs:a review [J].Animal Reproduction Science,2013,139(1/2/3/4):76-88.
[15] HAUMONT M,DELHAYE L,GARCIA L,et al.Protective immunity against congenital toxoplasmosis with recombinant SAG1 protein in a guinea pig model[J].Infection and Immunity,2000,68(9):4948 -4953.
[16] FOXCROFT G R.Mechanisms mediating nutritional effects on embryonic survival in pigs[J].Journal of Reproduction and Fertility,1997,52:47-61.
[17] DAVIS M E,MAXWELL C V,ERF G F,et al.Dietary supplementation with phosphorylated mannans improves growth response and modulates immune function of weanling pigs[J].Journal of Animal Science,2004,82(6):1882-1891.
[18] ZHAO PY,JUNG JH,KIM IH.Effect of mannan oligosaccharides and fructan on growth performance,nutrient digestibility,blood profile,and diarrhea score in weanling pigs[J].Journal of Animal Science,2012,90(3):833-839.
[19] DE LOS SANTOS F S,DONOGHUE A M,FARNELL M B,et al.Gastrointestinal maturation is accelerated in turkey poults supplemented with a mannanoligosaccharide yeast extract(Alphamune)[J].Poultry Science,2007,86(5):921-930.
[20] OSWALD I P.Role of intestinal epithelial cells in the innate immune defence of the pig intestine[J].Veterinary Research,2006,37(3):359-368.
[21] JANSSON T,POWELL T L.Human placental transport in altered fetal growth:does the placenta function as a nutrient sensor?-a review[J].Placenta,2006,27:91-97.
[22] GUDE N M,ROBERTS C T,KALIONIS B,et al.Growth and function of the normal human placenta[J].Thrombosis Research,2004,114(5/6):397-407.
[23] HASEGAWA M,OSAKA T,TAWARATSUMIDA K,et al.Transitions in oral and intestinal microflora composition and innate immune receptor-dependent stimulation during mouse development[J].Infection and Immunity,2010,78(2):639-650.
[24] UEMATSU S,AKIRA S.Toll-like receptors and innate immunity[J].Nature Reviews Immunology,2006,84(9):712-725.
[25] BRADLEY C L.Efficacy of Bio-MOS supplementation to sow diets during gestation and lactation on subsequent performance of pigs supplemented with or without Bio-MOS[D].Ph.D.Thesis.Ann Arbor:The University of Arkansas,2006.
[26] NEWMAN K.Mannan-oligosaccharides:natural polymers with significant impact on the gastrointestinal microflora and the immune system[C]//Biotechnology in the feed industry:proceedings of Alltech’s 10th annual symposium.Loughborough:University Press,1994:167-174.

