谷氨酰胺及其前体物对松浦镜鲤肠道消化酶活性及肠道形态的影响
李晋南 徐奇友 王常安 罗 亮 赵志刚
近年来,谷氨酰胺(glutamine,Gln)因其独特的生理功能逐渐成为营养学、生理学和免疫学等学科的研究热点。研究表明,Gln可以增加免疫功能、维持酸碱平衡、增加细胞体积和增强肌肉细胞内蛋白质的合成等[1]。在许多物种中,肠黏膜和其他迅速增生的细胞(如免疫细胞)的主要能量来源是Gln,而非葡萄糖。因此,肠道是Gln最主要的消耗器官[2],但肠黏膜本身既不能产生也无法储存Gln,因此适当的补充Gln可以增加肠绒毛高度、降低肠黏膜通透性和增强肠免疫功能[3]。然而,Gln在水溶液中极不稳定,受热易分解成有毒的焦谷氨酸和氨,从而限制了它的使用。因此,本研究选择 α-酮戊二酸(α-ketoglutarate,AKG)、鸟氨 酸 - α - 酮 戊 二 酸 (ornithine-α-ketoglutarate,OKG)和谷氨酸(glutamate,Glu)3种 Gln的前体物,研究它们对松浦镜鲤肠道消化酶活性及肠道形态的影响,旨在探讨Gln前体物替代Gln的可行性。
1 材料与方法
1.1 试验材料
AKG 和 Glu购自 Sigma,纯度≥98.5%;Gln购自哈尔滨百事达生物公司;OKG购自溧阳市开拓者化学技术服务中心。
1.2 试验设计及饲粮
试验选择规格一致的初始体重为(97.33±6.74)g的健康松浦镜鲤(选自中国水产科学研究院黑龙江水产研究所)270尾。预试2周后随机分为6组,4个试验组分别为AKG组、OKG组、Gln组、Glu组,同时以鱼粉(FM)组和植物蛋白质(PM)组为对照组,每组设3个重复,每个重复15尾鱼。试验期为60 d。
FM组以鱼粉和豆粕为蛋白质源,PM组以豆粕代替鱼粉为蛋白质源,同时用L-蛋氨酸、赖氨酸和L-苏氨酸调节氨基酸平衡,鱼油和豆油为脂肪源,羧甲基纤维素为黏合剂,配制成等氮等能饲料。各试验组在植物蛋白质饲料基础上分别添加1.5%AKG、OKG、Gln 和 Glu。具体饲料组成及营养水平见参考文献[4]。饲料原料经粉碎按配比混合均匀,少量的组分采用逐级扩大法混合,然后用颗粒机制成2 mm颗粒饲料,置于-20℃冰箱中保存待用。
1.3 饲养管理
试验期间每天定时投喂3次,每次投喂以饱食无残饵为准。试验在室内控温循环水族箱里进行,温度为(24±1)℃,24 h不间断供氧,溶氧大于5 mg/L,每日吸污,每周换去水族箱内2/3水并注入已曝气的水,每日观察记录鱼摄食和死亡情况。
1.4 肠道消化酶活性的测定
饲养试验结束后,停食24 h,每缸随机选取3尾鱼,置于冰盘中迅速解剖,分别取前肠、中肠和后肠,用冰浴的0.86%生理盐水洗净肠道中的内容物,滤纸吸干水分,测量肠重。按1∶9质量体积比加入生理盐水,以FJ-200CL高速组织匀浆机匀浆,4℃条件下4 000 r/min离心10 min,取上清液分装于1.5 mL离心管中,-20℃保存待测蛋白酶、淀粉酶和脂肪酶活性。
蛋白酶活性测定采用福林-酚(Folin-phenol)法,以0.5%酪素作底物,将1 mL酶粗提液(对照管为1 mL去离子水)在37℃预热5 min后,加入2 mL预热的0.5%酪素,37℃反应15 min,然后加入10%三氯乙酸3 mL,终止反应,离心取上清液1 mL加入 0.55 mol/L Na2CO35 mL,再加1 mL福林-酚试剂,在37℃水浴中显色15 min,680 nm波长下比色,以对照管调零,测吸光度。用同样的方法计算出标准酪氨酸-吸光度的回归方程,运用回归方程计算经酶分解酪素所产生的酪氨酸的量(μg)。蛋白酶活性单位定义:在37℃下,每分钟水解酪素产生相当于1μg酪氨酸所需的酶量为1个酶活性单位。
淀粉酶和脂肪酶活性采用南京建成生物工程研究所的试剂盒测定,具体方法参见试剂盒说明书。淀粉酶活性单位定义:在37℃下,组织中每毫克蛋白质与底物作用30 min,水解10 mg淀粉定义为1个酶活性单位。脂肪酶活性单位定义:在37℃下,每克组织蛋白质在本反应体系中与底物反应1 min,每消耗1μmol底物为1个酶活性单位。
1.5 肠道形态的测定
肠道组织切片的制备:饲养试验结束后,每组随机选取3尾鱼,置于冰盘中迅速解剖,分别取前肠、中肠和后肠,以0.86%的生理盐水冲洗干净,固定于Bouin氏液中。固定24 h后,经过乙醇逐级脱水、二甲苯透明、石蜡包埋、切片(5μm)、苏木精-伊红(HE)染色、脱水、透明、中性树脂封片。用LeicaMD 4000B显微镜观察并拍照,图像由Motic Images Plus 2.0软件进行测量,每段肠样测量15个以上完整皱襞高度、绒毛宽度和肌层厚度,分别取其平均值作为该样品各指标的测定结果。
肠道指标的计算方法:饲养试验结束后,每组随机选取3尾鱼,测量试验鱼体重、体长、肠重和肠长,计算肠体指数(intestinal somatic index,ISI)、肠长指数(intestinal length index,ILI)。
肠体指数(%)=(肠重/体重)×100;
肠长指数(%)=(肠长/体长)×100。
1.6 统计分析
数据用平均值±标准差表示。试验结果用SPSS 20.0软件进行单因素方差分析和Duncan氏法多重比较,显著性水平P值为0.05。
2 结果
2.1 Gln及其前体物对松浦镜鲤肠道消化酶活性的影响
由表1可知,各组间前肠和中肠的蛋白酶活性没有显著差异(P>0.05);Glu组后肠的蛋白酶活性显著低于 FM 组(P<0.05)。OKG组和 Gln组前肠的淀粉酶活性显著高于FM组和PM组(P<0.05);Glu组中肠的淀粉酶活性显著低于FM组、PM 组和 Gln 组(P<0.05);同样,Glu 组后肠的淀粉酶活性最低,且显著低于AKG组和FM组(P<0.05)。各组间中肠和后肠的脂肪酶活性没有显著差异(P>0.05);Glu组前肠的脂肪酶活性显著高于 Gln组、OKG组、FM 组和 PM 组(P<0.05);AKG组前肠的脂肪酶活性显著高于FM组和 OKG 组(P<0.05)。
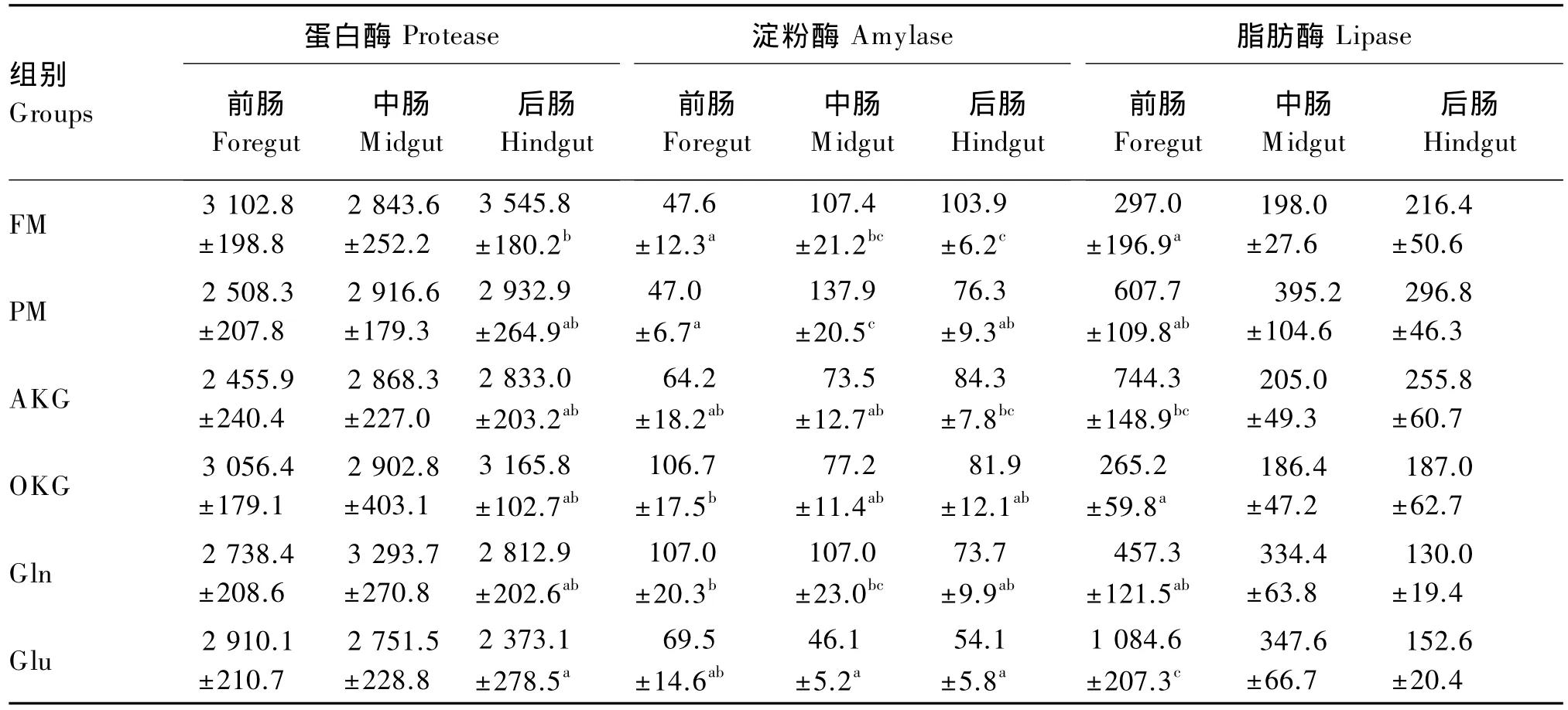
表1 Gln及其前体物对松浦镜鲤肠道消化酶活性的影响Table 1 Effects of Gln and its precursors on intestinal digestive enzyme activity of Songpu mirror carp U/g prot
2.2 Gln及其前体物对松浦镜鲤肠道形态的影响
由表2可知,各组间肠长指数没有显著差异(P>0.05)。AKG 组、Gln 组、Glu 组及 PM 组的肠体指数显著高于FM 组(P<0.05),OKG组的肠体指数与FM组差异不显著(P>0.05)。各组间中肠和后肠的皱襞高度没有显著差异(P>0.05),Gln组前肠的皱襞高度显著低于AKG组、PM组和FM组(P<0.05)。各组间各肠段的肠绒毛宽度差异不显著(P>0.05)。各组间前肠和后肠的肌层厚度差异不显著(P>0.05),AKG组的中肠肌层厚度显著高于FM 组(P<0.05),其他各组间差异不显著(P>0.05)。
各组前肠组织切片如图1所示,AKG组的肠绒毛发育良好,排列整齐紧密,因此增加了肠道的吸收面积,也有利于肠道的健康。Gln组的前肠肠绒毛排列紧密,密度比FM组有所增加,但皱襞高度下降,OKG组和Glu组前肠肠绒毛密度与FM组没有明显差异。
3 讨论
Gln具有重要的生理作用,尤其是在肠道组织,但其在溶液中和某些生理状态下不稳定,且在临床中很难掌握[5-6]。为了避免这些问题,我们选取AKG、OKG和 Glu等 Gln的前体物。AKG和Gln都是三羧酸循环中的中间产物,AKG通过转氨作用生成Glu,Glu再进一步形成Gln,这种转化是非常快速的。因AKG在生理状态和溶液中很稳定且是无毒的,因此更适于替代Gln[6]。Glu稳定性虽然好,但是有神经毒性,能导致“中国餐馆综合征”,并且不易通过细胞膜[7]。OKG是由1分子的AKG和2分子的鸟氨酸组成,研究表明OKG能阻止肌肉中Gln的减少,增加蛋白质的合成代谢,减少肌肉消耗[8]。
肠道是鱼类营养消化吸收的重要场所,因此肠道的重量、肠道的皱襞高度和各消化酶活性与动物体的生长发育和营养物质的消化吸收有重要的关系。以往的研究发现,饲料中添加Gln可以促进陆生动物肠道发育和提高消化酶活性[9-13]。在水生动物的研究中,同样表明添加Gln可以改善生长性能、肠道发育和免疫力[14-16]。Lin 等[17]发现饲料中添加Gln可以增加建鲤幼鱼体增重、摄食量、肠道重量、肠绒毛高度、碱性磷酸酶和钠钾ATP酶活性。本试验的FM组饲料组成中鱼粉20%,豆粕34%,粗蛋白质30.71%,PM 组饲料组成中豆粕62%,粗蛋白质30.81%,各试验组在PM组基础上分别添加1.5%的Gln及其前体物[4]。本试验的研究结果显示,添加Gln前体物AKG组、Glu组和Gln组的肠体指数比FM组有显著的提高,但与PM组相比差异不显著,这一结果可能是由于基础饲料的不同而引起的。但是本试验的结果显示它们并没有显著的增加肠绒毛高度,这一结果与徐奇友等[16]研究的Gln对虹鳟稚鱼肠道形态的影响结果一致,其研究表明在12周时,添加1.0%和2.0%Gln显著降低了虹鳟稚鱼肠道的皱襞高度。其原因可能是由于Gln的不稳定性,在配制饲料的过程中或其他不稳定的情况下,如水溶液中,会产生有毒的焦谷氨酸和氨,本试验结果从皱襞高度和切片结果都可以看出,肠绒毛发育受到了抑制,其原因可能是由于添加的Gln没有发挥作用,反而起到了抑制作用。因此限制了Gln在水产动物饲料中的应用。AKG组前肠的皱襞高度与对照组相比差异不显著,且从切片中可以看出,AKG组肠绒毛致密程度增加,细长且排列整齐,这样可以增加肠道的吸收面积,AKG组中肠的肌层厚度显著高于FM组,肌肉层的环肌层部分对肠的蠕动较为有利,AKG组肌层厚度增加在一定程度上促进了肠道的蠕动,提高了营养物质的吸收利用。在之前的研究表明,AKG组的增重率和蛋白质沉积效率分别比 PM组提高 5.96%和16.89%,AKG组试验动物的生长性能略优于其他添加组[4],AKG组肠道结构的改善可以解释这一现象。

表2 Gln及其前体物对松浦镜鲤肠道形态的影响Table 2 Effects of Gln and its precursors on intestinal morphology of Songpu mirror carp
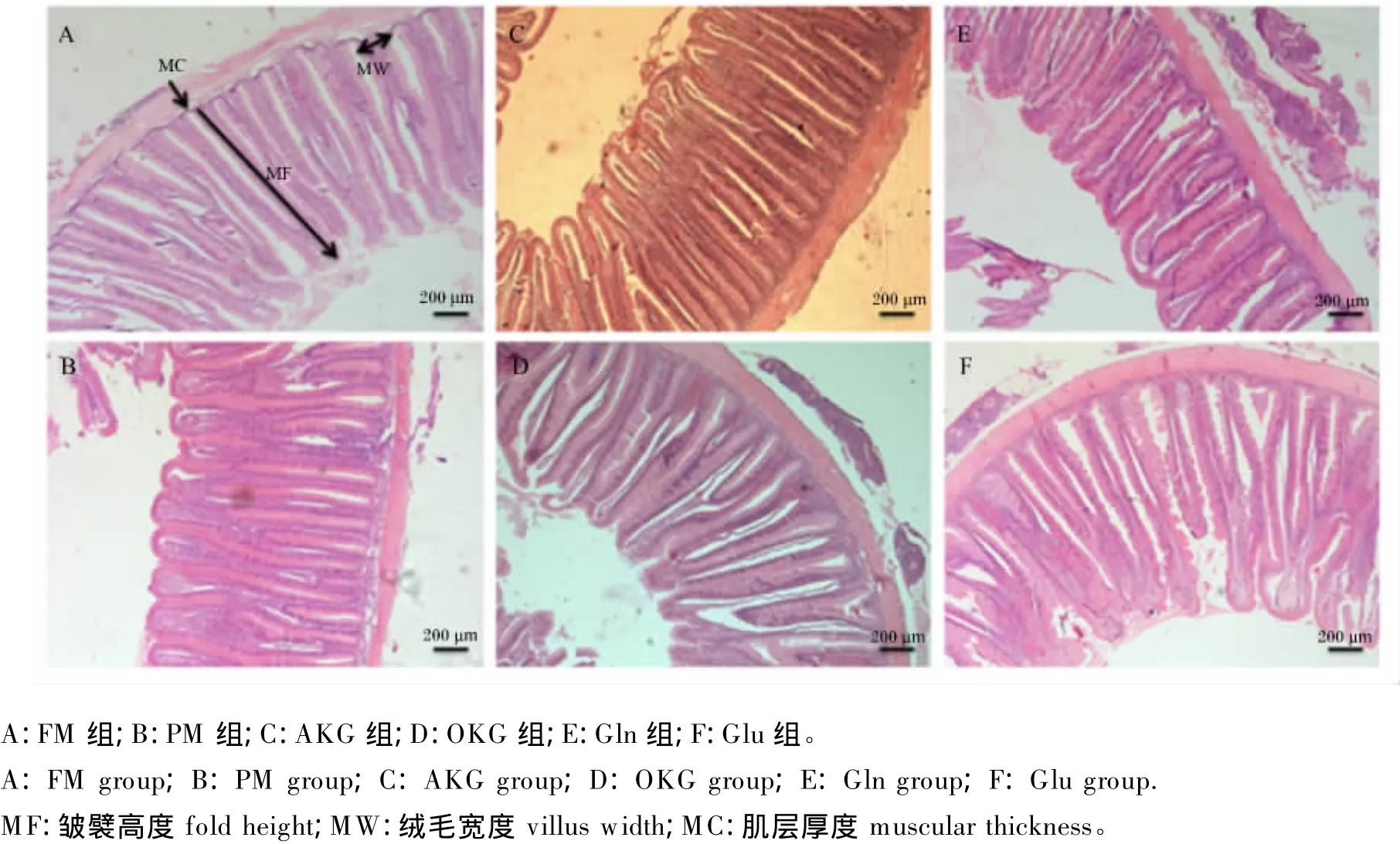
图1 松浦镜鲤前肠组织切片Fig.1 Tissue slice of foregut of Songpu mirror carp
Lin等[17]等对建鲤幼鱼的研究也表明,鱼肠道蛋白酶和脂肪酶活性随饲料Gln添加量上升而提高。而高进等[18]的研究表明,饲料中添加Gln对大黄鱼稚鱼消化酶活性没有显著影响。徐奇友等[19]的研究表明,饲料中添加 0.25%~1.00%Ala-Gln显著提高哲罗鱼仔鱼的肠脂肪酶活性。本研究的结果显示,添加1.5%的OKG和Gln显著提高了前肠的淀粉酶活性,Glu和AKG显著提高了前肠的脂肪酶活性。这一结果说明Gln及其前体物可以显著改善鲤鱼前肠消化酶活性。
4 结论
Gln及其前体物可以显著改善松浦镜鲤前肠淀粉酶和脂肪酶活性。
[1] YOUNG V R,AJAMI A M.Glutamate:an amino acid of particular distinction[J].The Journal of Nutrition,2000,130:892S-900S.
[2] YOUNG V R,AJAMI A M.Glutamine:the emperor or his clothes[J].The Journal of Nutrition,2001,131(Suppl.9):2449S-2459S.
[3] 任国谱,谷文英.谷氨酰胺活性肽营养液对大鼠小肠营养作用的研究[J].氨基酸和生物资源,2003,25(4):40-42.
[4] 李晋南,徐奇友,位莹莹,等.谷氨酰胺及其前体物对松浦镜鲤生长性能、体成分和血清生化指标的影响[J].东北农业大学学报,2013,44(12):119-125.
[5] SMITH R J,WILMORE D W.Glutamine nutrition and requirements[J].Journal of Parenteral and Enteral Nutrition,1990,14(Suppl.4):94s-99s.
[6] PIERZYNOWSKI S G,SJODIN A.Perspectives of glutamine and its derivatives as feed additives for farm animals[J].Journal of Animal and Feed Sciences,1998(7):79-91.
[7] 王凤英,姚刚,李慧显.谷氨酰胺(Gln)及其衍生物在小肠中的作用[J].新疆畜牧业,2004(1):61-63.
[8] CYNOBER L.Ornithine alpha-ketoglutarate in nutritional support[J].Nutrition,1991,7(5):313-322.
[9] 张军民,高振川,王连娣,等.日粮添加谷氨酰胺对早期断奶仔猪小肠酶的影响[J].动物营养学报,2001,13(4):18-23.
[10] HELTON W S,JACOBS D O,BONNER-WEIR S,et al.Effects of glutamine-enriched parenteral nutrition on the exocrine pancreas[J].Journal of Parenteral and Enteral Nutrition,1990,14(4):344-352.
[11] HELTON W S,SMITH R J,ROUNDS J,et al.Glutamine prevents pancreatic atrophy and fatty liver during elemental feeding[J].Journal of Surgical Research,1990,48(4):297-303.
[12] WU G,MEIER S A,KNABE D A.Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs[J].The Journal of Nutrition,1996,126(10):2578-2584.
[13] MURNIN M,KUMAR A,LI G D,et al.Effects of glutamine isomers on human(Caco-2)intestinal epithelial proliferation,strain-responsiveness,and differentiation[J].Journal of Gastrointestinal Surgery,2000,4(4):435-442.
[14] 叶元土,王永玲,蔡春芳,等.谷氨酰胺对草鱼肠道L-亮氨酸、L-脯氨酸吸收及肠道蛋白质合成的影响[J].动物营养学报,2007,19(1):28-32.
[15] 徐奇友,王常安,许红,等.丙氨酰-谷氨酰胺对哲罗鱼仔鱼生长和抗氧化能力的影响[J].动物营养学报,2009(6):1012-1017.
[16] 徐奇友,王常安,许红,等.外源性谷氨酰胺对虹鳟稚鱼生长和肠道形态的影响[J].中国粮油学报,2009,24(4):98-102.
[17] LIN Y,QIU Z X.Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp(Cyprinus carpiovar.Jian)[J].Aquaculture,2006,256(1/2/3/4):389-394.
[18] 高进,艾庆辉,麦康森.微颗粒饲料中添加谷氨酰胺对大黄鱼稚鱼生长、存活及消化酶活力的影响[J].中国海洋大学学报:自然科学版,2010,40(1):49-54.
[19] 徐奇友,王常安,许红,等.饲料中添加谷氨酰胺二肽对哲罗鱼仔鱼肠道抗氧化活性及消化吸收能力的影响[J].中国水产科学,2010,17(2):351-356.

