Salen-Co(Ⅲ)配合物催化CO2和环氧乙烷生成环状碳酸酯
王 益,陈 冕,刘 杰
(云南师范大学 化学与分子工程学院,云南 昆明 650500)
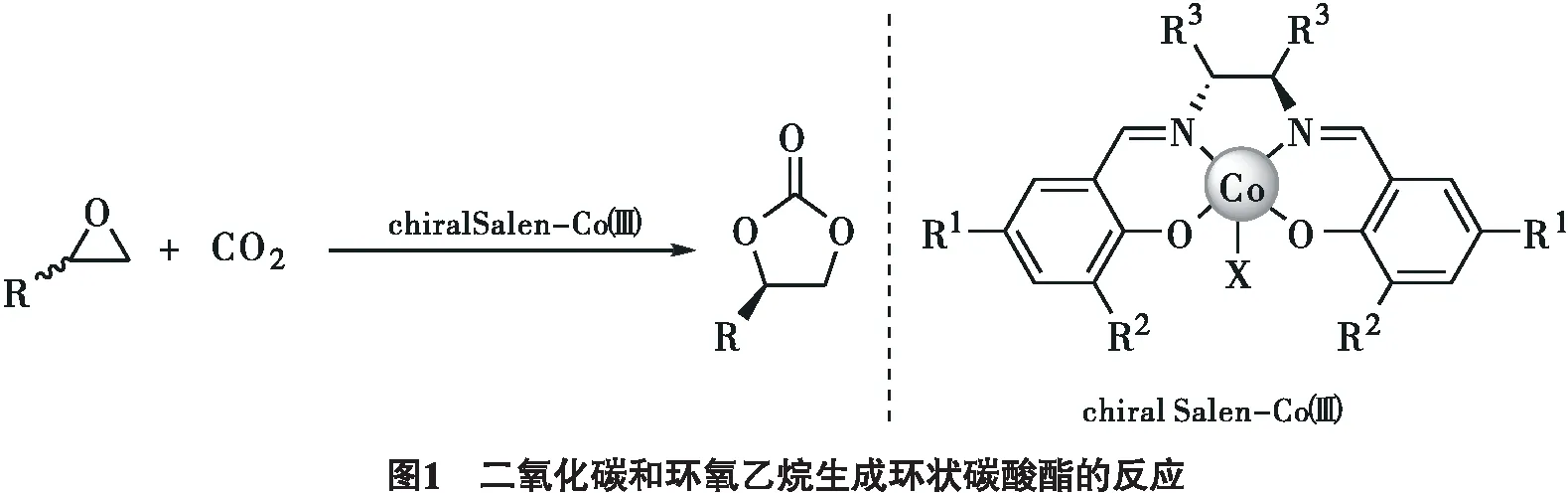
环状碳酸酯是一类非常重要的化合物,它既可以作为锂离子电池中的电解质和制药过程中的中间体,还可以作为合成塑料的原料,作为环境友好型的非质子型溶剂和脱脂剂[1-3].利用CO2为化学原料合成环状碳酸酯已50年了,尽管CO2是环境污染物,在工业上它可以作为原料合成聚碳酸酯和环状碳酸酯,相比于使用光气为原料这种方法更加环保.但是该方法经常要受到催化稳定性差、活性差和对空气敏感,需要使用混合溶剂以及高温高压,催化剂不易制备等条件的制约[4].
Salen配体有N2O2配位原子,可以插入多种金属离子进行协调配位形成催化中心(见图1).多种取代基能被引入到芳香环里,从而为各种各样的催化反应作准备.手性分子可以被简单地引入到Salen骨架中,这个特征对催化外消旋环氧化物和CO2合成光学纯的环状碳酸酯非常有吸引力.Salen-Co(Ⅲ) 配合物在催化CO2和环氧化合物合成环状碳酸酯反应中取得了重大进展[5].在此,我们将讨论使用Salen-Co(Ⅲ) 配合物作为催化CO2和环氧化物反应的多相和均相催化剂.特别强调的是这些催化剂经常能提供聚碳酸酯和环状碳酸酯,在一定的反应条件下(例如CO2压力和催化剂的负载等)能转化为所期望得到的单一产物.
1 Salen-Co(Ⅲ) /助催化剂体系
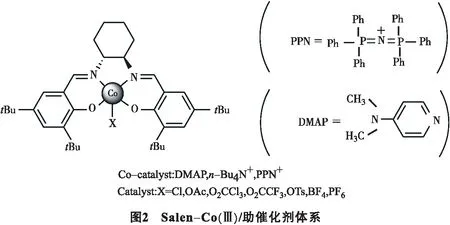
Jacobsen等[6-10]发现,除了Salen-Cr(Ⅲ) 配合物之外,钴的衍生物也可以作为环氧化物开环的催化剂.研究结果表明Salen-Co(Ⅲ) /DMAP(4-二甲氨基吡啶)催化体系具有最好的催化活性.Nguyen等[11]探讨了使用Salen-Co(Ⅲ) 配合物作为催化剂怎样提高CO2和环氧化物反应的可能性(见图2).催化过程中要求路易斯碱(LB)的存在作为助催化剂.没有助催化剂的存在催化剂就没有活性,因此只有微量的环状碳酸酯生成.助催化剂可以增加路易斯碱的碱性.在这种情况下,两分子的催化助剂被使用:一分子助催化剂的作用是作为亲核试剂打开被路易斯酸活化的环氧化物;另一分子的作用是控制CO2插入的速率.对CO2和环氧丙烷的反应来说,DMAP作为助催化剂可以达到非常好的转化率.这一催化体系下(100 ℃,2 200 kPa压强的CO2)能转化各种末端环氧化物[12-13].如:环氧丙烷,聚已烯环氧化物,环氧氯丙烷,环氧己烷或异丁烯环氧化物均以当量的产率得到相应的环状碳酸酯.
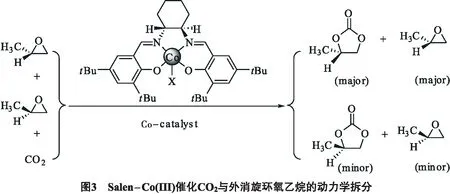
与此同时,Salen-Co(Ⅲ) /助催化剂体系被成功作为水解动力学拆分环氧化物的催化剂(见图3).Lu等[14]报道了一种简单高效的手性Salen-Co(Ⅲ) /季铵盐卤化物催化体系用于动力学拆分反应.这可以实现在相对温和没有溶剂的条件下,由外消旋环氧化物直接合成具有光学活性的环氧碳酸酯.这些研究表明季铵盐在反应中是必需的,它能促进反应而且对对映选择性和反应速率有较大的影响,同时对平衡离子和温度等反应性能也有较大的影响.在室温下,0.5 mol的外消旋环氧丙烷,0.55~0.60倍的CO2在0.001 mol配合物与0.001 moln-Bu4NBr (四叔丁基溴化铵) 结合作为催化剂存在时,反应约2 h就得到中等的对映选择性的环氧化物和碳酸丙烯酯产物.
Berkessel等[15]发现Salen-Co(Ⅲ) /助催化剂这一类型催化体系的选择性在低温下能够得到提高.在-50 ℃和一个标准大气压力的CO2下,碳酸丙烯酯的ee为87%.在更深入的研究中发现低温下催化组合虽然转化率很低,但是能得到更好的立体选择性.选择平衡离子X对催化体系的活性有重要影响,而对对映选择性影响不大.筛选不同的盐(Bu4N+和PPN+)显示出有机盐的阴离子也会对CO2的加成有影响.当X=O2CCF3,助催化剂离子=PPN+,在-40 ℃混合时可以得到最好的效果.在这种情况下以40%的产率得到环状碳酸酯产物(PC),ee值为83%.在TBAMC(四叔丁基碳酸铵)作为助催化剂下,首次通过环氧丙烷合成得到了丙基碳酸酯产物,虽然只有18%的产率,但是仍然取得了较好的立体选择性(71%ee).
Darensbourg等[16]对类似体系也进行了研究:当Co(Ⅲ) 中心被Co(Ⅱ)取代(Salen-Co(Ⅱ)/n-Bu4NCl, 平衡离子X = Cl, N3, Br, I)对催化CO2和环氧丙烷生成聚碳酸酯非常有效,只有少量的短链醚连接的副产物生成.该反应通过一个六元环状碳酸酯(三亚甲基碳酸酯)中间体,以开环聚合作用得到相应的聚碳酸酯(TMC)产物.
接下来的策略是使用Salen-Co(Ⅲ) 和添加剂作为共同的催化剂体系固定CO2(见图4).Jin等[17]报道了若干个Salen-Co(Ⅲ) 配合物和季鎓三溴盐(PTAT)混合在一起,选择不同的抗衡离子作取代基形成一类新的催化体系.实验结果表明PTAT是最好的添加剂,在十分温和的条件下对CO2和环氧丙烷加成生成丙烯酸碳酯产率为71%.他们研究组也对这一类型的一系列手性催化剂进行的不对称反应进行了研究.在CO2和环氧丙烷的偶联反应中,虽然这些催化剂的立体选择性较低,但是却都可以得到较好的产率和TOF值.

2 双官能团Salen-Co(Ⅲ) 催化剂
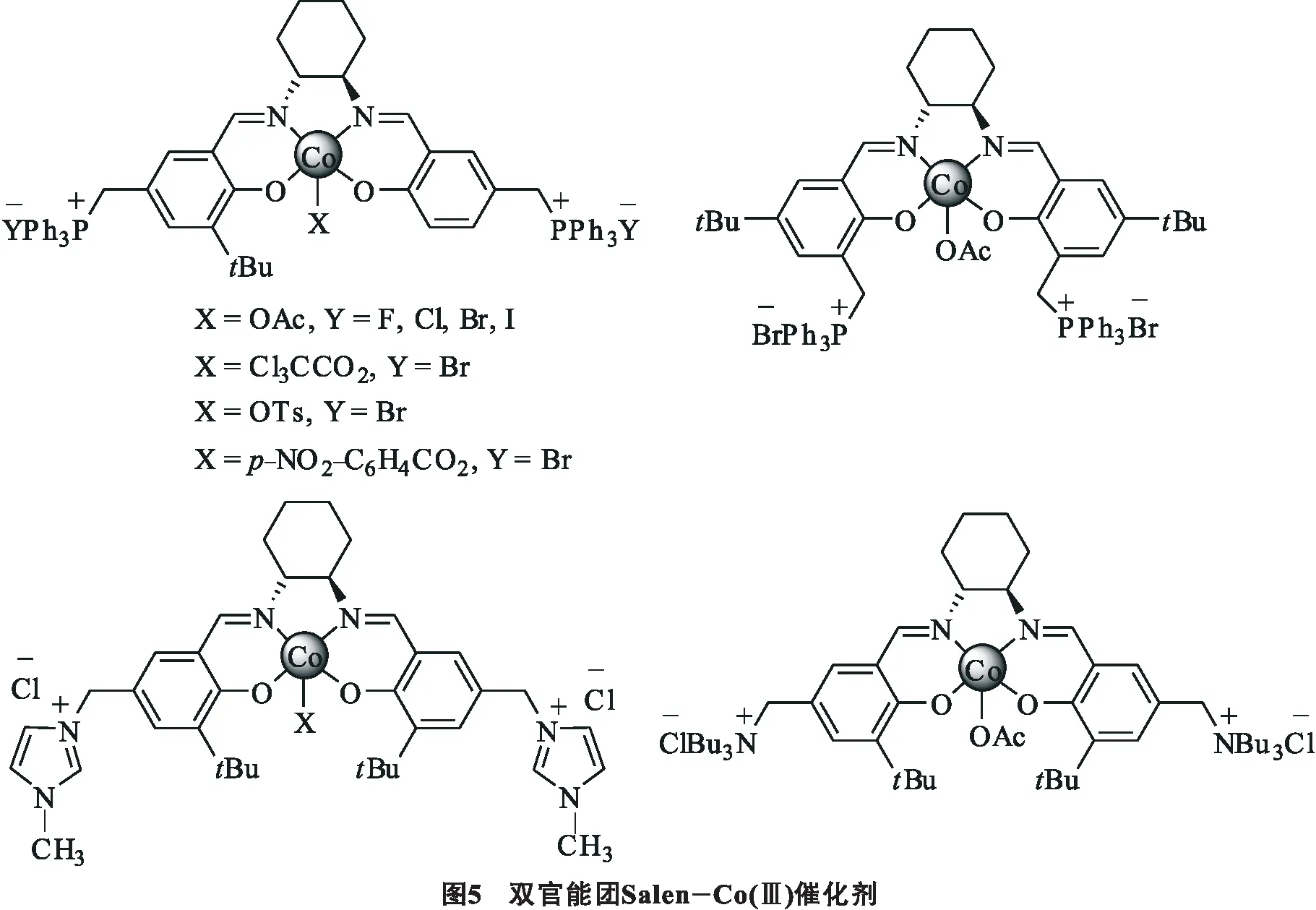
通过动力学拆分外消旋环氧化物可以得到手性的环状碳酸酯.Jing等[18]提出了一系列的双官能团催化剂.这种催化剂由一分子的路易斯酸金属Salen配合物和季鎓离子作为路易斯碱混合而成,通过在Salen类型的配体中引入季磷酸基团增加反应的立体选择性(见图5).通过筛选不同的催化体系发现季鎓盐阴离子同时影响反应的活性和立体选择性.氯化物的ee值最高,碘化物的反应活性最高,磷基团位置的变化也会影响反应的速率.至于催化剂平衡离子的影响,通常来说醋酸根有更好的立体选择性,在温和条件下(0 ℃,600 kPa CO2)得到的丙烯碳酸酯的ee值为78%.不幸的是,使用同样的催化体系对其他的环氧化合物只得到中等偏低的ee值.例如苯基环氧乙烷的ee值为5%,环氧氯丙烷的ee值为30%,1, 2-氧化丁烯的ee值为47%.值得一提的是这些催化剂可以循环使用5次,催化活性和立体选择性没有大的损失.
3 Salen-Co(Ⅲ) /碱金属体系
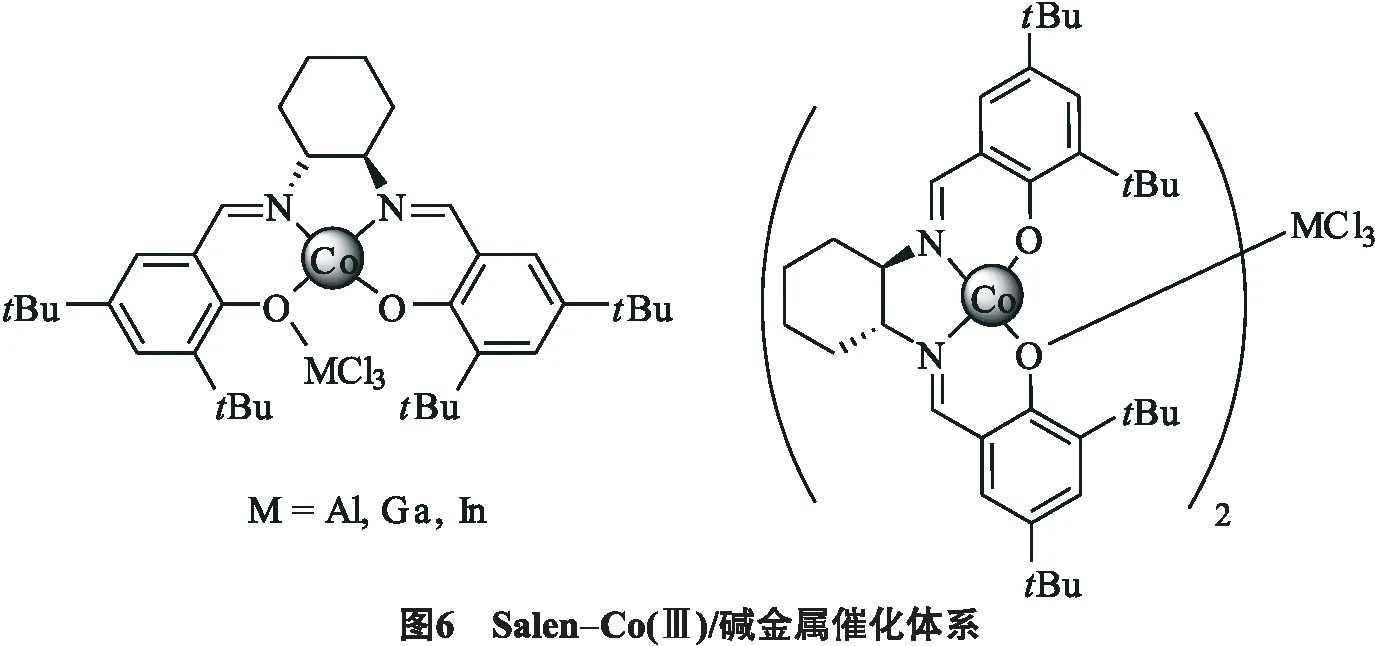
Kim等[19]报告了不同的方法来提高环氧化物和CO2耦合反应的对映选择性.在一定催化量的碱金属盐,季铵盐卤化物,或离子液体存在下,手性Salen-Co(Ⅱ)配合物可以有效地催化这类反应,见图6.在CO2插入环氧丙烷的反应中,配合物中碱金属M=Al的时候被认定为是最有效的单核催化剂,只需要在室温下,催化剂用量为0.05%就能得到85%的ee值.增加催化剂用量或者增加无机碱都能提高产物的ee值.例如使用氢氧化钾,碳酸钾,碳酸氢钾明显提高碳酸丙烯酯的的ee值,但产量只有中等程度的改善.加入催化量的季铵盐卤化物或离子液体可以提高产率.这些催化剂的阴离子和阳离子对催化性能有重要作用.使用阳离子如MIm(甲基咪唑盐),或n-Bu4N能有效提高反应速率,而使用一个简单的阴离子如OH也能提供良好的对映选择性.
4 联萘Salen-Co(Ⅲ) 催化剂
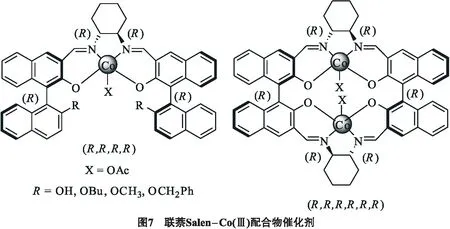
Jin等[20]使用手性联萘Salen-Co(Ⅲ) 配合物,在季鎓三溴盐(PTAT)或四丁基溴化铵(TBAB)复合物的存在下,对环氧化物和CO2耦合反应进行了研究(见图7).该类型的催化剂在承担衔接片段和联萘(BINOL)结构上都存在手性信息,这种特征在催化不对称环加成反应中表现出很好的对映选择性.当这两个单元有相同的手性配置(S/S或R/R),得到相反的手性环状碳酸酯产物(R或S).然而,当1,1′-2-联萘酚和1,2-环己二胺构型不相同(S/R或R/S),催化剂的活性和对映选择性明显下降.催化剂有更大的取代基X给予较高的ee值.在最优反应条件下(0 ℃和500 kPa的CO2压力),R= OBu/PTAT是最好的催化体系,环状碳酸酯产物ee值为87%.
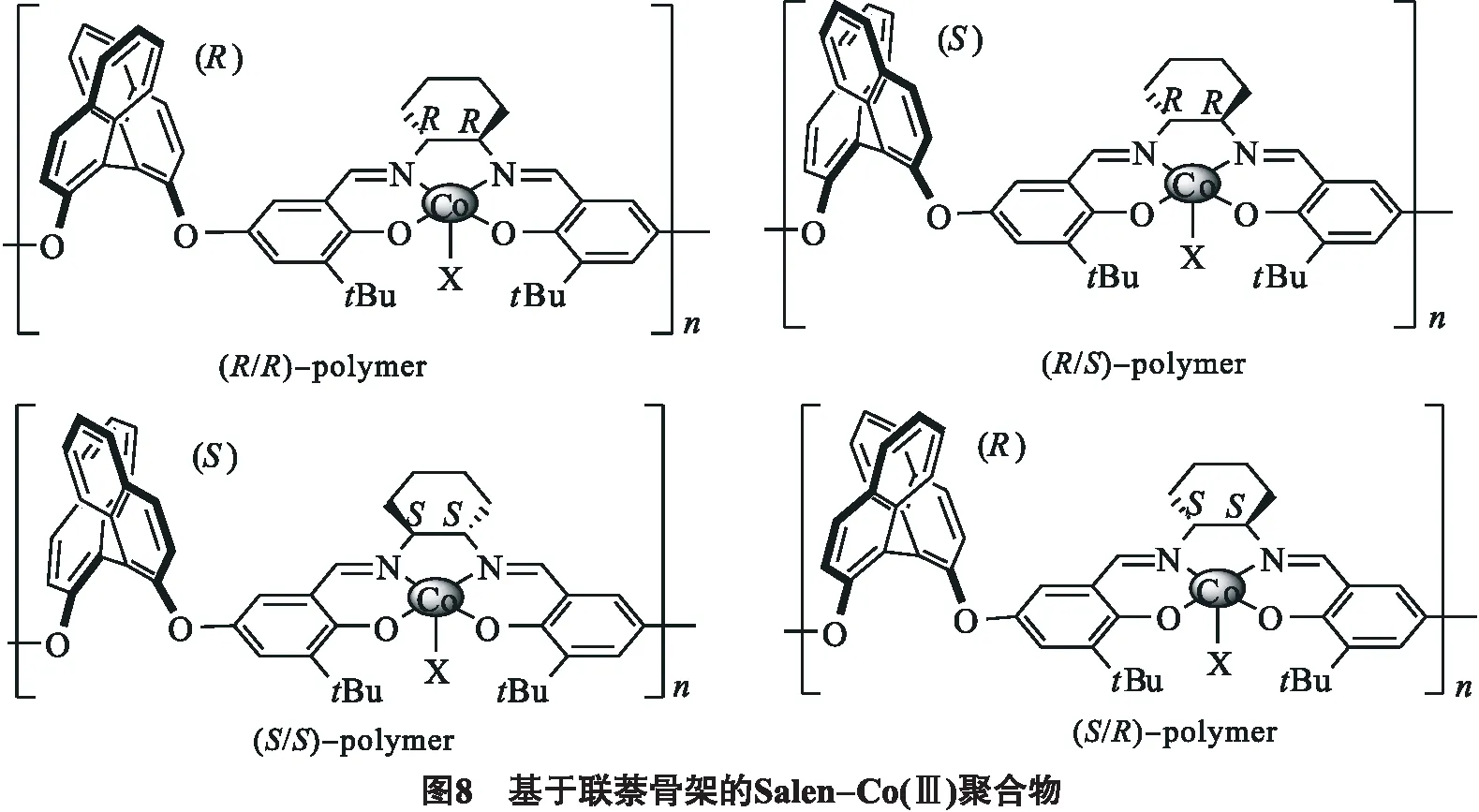
为了提高ee值的同时保持良好的催化活动,Jin等[21]开发了4种新的基于联萘酚结构的Salen-Co(Ⅲ) 聚合物作为催化剂.与传统的Salen-Co(Ⅲ) 催化剂相比,该结构有一个对称手型中心,因此可以得到更高的对映选择性(见图8).助催化剂PTAT存在下和大位阻阴离子X(X=Cl3CCO2)催化剂对催化效率和获得高对映选择性都非常重要.(R/R)-聚合物和(R/S)-聚合物催化环氧化物转换率为40.2%,分别得到61.2%ee值的S-型环状碳酸酯和60.2%ee值的R-型环状碳酸酯,均高于使用单金属催化剂取得的效果.然而(S/S)-聚合物和(S/R)-聚合物得到的催化效果却不如单核催化剂,只有52.0%的转换率,49.5%的ee值,这充分显示出手性联萘酚片段在手性诱导方面的重要性.聚合物Salen-Co(Ⅲ) 配合物也可以被回收和重复使用而不丧失催化活性和对映选择性.
5 结语
Salen-Co(Ⅲ) 配合物因其合成方便、高效、低毒、适用广泛而激起了化学家们浓厚的兴趣,在固定CO2和环氧乙烷的加成反应,尤其在不对称催化合成手性环状碳酸酯中扮演着越来越重要的角色, 成为近几年中不对称催化固化CO2的一个十分活跃的领域.毫无疑问,在研究人员的不懈努力下,Salen-Co(Ⅲ) 配合物将会被应用到更多的新的催化反应中,并且会有更大的突破和进展.
参考文献:
[1] SAKAKURA T, CHOI J C, YASUDA H.Transformation of carbon dioxide[J].Chemical Reviews, 2007, 107(6):2365-2387.
[2] ARESTA M, DIBENEDETTO A.Utilisation of CO2as a chemical feedstock:opportunities and challenges[J].Dalton Transactions, 2007 (28):2975-2992.
[3] ARESTA M.Carbon dioxide as chemical feedstock[M].John Wiley & Sons, 2010.
[4] SAKAKURA T, KOHNO K.The synthesis of organic carbonates from carbon dioxide[J].Chemical Communications, 2009 (11):1312-1330.
[5] CLEMENTS J H.Reactive applications of cyclic alkylene carbonates[J].Industrial & Engineering Chemistry Research, 2003, 42(4):663-674.
[6] KRUPER W J, DELLAR D D.Catalytic formation of cyclic carbonates from epoxides and CO2with chromium metalloporphyrinates[J].The Journal of Organic Chemistry, 1995, 60(3):725-727.
[7] DARENSBOURG D J, YARBROUGH J C.Mechanistic aspects of the copolymerization reaction of carbon dioxide and epoxides, using a chiral salen chromium chloride catalyst[J].Journal of the American Chemical Society, 2002, 124(22):6335-6342.
[8] PÉREZ E R, SANTOS R H A, GAMBARDELLA M T P, et al.Activation of carbon dioxide by bicyclic amidines[J].The Journal of Organic Chemistry, 2004, 69(23):8005-8011.
[9] BERKESSEL A, BRANDENBURG M.Catalytic asymmetric addition of carbon dioxide to propylene oxide with unprecedented enantioselectivity[J].Organic Letters, 2006, 8(20):4401-4404.
[10] TOKUNAGA M, LARROW J F, KAKIUCHI F, et al.Asymmetric catalysis with water:efficient kinetic resolution of terminal epoxides by means of catalytic hydrolysis[J].Science, 1997, 277(5328):936-938.
[11] PADDOCK R L, NGUYEN S B T.Chiral (salen) Co(III) catalyst for the synthesis of cyclic carbonates[J].Chemical Communications, 2004 (14):1622-1623.
[12] LI F, XIA C, XU L, et al.A novel and effective Ni complex catalyst system for the coupling reactions of carbon dioxide and epoxides[J].Chemical Communications, 2003 (16):2042-2043.
[13] FU G C.Enantioselective nucleophilic catalysis with “planar-chiral” heterocycles[J].Accounts of Chemical Research, 2000, 33(6):412-420.
[14] LU X B, LIANG B, ZHANG Y J, et al.Asymmetric catalysis with CO2:Direct synthesis of optically active propylene carbonate from racemic epoxides[J].Journal of the American Chemical Society, 2004, 126(12):3732-3733.
[15] PADDOCK R L, NGUYEN S B T.Chemical CO2fixation:Cr (Ⅲ) salen complexes as highly efficient catalysts for the coupling of CO2and epoxides[J].Journal of the American Chemical Society, 2001, 123(46):11498-11499.
[16] CHANG T, JING H, JIN L, et al.Quaternary onium tribromide catalyzed cyclic carbonate synthesis from carbon dioxide and epoxides[J].Journal of Molecular Catalysis A:Chemical, 2007, 264(1):241-247.
[17] CHANG T, JIN L, JING H.Bifunctional chiral catalyst for the synthesis of chiral cyclic carbonates from carbon dioxide and epoxides[J].Chem Cat Chem, 2009, 1(3):379-383.
[18] CHEN S W, KAWTHEKAR R B, KIM G J.Efficient catalytic synthesis of optically active cyclic carbonates via coupling reaction of epoxides and carbon dioxide[J].Tetrahedron letters, 2007, 48(2):297-300.
[19] JIN L, HUANG Y, JING H, et al.Chiral catalysts for the asymmetric cycloaddition of carbon dioxide with epoxides[J].Tetrahedron:Asymmetry, 2008, 19(16):1947-1953.
[20] YAN P, JING H.Catalytic asymmetric cycloaddition of carbon dioxide and propylene oxide using novel chiral polymers of BINOL-Salen-Cobalt (Ⅲ) salts[J].Advanced Synthesis & Catalysis, 2009, 351(9):1325-1332.

