荧光法测定蒜头果蛋白中Trp的含量
袁 燕,张 薇,戴建辉,陈磊,钱吉花,殷兆福
(云南民族大学 云南省生物高分子功能材料工程技术研究中心,云南 昆明 650500)
色氨酸(Trp)是食物中含量较少且在体内又无法自行合成的“必需氨基酸”,它对人和动物的生长发育、新陈代谢起着重要的作用,被称为第二必需氨基酸[1].色氨酸测定方法主要有纸层析法、荧光法、高效液相色谱法、气相色谱-质谱联用、质谱-质谱联用、毛细管电泳、酶/比色法以及酶电极法等[2-3].由于Trp在受到紫外光照射后,会产生比激发波长更长的荧光信号,所以利用Trp的荧光特性,可以用简便、快捷、高灵敏度的荧光光谱分析方法来检测Trp的含量[4].
蒜头果(MalaniaoleiferaChunet S. Lee)属于铁青树科蒜头果属[5],是中国特有单种属稀有植物,国家二级保护树种,广西重点保护野生植物[6-7].蒜头果蛋白(malanin)是从云南广西特有植物蒜头果中分离、纯化出的一种新的、具有抗肿瘤活性的蛋白质[8],该蛋白是一种糖蛋白,相对分子质量为 61 875,由A、B两条链通过二硫键连接而成.由于在通常的氨基酸分析中一般都使用酸水解蛋白质,但是在酸水解条件下,Trp极易被破坏,故在氨基酸分析测定中无Trp的含量数据,而需要单独测试[9].本研究以NaOH为水解液,利用荧光法测定malanin中Trp的含量,为malanin全序列的测定提供参考数据.
1 材料与方法
1.1 材料与试剂
malanin由本课题组制备;L-色氨酸为上海生物工程技术有限公司产品;其它试剂均为国产分析纯;所有水均为Milli-Q纯水.
1.2 仪器
F-4500荧光分光光度计(HITACHI公司);Milli-Q纯水机(MILLIRORE公司);万分之一天平(Sartorius, BP110S).
1.3 实验方法
1.3.1 Trp标准系列溶液配制
准确称取色氨酸10 mg,加蒸馏水溶解,定容至10 mL,此溶液质量浓度即为1 mg·mL-1.在7支试管中分别加入1 mg·mL-1Trp溶液0.00、0.05、0.10、0.20、0.25、0.30和0.35 mL,再用pH=10.5的KH2PO4- NaOH缓冲液定容至5 mL,则Trp标准溶液的质量浓度分别为0.00、0.02、0.03、0.04、0.05、0.06、0.07 mg·L-1.
1.3.2 荧光光谱测定
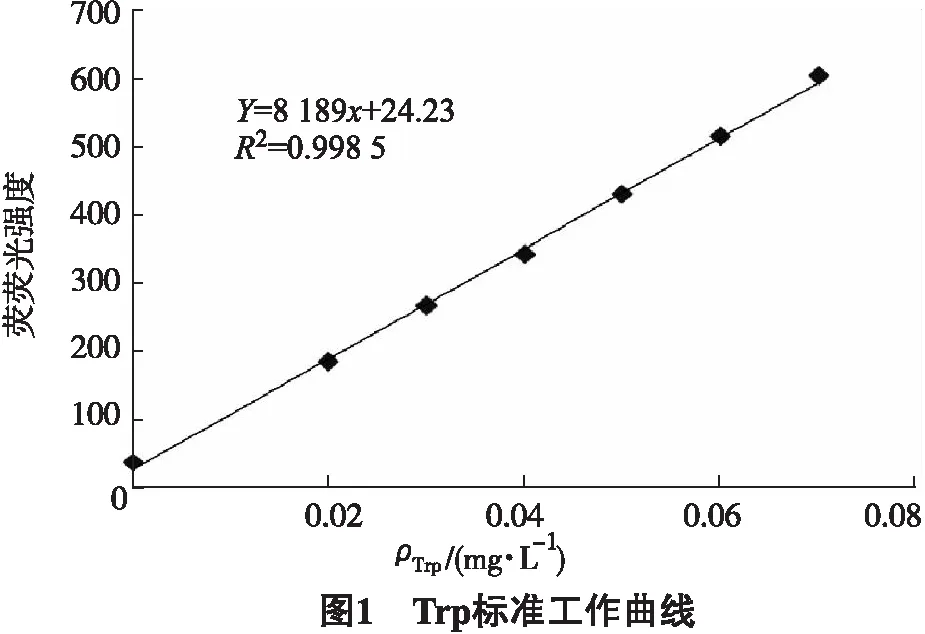
选用激发波长225 nm,在290~450 nm扫描荧光光谱,于发射波长350 nm处读取荧光强度值.激发光谱狭缝宽度为5 nm,发射光谱狭缝宽度为10 nm,高速扫描,以Trp标准溶液浓度为横坐标,荧光强度为纵坐标绘制标准曲线[10].如图1所示,可见Trp在0.00~0.07 mg·L-1范围内线性良好.
1.3.3 Malanin样品的水解
称取5 mg malanin于水解管内,加入新配制的含0.5%可溶性淀粉的6.0 mol·L-1NaOH溶液5 mL,向水解管充纯氮3 min后封口,在烘箱中110 ℃水解20 h 后,放置于暗处冷却至室温[11].
将水解产物转移至已加有5.0 mL 6 mol·L-1HCl的50 mL容量瓶中,用纯水反复冲洗水解管5~6次后加入l 滴 0. l %的酚酞溶液,然后用6 mol·L-1HCl调溶液至无色,再用l mol·L-1NaOH 滴定至溶液呈粉红色,用纯水定容.取1 mL样品于5 mL刻度管中,用pH 10.5的KH2PO4-NaOH 缓冲液定容后摇匀,即为样品待测液.
1.3.4 样品中Trp含量的测定
样品待测液按照1.3.2的实验方法进行,选用225 nm为激发波长,350 nm为发射波长进行荧光测定.
1.3.5 样品中Trp含量的计算采用标准曲线法[10].

2 结果与分析
2.1 Trp标准曲线
以Trp标准溶液质量浓度(mg·L-1)为横坐标,荧光强度为纵坐标得到线性回归方程为y= 818 9x+24.23 (R2=0.998 5)(图1).结果表明,在0.00~0.07 mg·L-1线性范围内,Trp标准溶液质量浓度与荧光强度呈良好的线性关系.
2.2 NaOH水解液浓度的选择
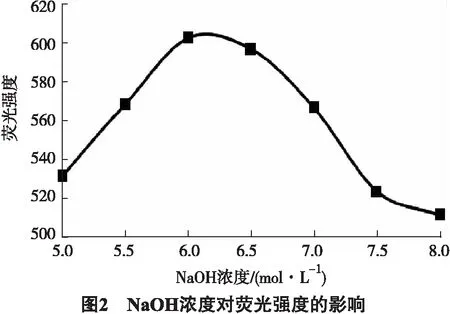
为研究NaOH的水解条件对malanin水解产生Trp量的影响,本研究分别向5 mg malanin中加入5 mL不同浓度的NaOH进行水解,其结果如图2所示,可见NaOH浓度在5.5~7.0 mol·L-1范围内较好,故本实验选用6.0 mol·L-1.
2.3 Malanin中Trp的含量测定
根据回归方程及含量公式可以计算得出malanin中Trp的含量为5.116 mg·g-1,即每分子malanin中含Trp约为4个.
2.4 检测限和精密度试验
在最佳试验条件下,对0.05 mg·L-1的Trp标准溶液连续测定8次,由荧光信号强度的标准差的3倍与工作曲线斜率之比,得检测限为0.002 mg·L-1.对malanin连续取样测定8次,相对标准偏差(RSD)为1.82%.
2.5 样品重现性和回收率试验
取5.0 mg左右的malanin样品6份,按上述水解法处理,仪器条件同上,测定结果如表1所示.重现性试验的相对标准偏差为1.05%,结果表明重现性较好.
在malanin待测液中进行加标回收实验,计算得到的回收率结果如表2,回收率在96.1%~100.1%之间,说明准确度较好,达到了分析实验的要求.
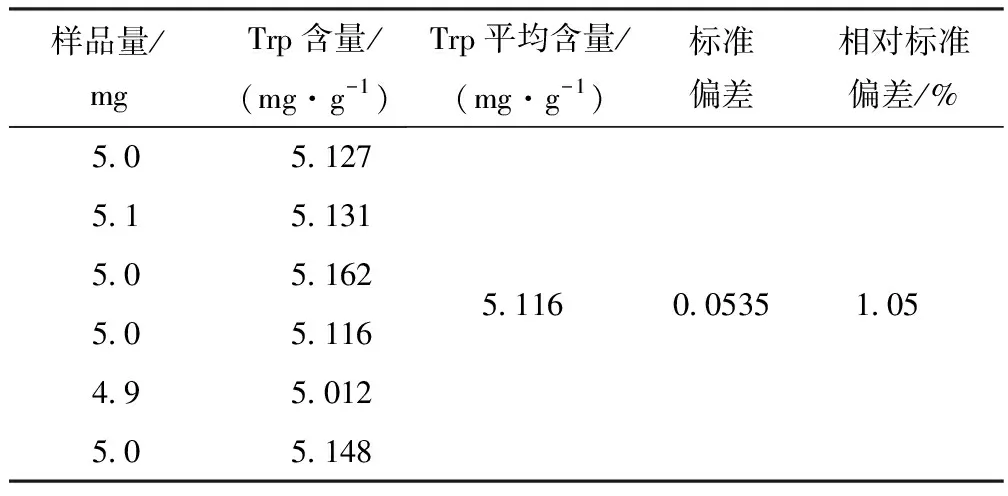
表1 重现性试验

表2 回收率试验
3 结语
由于蛋白质的氨基酸组成测定的水解方法主要是酸水解,同时辅以碱水解.酸水解虽然不引起消旋作用,得到的是L-氨基酸,但Trp却完全被沸酸所破坏,羟基氨基酸(丝氨酸及苏氨酸)有一小部分被分解,同时天冬酰胺和谷胺酰胺的酰胺基也被水解下来.为测定Trp含量,蛋白质可用碱水解,虽然水解过程中多数氨基酸遭到不同程度的破坏,并且会产生消旋现象,所得产物是D型和L型氨基酸的混合物,但Trp在碱性条件下却是稳定的,可以定量回收[12].故本研究以NaOH为水解液,利用荧光法测定malanin中Trp的含量,得出malanin中Trp含量为5.116 mg·g-1,即每分子malanin中含Trp约为4个,此结果为酸水解测定malanin氨基酸的组成作为补充,同时也为malanin全序列的测定提供较好的参考数据.
参考文献:
[1] 孙昕. 分光光度法测定豆类及其粗蛋白质中的色氨酸[J]. 生物学杂志, 2000, 17(5):33-35.
[2] 于金龙, 郭长江, 黄英武, 等. 发酵液中色氨酸含量高通量快速测定[J]. 氨基酸和生物资源, 2008, 30(1):70-71.
[3] 高春, 周淑平, 李群, 等. 18种复合氨基酸注射液中N-乙酰-L-酪氨酸及L -色氨酸含量测定方法的研究[J]. 中国生化药学杂志, 1998, 19, 3.
[4] 吴芳, 郭卫东, 张润, 等. 荧光法测定微藻中色氨酸的含量[J].海洋科学, 2005, 29(10):1-4.
[5] 丘华兴, 林有润. 中国植物志(24卷)[M].北京:科学出版社, 1988, 24.
[6] 傅立国. 中国植物红皮书——稀有濒危植物(1册)[M]. 北京:科学出版社, 1992:480.
[7] 广西林业局保护站. 广西壮族自治区重点保护野生植物资源调查报[R]. 南宁, 2001:6.
[8] YUAN Y, DAI X C, WANG D B, et al. Purification,characterization and cytotoxicity of malanin, a novel plant toxin from the seeds ofMalaniaoleifera[J]. Toxicon, 2009, 54:121-127.
[9] 金静芳, 沈明泉. 荧光法测定羽毛中的色氨酸含量[J]. 氨基酸和生物资源, 1995, 17(4):27-30.
[10] 任大喜, 提伟钢, 李景红, 等. 荧光法测定婴儿奶粉中色氨酸的含量[J]. 食品工业科技, 2007, 28(7):203-204.
[11] 刘惠容, 张双峰. 玉米子实中色氨酸的测定[J]. 陕西农业大学, 1987, 3:34-36.
[12] 沈同, 王镜岩. 生物化学[M]. 2版.北京:高等教育出版社, 2002:121.

