栀子蓝色素的制备及其抗氧化活性研究
尹 燕,黄相中,关小丽,李艳春,倪 崛,李云龙
(1.云南瑞宝生物科技有限公司,云南 昆明 650217; 2. 云南民族大学 民族药资源化学国家民委-教育部重点实验室,云南 昆明 650500)
栀子是茜草科植物栀子(GardeniajasminoidesEllis)的干燥成熟果实,为临床常用中药,属卫生部颁布的第一批药食两用资源,其性寒、味苦,归心、肺、三焦经[1].在我国主要分布于江苏、安徽、江西、广东、广西、云南、河南、贵州、四川、湖北、福建、台湾等地[2].栀子苷是栀子的主要成分之一,栀子蓝色素是以栀子苷为底物,经过β-葡萄糖苷酶的作用或微生物发酵所制得的天然色素[3-5],栀子蓝色素的稳定性已有文献报道[6-8],抗氧化活性未见报道.本研究用米曲霉发酵产物水解栀子苷,水解产物与味精反应制备栀子蓝色素,旨在提高栀子蓝色素粗品的色价,并用大孔树脂DM-2对制得的栀子蓝色素进行精制,同时以DPPH自由基捕获分光光度法测定栀子蓝色素的抗氧化活性,为提高栀子蓝色素工业化生产中粗品的色价提供科学依据,为食用天然色素的应用进一步拓宽渠道.
1 材料与方法
1.1 材料
1) 原料与试剂.栀子苷(液态,含量42.30%),云南瑞宝生物科技有限公司;米曲霉(编号:ym3 051),云南省微生物研究所;1,1-二苯-2-苦肼基(DPPH·)、2,6-二叔丁基-4-甲基苯酚(BHT),Sigma 公司;DM-2大孔吸附树脂,山东鲁抗立科药物化学有限公司;味精(含量≥99%),河南莲花味精股份有限公司;马铃薯葡萄糖琼脂培养基(PDA培养基),生物试剂,北京三药科技开发公司;水为蒸馏水;其它试剂均为国产分析纯.
2) 仪器与设备.KY-隔水式培养箱, BS-2F恒温震荡培养摇床,金坛市华城开元实验仪器厂;LDZX-BOA立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-1F型超净工作台,中日合资苏州安泰空气技术有限公司;FA1604 型电子天平,上海天平仪器厂; ZK-82A真空干燥箱,上海实验仪器总厂;RE-52旋转蒸发仪,上海亚荣生化仪器厂;SHZ-D(Ⅲ)循环水式真空泵,巩义市英峪予华仪器厂;HH-4数显恒温水浴锅,金坛市华富仪器有限公司;UV 1810分光光度计,北京普析通用仪器有限责任公司.
1.2 实验方法
1.2.1 PDA培养基的配制
取3.7 g培养基粉末,加水100 mL,加热溶解,分装于15 mm×150 mm的试管中,加塞、包扎,121 ℃灭菌20 min后取出试管摆斜面,冷却后贮存备用.
1.2.2 发酵液的制备
1) 菌悬液的制备.在无菌的条件下,把米曲霉接入PDA培养基,在29 ℃培养箱中培养73 h,然后用无菌生理盐水配制成107~108cfu·mL-1的菌悬液.
2) DNS试剂的配制.准确称取无水的3,5 -二硝基水杨酸3.25 g,氢氧化钠1.6 g溶解于20 mL蒸馏水中,加入22.5 mL丙三醇溶解定容至500 mL,贮存于棕色试剂瓶中.
3) 培养基的优化.选择麦麸(A)、(NH4)2SO4(B)、CaCl2(C)、ZnSO4·7H2O(D)、MgSO4·7H2O(E)、KH2PO4(F)因素,4水平对液体发酵培养基进行优化,因素水平变化(见表1).固定菌悬液的接入量为3%,发酵温度为30 ℃,摇床的震荡速率为130~150 r/min,发酵时间为84 h.参照文献[9-10],分别取1 mL 发酵液于10 mL比色管中,加入1 mL 0.5%水杨素(溶于pH 4.6, 0. mol/L HAc 缓冲溶液),在50 ℃下水浴保温30 min后,加入 1.5 mL DNS试剂,沸水浴5 min,冷却至室温后用蒸馏水定容,在540 nm处测定吸光值.
4) 发酵条件的优化.通过正交试验,选择温度(A)、摇床的震荡速率(B)、装液量(E)、接种量(D)及发酵时间(C)5因素,4水平进行发酵条件的优化,因素水平变化(见表2).

表1 液体发酵培养基正交试验因素水平变化 %

表2 液体发酵条件正交试验因素水平变化
1.2.3 栀子蓝色素制备条件的优化
选择栀子苷的质量浓度(D)、装液量(B)、震荡速率(A)、加味精前的反应时间(C)4因素3水平进行正交试验对栀子蓝色素的制备条件进行优化,因素变化见表3.参照文献[5,11-12],反应温度为 50 ℃,味精的添加量为栀子苷质量的0.7倍,加发酵液水解时间为6 h,发酵液的添加量 ∶栀子苷的质量为2(V∶m).通过反应液中栀子蓝的色价与反应所需栀子苷的浓度比值对正交实验进行分析.
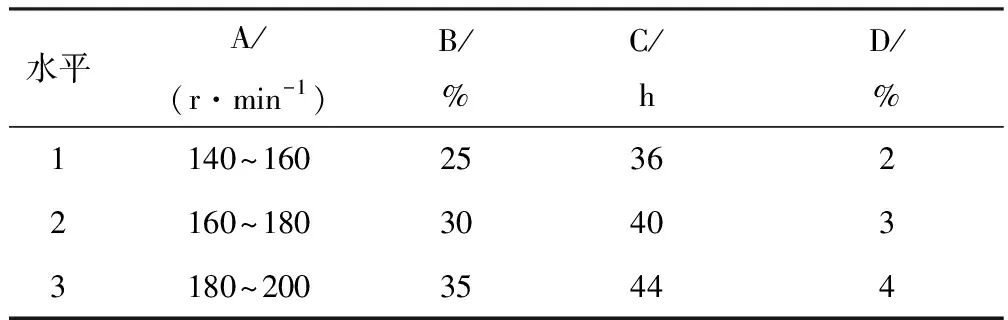
表3 栀子蓝制备条件正交试验因素水平变化
1.2.4 栀子蓝色素的精制
称取16份10.64 g栀子苷于4个500 mL三角瓶中,分别加水稀释到140 g,每瓶中加入1.2.2中的发酵液9.8 mL,在50 ℃的恒温摇床内,160~180 r/min的震荡速率下反应6 h,各加入3.15 g味精,继续反应40 h,取出放入80 ℃的恒温水浴中30 min,反应液合并过滤,得 2 321.5 g滤液,取其中220.00 g在60 ℃和60~70 kPa真空度下浓缩,60~70 ℃和60~70 kPa真空度下干燥得到10.72 g栀子蓝色素A(精品).向32 mm×400 mm的层析柱中加入处理好的200 mL DM-2大孔树脂,加入350.0 g栀子蓝滤液,先用400 mL水洗脱,然后用300 mL 65%的乙醇溶液进行脱液.65%的乙醇洗脱液减压浓缩、干燥得精制栀子蓝色素8.10 g,在594.0 nm处测定栀子蓝色素的吸光度.
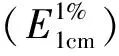
(1)
1.2.5 栀子蓝色素清除DPPH·能力的测试
参照文献[13],分别取3.0 mL不同质量浓度的栀子蓝色素的30%乙醇溶液,与5.0 mL 0.065 mmol/L DPPH·的50%乙醇溶液均匀混合,避光放置20 min,在517 nm处测定其吸光度的变化,以BHT为阳性对照,DPPH·清除率(Kp) 计算方法如下:
Kp=[1-(As-Ar)/A0]×100% .
As为加样品溶液时的吸光度,A0为用30%乙醇替代样品溶液时的吸光度,Ar为用50%乙醇替代DPPH·溶液时的吸光度,重复测定3次,取其算术平均值.
2 结果与分析
2.1 发酵液制备条件的优化
2.1.1 液体发酵培养基的优化
液体发酵培养基正交试验分析结果见表4~5.由表4~5可以得出,极差值R的大小为麦麸(A)> (NH4)2SO4(B)和KH2PO4(F)>MgSO4·7H2O(E)>CaCl2(C)>ZnSO4·7H2O(D),最佳配方为3%麦麸,0.3%(NH4)2SO4,0.02% CaCl2,0.6%KH2PO4,0.01 %MgSO4·7H2O,0.01 %ZnSO4·7H2O.以此条件做验证实验,测得吸光值为0.476,进一步证实该配方为最优配方.

表4 液体发酵培养基正交试验L16(46)设计方案及结果
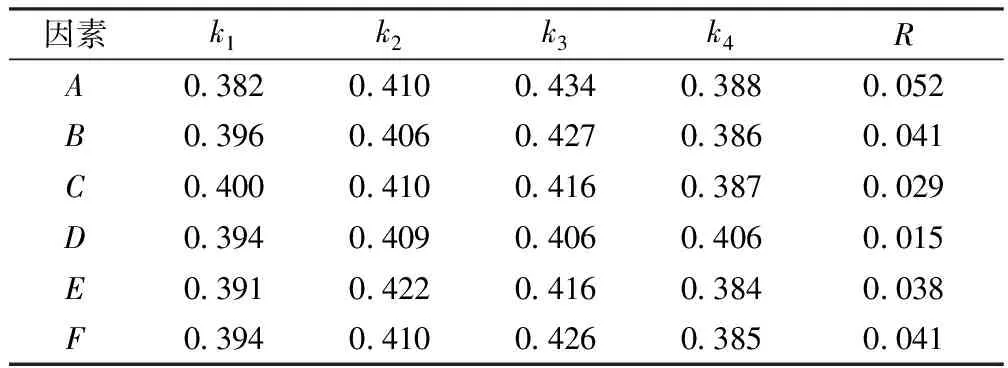
表5 液体发酵培养基正交试验L16(46)极差分析
2.1.2 发酵条件的优化
发酵条件正交试验分析结果见表6~7.由表6~7可知,极差值R的大小为装液量(E)>震荡速度(B)>温度(A)>发酵时间(C)>接种量(D).最佳发酵条件为发酵温度30℃,震荡速率130~150 r/min,装液量为30 mL,接种量3%,发酵时间96 h.以此条件做验证实验,测得吸光值为0.511,进一步证实该发酵条件为最优条件.
2.2 栀子蓝色素制备条件的优化
栀子蓝制备条件正交试验分析结果见表8~9.由表8~9可知,极差值R的大小为震荡速率(A)>加液量(B)>味精的反应时间(C)>栀子苷的质量浓度(D).最佳条件为震荡速率160~180 r/min,加液量为30%,味精反应时间40 h,栀子苷浓度3%,以此条件做验证实验,栀子蓝的色价与反应所需栀子苷的浓度的比值为150.10,进一步证实该制备条件为最优条件.

表6 液体发酵条件正交试验L16(45)分析结果

表7 液体发酵条件正交试验L16(45)极差分析
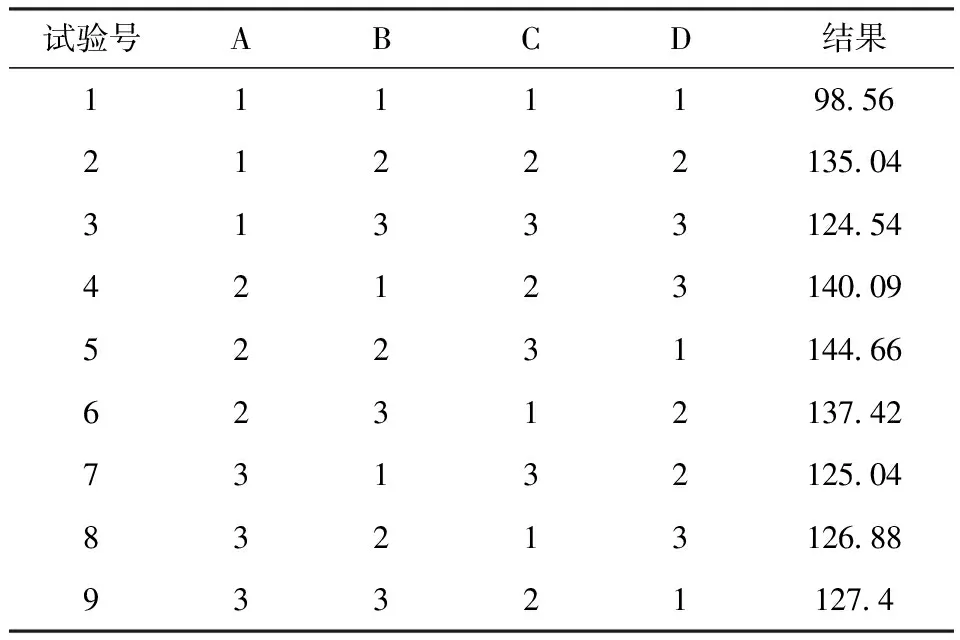
表8 栀子蓝色制备条件正交试验L9(34)分析结果
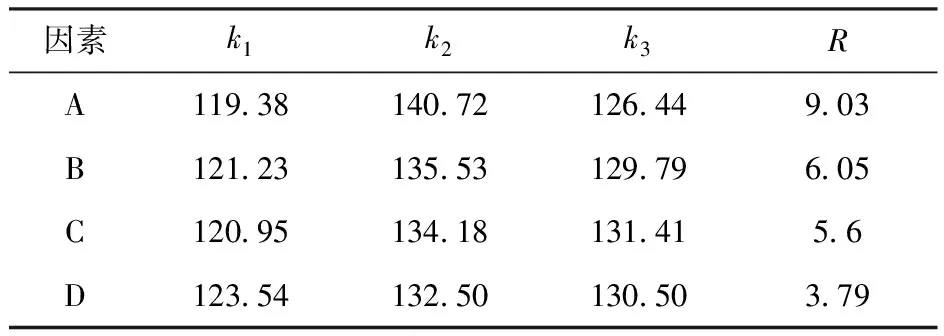
表9 栀子蓝色制备条件正交试验L9(34)极差分析
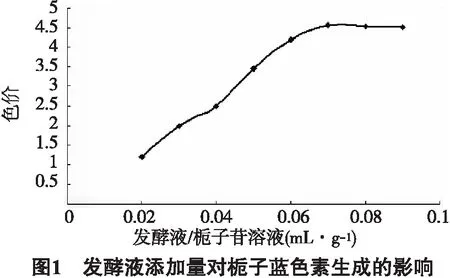
2.3 发酵液添加量对栀子蓝色素生成的影响
按上述制备条件对发酵液的添加量进行优化,发酵液添加量对栀子蓝色素生成的影响(见图1).由图1可知,发酵液的最优添加量为0.07mL/g.
2.4 栀子蓝色素的精制
采用DM-2大孔树脂层析柱对栀子蓝色素粗品进行精制.精制前栀子蓝色素粗品的色价为90.56,经过大孔树脂精制后,栀子蓝色素的色价提高到180.01,得率为90.96%.
2.5 栀子蓝色素清除DPPH·能力
DPPH·是一种人工合成的稳定自由基,分子结构中含有3个苯环,1个N原子上有1个孤对电子,其乙醇溶液呈紫色,经波长扫描,体系的最大吸收波长在517 nm处,因此,实验选择517 nm为测定波长.按照1.2.5的测定方法,测得在波长517 nm 处的吸光度越小,样品清除DPPH·能力越强,样品的抗氧化能力越强.因而测定试样对DPPH·清除率可用于简便、准确地评价其抗氧化能力.图2是DPPH·法测定栀子蓝色素的抗氧化能力实验结果.图2表明,栀子蓝色素粗品A及精制品B对DPPH·具有较好的清除能力,清除率随样品浓度的增加而增大,且栀子蓝色素精制品B的DPPH·清除能力比栀子蓝色素粗品A的强(栀子蓝色素A和B的EC50分别为43.5 μg·mL-1和37.5 μg·mL-1).

3 结语
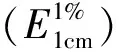
参考文献:
[1] 国家药典委员会.中华人民共和国药典(一部)[M]. 北京:化学工业出版社, 2005:173.
[2] 中国医学科学院. 中药志Ⅲ[M]. 北京:人民卫生出版社,1984:581.
[3] 杨全军, 范明松, 孙兆林, 等. 栀子化学成分、药理作用及体内过程研究进展[J]. 中国现代中药, 2010, 12(9):7-9.
[4] FUJIKAWA, S,FUKUI Y,KOGA K,et al. Brilliant skyblue pigment formation from gardenia fruits [J]. J Ferment technol, 1987(4):419-424.
[5] 凌敏, 焦裕健, 李立明, 等. 高色价栀子蓝色素的制备及其纯化工艺研究[J]. 食品工业科技, 2009,30(9):262-264.
[6] PAIK Y S, LEE C M, CHO M H, et al. Physical stability of the blue pigments formed from geniposide of gardenia fruits:effects of pH, temperature, and light[J]. Journal of Agricultural and Food Chemistry, 2001, 49(1):430-432.
[7] 付学军, 董新伟,,金海珠. 天然色素栀子蓝的稳定性研究[J]. 冷饮与速冻食品工业, 2005,1(1):22-25.
[8] 徐尤智, 梁华正, 陈贺, 等. 高色价栀子蓝色素的制备及其稳定性研究[J]. 现代食品科技, 2011,27(4):440-443.
[9] 吴拾荆, 李华. β-葡苷酶高产株的筛选及在栀子色素制备中的应用[J]. 武汉化工学院学报, 2001,23(3):28.
[10] 赵凯, 许鹏举, 谷广烨. 3, 5一二硝基水杨酸比色法测定还原糖含量的研究[J]. 食品科学, 2008,29(8):534-536.
[11] 梁华正,乐长高, 廖晓峰. 京尼平甙水解物与谷氨酸钠反应生成栀子蓝色素最佳条件的研究味精[J]. 食品工业科技, 2003, 25(7):110-112.
[12] 杨志, 张芳, 李梅, 等. 栀子蓝色素制备及纯化工艺的研究[J]. 现代食品科技, 2008,24(4):352-356.
[13] 郑德勇, 安鑫南.竹叶提取物清除DPPH自由基的测定方法[J]. 福建农林大学学报:自然科学版,2005,34(1):59-61.

