3830电极在右室间隔起搏的临床应用
张春亮 曹清涛 王怀新
自1958年第一台永久心脏起搏器置入成功后[1],其在临床得到了广泛应用,目前它已成为多种心脏病重要的诊治方法。右室心尖部起搏作为治疗严重心动过缓性心律失常的一种可靠方法应用于临床,但随着对心脏起搏认识的深入和临床实践的发展,传统右室心尖部起搏对心脏结构和功能的不良影响逐渐被认识和关注。右心室心尖部起搏,心肌激动顺序背离生理状态,导致左、右心室收缩不同步,继而产生有害的血流动力学反应,如起搏综合征、心室重构和心功能不全等[2~5]。随着近年主动固定螺旋电极的问世,国内外先后进行了直接希氏束,右心室流入道间隔部,右心室流出道间隔部,右心室心尖部和右心室漏斗部间隔部等多部位的起搏研究,主要是为了寻找最佳的心脏起搏部位,结果不完全一致。而右室中位室间隔部起搏可以获得类似于生理性房室传导的心室激动顺序,对左心功能的影响较小,被认为是最佳的起搏部位之一[6]。本文通过观察应用Medtronic公司最新、最细的3830 实心电极对右室高位室间隔部和中位间隔部起搏对QRS时限、血BNP、LVEF影响,来探讨更优的心室起搏部位。
1 资料与方法
1.1一般资料 选取2012年1月~2013年6月期间在本院因病态窦房结综合征、高度房室传导阻滞及Ⅲ度房室传导阻滞行DDD型或DDDR型永久性心脏起搏器植入术的71例患者,所有患者均符合2008 年ACC/ AHA/HRS 起搏器植入的Ⅰ类或Ⅱa类适应证。根据心室起搏电极植入部位的不同,随机分为右室中位室间隔起搏组(36例)和右室高位室间隔起搏组(35例),术前患者均无临床显性心功能不全,纽约心功能分级(NYHA)Ⅰ~Ⅱ级。排除标准:① 术前临床上有显性心功能不全的症状,心脏超声提示左室射血分数(LVEF)<0.5的患者;② 持续性心房颤动、心房扑动、房性心动过速、频发室性早搏、室性心动过速等严重心律失常患者;③不稳定型心绞痛、先天性心脏病、各种类型心肌病、高血压性心脏病;④ 其他严重心、脑、肝、肾及风湿免疫等慢性疾病及肿瘤患者;⑤起搏器植入术前QRS波群时限>120 ms。35例右心室高位室间隔起搏组,男19例,女16例,年龄42~76岁[平均年龄(56.2±10.4)岁],其中DDD型15例,DDDR型20例;36例右心室中位室间隔起搏组,男21例,女15例,41~75岁[平均年龄(55.9±10.7)岁],其中DDD型16例,DDDR型20例。两组患者在起搏器置入前年龄、性别、QRS波时限、左心室射血分数(LVEF值)、血BNP等方面差异无统计学意义。见表1,3。
1.2实验方法
1.2.1起搏电极植入方法 常规经左锁骨下静脉或腋静脉途径,穿刺成功后送Select Site 鞘管进入右室。撤除导引导丝和扩张鞘,肝素水冲鞘后,插入Medtronic3830固定于右室间隔部, X线透视下确认导线头端固定,测试参数满意,10V 高压起搏无膈肌起搏,切开撤出输送鞘管,缝线固定导线。右室高位室间隔部定位方法:左前斜40°确定电极头端与心室间隔部呈垂直位(电极头端指向脊柱缘);后前位肺动脉瓣与三尖瓣之间,大约距离心影底部2个椎体以上。中位间隔部定位方法:同样左前斜40°确定电极头端与心室间隔部呈垂直位;后前位在三尖瓣与心尖部之间,大约距离心影底部0.5~2个椎体之间。
1.2.2起搏参数的测定 在起搏器电极置入5 min后分别测定起搏阈值,感知功能及阻抗,3个月后重复测试上述前3个参数并判断有无电极脱位、感染。
1.2.3其他观察参数 术前常规做心电图测定QRS波时限,先行12导联常规心电图检查,采用手工方法,每个导联选择一个起点和终点比较清晰的QRS波群对其时限进行测量,然后计算出12个导联QRS波群时限的平均值作为该患者的QRS波群时限。以Philip IE 33 型超声多普勒仪,测量左室射血分数(LVEF),连续测量3次取平均值。抽取外周静脉血1 ml, 乙二胺四乙酸(EDTA)抗凝, 应用美国美德声科学技术公司干式快速定量心力衰竭诊断仪, 荧光免疫法测定血浆脑钠肽 (BNP)。术后3个月起搏器复查时重复测定上述参数。

2 结果
两组患者在术中及术后3个月起搏阈值、阻抗、感知相比较差异无统计学意义,均未出现电极脱位、感染等,见表2。右心室中位室间隔起搏组QRS波宽度明显窄于右心室高位室间隔起搏组[(116±23.6)ms VS(150±34.2)ms,P<0.05]。中位室间隔组术前及术后3个月LVEF、BNP无显著改变,高位室间隔组术前及术后3个月LVEF降低[(0.46±0.12%)VS(0.62±0.07)%,P<0.05]、BNP升高[(161.3±34.2)ng/L VS(80.1±33.2)ng/L,P<0.05],差异有统计学意义,见表3。

表1 两组患者基本资料比较
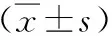
表2 两组术中及术后三个月参数
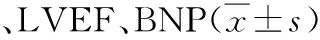
表3 两组术前及术后QRS波时限
注:组内比较aP<0.05,组间比较bP<0.05
3 讨论
永久起搏器是治疗缓慢性心律失常的有效方法,在临床永久性心脏起搏器的导线植人术中, 右心室心尖部是一种传统的起搏位点,由于导线容易到位,技术学习曲线较短,故一直被沿用至今,然而这种位点存在较多弊端。右心室心尖部起搏时电脉冲由心尖部向室间隔逆行传导,而左心室大部分是经由心肌传导,除极速度较慢,形成左心室心肌本身和右心室心肌除极不同步,心电图QRS波明显增宽。室间隔、心尖部与左心室后壁呈反常运动,整个心脏丧失了整体协调性,对血流动力学多方面的负面影响,导致LVEF下降,长期的右心室心尖部起搏可以损害左心室功能,降低心肌灌注,增加组织儿茶酚胺并导致左心室心肌的组织学异常。理想的心室起搏应当接近正常的激动顺序及保持较好的心脏同步性。大量研究显示起搏所致的心室间和心室内电和机械活动的不同步可能是心脏结构和功能发生改变的基本原因[5]。直接希氏束起搏因电极植入过程复杂,需要对希氏束电位进行标测,准确定位困难,并且起搏阈值不稳定,部分患者出现起搏失败,安全性较差,所以在临床上难以广泛应用[7]。室间隔起搏由于起搏点距离希氏束较近,起搏电流能够部分通过正常的传导系统迅速激动左右心室,具有改善心室间电及机械活动同步性的潜在优势[8]。但目前中位与高位室间隔起搏对心脏结构和功能的影响是否有区别尚不明确。右室中位室间隔起搏,因电极植入过程简单,阈值稳定,安全可靠,并且起搏部位距离希氏束较近,可能具有改善心室间和心室内电及机械活动的同步性,减少对心脏结构和功能不良影响的潜在优势,因而右室中位室间隔成为目前研究最多的起搏的替代部位。
起搏的安全性和可靠性关系着患者的生命安全,因此起搏的安全性和可靠性进行系统评价至关重要。同国外研究相似[9]本研究发现,右心室中位室间隔起搏与右心室高位室间隔起搏在起搏阈值、感知及阻抗、电极脱位率方面均无显著性差异。无论高位间隔还是中位间隔只要参数满意即可固定,两处部位起搏均能获得良好的起搏参数。
QRS波的宽度反映心室电除极的时程和离散度,而电除极的离散度与心肌机械活动密切相关,QRS波越宽大畸形,心室等容收缩时间越长,总收缩时间越短,则充盈时间相对缩短,导致心室收缩功能下降,而右室起搏增宽的QRS波后半部由左室除极形成,导致左室除极比右室滞后20 ms以上,这样左右心室电激动顺序改变及同步性下降对心功能产生不利影响,心脏的电活动和机械活动是藕联在一起的,当心室的除极顺序和时间发生异常时,必然造成心室间和心室内机械活动的异常,进而影响心脏的功能和结构。同国外研究资料相同[10,11],作者发现右室中位室间隔起搏QRS波时限较右室高位室间隔起搏明显缩短。 LVEF及BNP是观察心功能变化的可靠指标[12],右心室中位室间隔起搏组术后BNP及LVEF未出现明显改变,提示右心室中位室间隔起搏起搏未对左心功能产生负性影响,无或有较少的神经内分泌系统的激活,对心功能的影响较小,是较理想的起搏部位。
综上所述,作者的研究表明,Medtronic3830电极右室中位室间隔起搏由于更接近生理激动顺序, 心电图QRS宽度明显变窄、接近正常QRS波宽度,更利于左右心室的同步收缩,使血流动力学更接近生理状态,对心功能无明显恶性影响。Medtronic3830电极作为目前最细的实心双极起搏电极,与传统的螺旋电极以及被动电极相比,理论上可以减少挤压综合征、三尖瓣返流、静脉血栓形成的发生率,可以减轻囊袋负担,也有利于今后病情需要时电极的拔除[13]。本文对3830电极在室间隔起搏做出初步的探讨,更详细的资料有待多中心研究进一步完善。
[1] Furman S, Schwedel J. An intracardiac pacemaker for Stokes-Adams seizures.N Eng J Med,1959(261):943-8.
[2] Nahlawi M, Waligora M, Spies SM,et al. Left ventricular function during and after right ventricular pacing. J Am Coll Cardiol,2004(44):1883-8.
[3] Sweeney MO, Hellkamp AS. Heart failure during cardiac pacing. Circulation,2006(113):2082-2088.
[4] Sweeney MO, Hellkamp AS, Ellenbogen KA,et al. Adverse effect of ventricular pacing on heart failure and atrial fibrillation among patients with normal baseline QRS duration in a clinical trial of pacemaker therapy for sinus node dysfunction. Circulation,2003(107):2932-2937.
[5] Tops LF, Schalij MJ, Bax JJ. The effects of right ventricular apical pacing on ventricular function and dyssynchrony. J Am Coll Cardiol,2009(54):764-776.
[6] Rosso R, Medi C, Teh AW,et al. Right ventricular septal pacing: a comparative study of outflow tract and mid ventricular sites. PACE,2010(33):1169-73.
[7] Deshmukh P, Casavant D, Romanyshyn M,et al. Permanent direct Hisbundle pacing: a novel approach to cardiac pacing in patients with normal His-Purkinje activation. Circulation,2000(101):869-877.
[8] Laske TG, Skadsberg ND Hilll AJ, et al. Excitation of the intrinsic conduction system through his and interventricular septal pacing. Pacing Clin Electrophysiol,2006(29):397-405.
[9] Kypta A,Steinwender C,Kammler J,et al.Long-term outcomes in patients with atrioventricular block undergoing septal ventricular lead implantation compared with standard apical pacing.Europace,2008,10(5):574-579.
[10] Muto C, Ottaviano L, Canciello M,et al. Effect of pacing the right ventricular mid-septum in patients with permanent atrial fibrillation and low ejection fraction. J Cardiovasc Electrophysiol,2007(18): 1032-1036.
[11] Cano O,Osca J,Sancho-Tello M,et al.Comparison of effectiveness of right ventricular septal pacing versus right ventricular apical pacing.Am J Cardiol,2010,105(10) : 1426.
[12] Ichiki H, Oketani N, Hamasaki S,et al.Effect of right ventricular apex pacing on the Tei index and brain natriuretic peptide in patients with a dual-chamber pacemaker. Pacing Clin Electrophysiol,2006(29):985-90.
[13] Khan A, Zelin K, Karpawich PP. Performance of the lumenless 4. 1-Fr diameter pacing lead implanted at alternative pacing sites in congenital heart: a chronic 5-year comparison. PACE, 2010,33(12):1467.

