鲜花生的低场核磁共振横向弛豫分析*
李潮锐, 刘 青, 杨培强
(1. 中山大学物理科学与工程技术学院,广东 广州 510275;2. 广东检验检疫技术中心食品实验室, 广东 广州 510623;3. 纽迈电子科技有限公司, 上海 200333)
低场1H-核磁共振弛豫分析及其成像技术在农业、医药和生物材料等领域有着潜在的广阔应用前景,也是当前食品质量研究的热门课题[1-6]。传统强磁场核磁共振波谱方法可以获得物质分子结构信息[7-11],但低场核磁共振弛豫谱却可以有选择地关注由于受激处于激发态粒子寿命从而分析被测对象主要组分的物理性质。特别是,利用1H-核磁共振弛豫可以有效地测量食品中水和油脂等组分[12-23],实现无损、快速、无侵入式实时食品监测。
利用1H-核磁共振弛豫技术准确检测主要组分的关键前提是建立核磁共振弛豫谱与被测对象组分的对应关系,即解决核磁共振弛豫谱的标识问题。本工作仅以鲜花生为研究对象,探讨1H-核磁共振弛豫技术的油料作物种子(主要)组分检测分析方法,并标识花生的核磁共振横向弛豫谱。花生中脂肪、蛋白质、碳水化合物和水的-H基是产生1H-核磁共振吸收的物理基础,由于各种组分原子的局域场及其内部相互作用机制不同,它们所产生的共振吸收频率(化学位移)及对应的寿命(弛豫时间)也不相同。本工作以后者为依据,通过测量分析脱水过程鲜花生1H-核磁共振弛豫谱变化并与纯花生油的实验结果比较,确定花生核磁共振横向弛豫谱归属。基于单位质量干燥花生和花生油两者的脂肪弛豫谱峰面积之比,进而直接获得花生含油率。
1 测量技术方法
使用赛多利斯科学仪器有限公司DENVER TP-114分析天平测量样品质量。通过RS-232接口使天平与计算机连接,实现质量实时测量和数据采集分析处理。为了较准确观测记录花生质量及其质量变化率,实验中既要保证样品周围空气对流促使蒸发及时排放,又必须消除空气对流对测量的干扰。为此,实验测量时将分析天平置于多处开孔的长方体外罩中,且实验测量过程分析天平两侧门保持全开状态便于空气对流。分析天平记录质量变化的采样时间间隔约64 s,测量系统置于湿度约50%和温度约25°实验室环境。
使用上海纽迈电子科技有限公司MicroMR-18核磁共振成像分析仪测量样品的核磁共振弛豫谱。实验主磁场强度约0.51 T,其对应共振频率在22.5 MHz附近,样品室温度(32.00±0.01)℃。采用CPMG(Carr-Purcell-Meiboom-Gill)方法测量横向弛豫,实验参数:采样率50 kHz,射频脉冲间隔500 μs,重复采样时间间隔3 000 ms;根据样品实际情况,重复采样次数10或20,回波个数设置为2 000。每次重复采样都通过设备自动测量自由感应衰减信号(FID,即Free Induction Decay)以调节样品的共振中心频率,从而消除磁场强度漂移所引起实验系统误差。选用核磁共振成像分析仪配套的反演软件进行连续谱迭代分析,运算参数:开始时间10 ms,截止时间1 000 ms,参与反演点数500,弛豫时间点数400,迭代次数1 000 000。
首先测量实验用鲜花生总量的质量,分别将其分为若干平行样进行核磁共振测量;实验完毕,再次测量该批平行样的总质量;由这2次测量所得质量的平均值表示该样品进行核磁共振测量时的总量质量。通过软件(可批量)获取每样品单次采样的核磁共振弛豫测量原始数据,随之对平行样实验数据累加结果进行反演分析。
鲜花生和金龙鱼花生油分别购自农贸市场和超市。鲜花生完全暴露于湿度约50%和温度约25 ℃的实验室环境自然干燥,适时测量花生质量及该时刻的核磁共振横向弛豫。直至最后3次(每次间隔约48 h)测量花生质量相对变化量小于0.05%(恒重),从而可以认为此时样品已处于完全脱水状态。
2 结果及分析
图1为鲜花生置于多孔外罩中自然干燥过程(a)质量及其(b)质量变化率随时间变化规律,后者是由前者对时间微分所得。实验结果表明,花生干燥过程中质量随时间单调减少,且质量变化率(趋势)逐渐缓慢,直至质量变化率接近零。
尽管由于存在一定程度的对流限制使置于多孔外罩中花生干燥进程比完全暴露于实验室环境要缓慢些,但上述实验结果已基本反映出它的质量变化规律:初始时,质量变化率较大;随之,质量变化率逐渐减小。由此可见,为了准确观测花生的核磁共振弛豫过程,必须采用先密后疏的测量时间间隔和先快后(可)缓的采样方法。事实上,初始时样品整体信号很强,可以减少重复采样次数,从而达到快速测量的目的;随之,样品组分信号渐弱,可适当增加采样次数,提高测量信噪比。这些结果不仅为确定核磁共振弛豫测量步骤和参数设置提供依据,同时也从后续核磁共振实验中得到进一步证实。利用上述实验结果,根据质量变化率或(相对)变化量均可确定合理的核磁共振弛豫测量的时间间隔,从而准确地记录花生干燥过程组分变化信息。
图2为通过MicroMR-18配套的反演软件进行连续谱迭代分析所得鲜花生在干燥过程不同质量时核磁共振横向弛豫谱,图中横坐标为弛豫时间而纵坐标则为对应信号强度,谱峰面积代表了组分共振吸收信号强度。图2(a)和(d)分别为鲜花生初始时和完全脱水状态的实验结果;(b)和(c)为干燥过程处于不同质量时的横向弛豫谱。根据图1所示的实验结果,在实验室环境中当失重达约30%时花生进入缓慢的自然干燥过程。直至最后间隔约48 h的3次测量花生质量相对变化量小于0.05%,此时认为样品已处于完全脱水状态;图2(d)即为最后获得的花生横向弛豫实验结果。图中(a)、(b)和(c)通过纵坐标平移更清晰地显示它们之间的差异,但保持相同的坐标尺度。
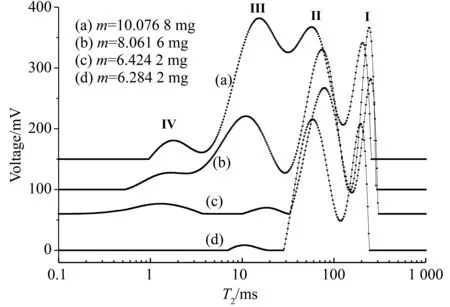
图2 干燥过程鲜花生核磁共振横向弛豫谱Fig.2 NMR transverse relaxation spectrum of peanut with hydrogenation
由图2(d)到(a)的变化过程可以看出,鲜花生在脱水过程中基本存在4个横向弛豫谱峰。显然,除了图2(d)完全脱水花生主要组分脂肪外,其它状态还应该存在水或其它-H基的响应。除了脂肪,鲜花生主要成分还含有蛋白质、碳水化合物和水,这些组分中不同-H基的原子局域场及其相互作用机制不同。从物理角度,这些蛋白质、碳水化合物和水的-H基相关的能态不同且各有不相等的弛豫时间(和化学位移)。因此,对于非完全脱水鲜花生1H-核磁共振横向弛豫谱必然存在多于4种组分的响应。
图2(a)-(c)实验结果表明,干燥过程中鲜花生的核磁共振弛豫峰数量没有发生改变,但是所有谱峰面积却明显地随花生脱水而变化。图3显示了干燥过程鲜花生核磁共振横向弛豫谱总面积与花生质量的关系。由图可见,随着脱水进程花生中的水组分逐渐减少,花生弛豫谱峰面积随之单调减小,同时也伴随着脂肪弛豫谱峰逐次清晰。可以认为,鲜花生蛋白质、碳水化合物和水的核磁共振横向弛豫时间与脂肪的结果很接近(或甚至重叠),致使它们的弛豫谱峰部分(或完全)地交迭在一起,反演迭代分析难以将它们分离,从而也说明图2(a)-(c)干燥过程只能观测到谱峰面积变化而不能直接记录到谱峰数量改变。上述分析可知,核磁共振弛豫同步测量脂肪和水的分析方法不适应于鲜花生[24-25]。
由图3可见,在湿度约50%和温度约25 ℃的实验室环境自然干燥过程,质量变化反映了鲜花生中水分子蒸发,而相应的横向弛豫峰面积也随之减小,从而也说明核磁共振弛豫技术可以很有效地检测鲜花生中水组分。当处于完全脱水(恒重)状态时,弛豫谱主要反映了花生脂肪中-H基的贡献。
图4的实验结果直观地给出了问题的答案,图中(a)和(b)纵坐标相对平移。根据金龙鱼花生油标称成分,可以认为图4(a)中谱峰I、II和III归属于花生油饱和脂肪、单不饱和脂肪和多不饱和脂肪的1H-核磁共振横向弛豫。尽管弛豫谱峰与各种脂肪之间的对应关系需要进一步通过改变脂肪酸组分比例才能作出定量分析,但是对比图4(a)和(b)结果已可推断鲜花生也含有这3种脂肪酸。已报道的研究结果显示利用脉冲NMR技术所测得油料种子作物含油量与传统索氏抽提法测量结果或样品实际油量都具有很好的线性相关[26-28],而本工作则可以通过每克干燥鲜花生和纯花生油的脂肪核磁共振横向弛豫谱峰面积比方法,直接获得图4所示的鲜花生样品含油率为47.22%。
对其它10个不同批次鲜花生样品的核磁共振弛豫分析都得到相同实验结果。由单位质量干燥花生和纯花生油两者的脂肪弛豫谱峰面积之比,可以得到全部样品的含油率范围为46.91%~51.09%,整体平均值为49.08%。上述结果表明,采用脂肪弛豫谱峰面积比方法与经典索氏抽提法所得测量结果吻合[29-30]。
3 结 论
鲜花生中脂肪、蛋白质、碳水化合物和水的-H基是产生1H-核磁共振弛豫谱的物理基础,而这些物质中原子相互作用差异导致它们的共振吸收弛豫时间(寿命)不同。实验采用CPMG方法获得鲜花生核磁共振横向弛豫谱,样品中脂肪、蛋白质、碳水化合物和水对1H-核磁共振响应构成了花生的弛豫谱整体。为了识别这些组分所对应的共振弛豫谱峰,通过实验室环境自然干燥逐步蒸发鲜花生中水分子,而准确记录花生脱水过程质量随时间变化提供了样品处理依据。随着脱水进程样品中的水组分逐次减小,样品的脂肪弛豫谱峰也逐渐清晰。由弛豫谱峰总面积与花生质量关系分析了样品水份蒸发物理过程,可以认为,鲜花生中蛋白质、碳水化合物和水与脂肪的核磁共振弛豫谱部分(或完全)交迭。利用纯花生油实验数据确认了鲜花生样品饱和脂肪、单不饱和脂肪和多不饱和脂肪的核磁共振横向弛豫谱峰。在相同实验条件下,基于单位质量干燥花生和纯花生油两者的脂肪弛豫谱峰面积之比,可以得到11个不同批次鲜花生样品的整体平均含油率为49.08%,它与索氏抽提法测量结果吻合。
研究结果表明,鲜花生中蛋白质、碳水化合物和水与脂肪的核磁共振弛豫时间很接近(或甚至重叠)而无法同步独立地测量水和脂肪共振弛豫响应,因此对于非完全脱水样品不能获得纯脂肪弛豫谱。为了得到鲜花生脂肪核磁共振信息,本研究通过长时间实验室环境自然干燥并采用恒重法确认样品处于完全脱水状态,从而也提高花生含油率的测量分析准确性。
[1] 阮榕生. 核磁共振技术在食品和生物体系中的应用[M]. 北京: 中国轻工业出版社, 2009.
[2] 夏天兰,刘登勇,徐幸莲,等. 低场核磁共振技术在肉与肉制品水分测定及其相关品质特性中的应用[J]. 食品科学, 2011, 32(21):253-256.
[3] 周 凝,刘宝林,王 欣. 核磁共振技术在食品分析检测中的应用[J]. 食品工业科技, 2011, 32(1):325-329.
[4] 顾小红,任璐,陈尚卫, 等. 核磁共振技术在食品研究中的应用[J]. 食品工业科技,2005, 26(9):189-194.
[5] 杨赫鸿,李沛军,孔保华,等. 低场核磁共振技术在肉品科学研究中的应用[J].食品工业科技,2012,33(13):400-405.
[6] ANGÉLIQUE M, MIREILLE C, ALAIN R, et al. Fat globule membrane composition on water holding capacity and water mobility in casein rennet gel: A nuclear magnetic resonance self-diffusion and relaxation study [J]. International Dairy Journal, 2006,16(4):344-353.
[7] 张倩芝, 陈晓红, 陈 建. 有机波谱法在α-二甲基苄基酚聚氧乙烯醚的结构确证中的应用[J]. 中山大学学报:自然科学版, 2011, 50: 141-143.
[8] 赵小菁,张丽影,刘宝全, 等. 氨基酸希夫碱及其金属锌配合物的合成及表征[J]. 中山大学学报:自然科学版, 2011, 50: 70-73.
[9] 程 悦, 严志勇, 卢嘉丽,等. 高速逆流色谱分离制备苦茶中的苦茶碱[J]. 中山大学学报:自然科学版, 2010, 49(3): 65-69.
[10] 李春燕,陆 羽,陈 烨,等. 环草石斛化学成分研究[J]. 中山大学学报:自然科学版, 2013, 52(3): 73-76.
[11] 钱 浩, 祝亚非, 许家瑞. 聚乙烯-醋酸乙烯醋接枝聚乙二醇共聚物的合成及结构表征[J]. 中山大学学报:自然科学版, 2003, 42: 30-34.
[12] 吴 烨,许 柯,徐幸莲,等. 低场核磁共振研究pH值对兔肌球蛋白热凝胶特性的影响[J]. 食品科学, 2010, 31(9):6-11.
[13] 李 玫,李苗云,赵改名,等. 冻融循环下鸡肉品质变化的低场核磁共振研究[J]. 食品科学, 2013, 34(11):58-61.
[14] 樊海涛,刘宝林,王 欣,等. 乳化剂对冷冻面团水分状态和玻璃化转变温度的影响[J]. 食品科学, 2012, 33(17):10-14..
[15] 吴酉芝,刘宝林,樊海涛. 低场核磁共振分析仪研究添加剂对冷冻面团持水性的影响[J]. 食品科学, 2012, 33(13):21-25.
[16] 钱菲,张锦胜,金志强,等. 核磁共振技术对食品玻璃化及玻璃化转变温度的研究[J]. 食品科学, 2008, 29(8):666-669.
[17] MIKLOS R, MORA-GALLEGO H, LARSEN F H, et al. Influence of lipid type on water and fat mobility in fermented sausages studied by low-field NMR [J]. Meat Science, 2014,96(1):617-622.
[18] ROBERT L J, IRVIN J L, THOMAS L P, et al. Seed oil and fatty acid composition in Capsicum spp. [J]. Journal of Food Composition and Analysis, 2013,30(2):102-108.
[19] JAMES P C, JUDY S, MANISHA S, et al. Glycerol as a reference material for fecal fat quantitation using low-resolution time domain1H NMR spectroscopy [J]. Clinical Biochemistry, 2011,44(16):1352-1354.
[20] MAZZANTI G, MUDGE E M, ANOM E Y. In situ Rheo-NMR measurements of solid fat content [J]. Journal of the American Oil Chemists Society, 2008, 85(5):405-412.
[21] NICHOLE L K S, JENNIE N W, VIVEK K, et al. Comparative analysis of fecal fat quantitation via nuclear magnetic resonance spectroscopy (1H NMR) and gravimetry [J]. Clinica Chimica Acta, 2009,400(1/2):33-36.
[22] SØRLAND G H,LARSEN P M,LUNDBY F,et al. Determination of total fat and moisture content in meat using low field NMR[J]. Meat Science,2004,66(3):543-550.
[23] BERTRAM H C,WIKING L,NIELSEN J H,et al. Direct measurement of phase transitions in milk fat during cooling of cream—a lowfield NMR approach [J]. International Dairy Journal 2005,15(10):1056-1063.
[24] RUDI T, GUTHAUSEN G, BURK W, et al. Simultaneous determination of fat and water content in caramel using time domain NMR [J]. Food Chemistry, 2008, 106(4):1375-1378.
[25] TODT H, GUTHAUSEN G, BURK W, et al. Water/moisture and fat analysis by time-domain NMR [J]. Food Chemistry, 2006,96(3):436-440.
[26] 宋丹阳, 李培武, 赵永国,等. 脉冲核磁共振仪在大豆含油量测定中的应用[J]. 中国油料作物学报, 2006, 28(2):199-202.
[27] 王晓军. 利用核磁共振技术测定油菜籽含油量的方法研究[J]. 作物学报, 1993, 19(4):289-297.
[28] 朱之美. NH5110核磁共振含油量测定仪在油菜籽含油量测定中的应用[J]. 中国油脂, 1992, 17(3):31-35.
[29] 姜慧芳,段乃雄. 花生品种蛋白质含量、含油量及脂肪酸组成[J]. 作物品种资源, 1994, 13(4):29-30,33.
[30] 山东省烟台地区花生研究所育种组. 几个主要花生品种含油量测定结果[J]. 花生学报,1973,2(4):9.

