小鼠cofilin-1基因及其真核表达载体的构建与体内外表达
李玲玲,张 伟,杜 蕊,宋玲珍,柴学军,胡新德,陈树林,赵善廷
(1 西北农林科技大学 动物医学院,陕西 杨凌 712100;2 Institute of Anatomy and Cell Biology,University of Freiburg,Freiburg 79104,Germany)
运动是生命细胞的基本特征之一。对大多数细胞而言,其运动能力离不开肌动蛋白、肌球蛋白以及一些调节蛋白对微丝和微管的调节作用。肌动蛋白解聚因子(Actin depolymerizing factor,ADF)/Cofilin家系成员之一的丝切蛋白(Cofilin),是普遍存在于真核生物中的一种低分子质量的肌动蛋白结合蛋白,它通过结合和剪切F-肌动蛋白(F-actin),改变F-actin骨架结构,发挥调节细胞定向运动的功能,在细胞趋化、迁移中发挥关键作用[1-4]。Cofilin的活性通过磷酸化、去磷酸化、磷酸肌醇化、pH改变等方式进行调节,其中磷酸化与去磷酸化是Cofilin响应胞内外刺激信号改变最重要的调节方式。Cofilin失活可引发多种疾病,如癌症、阿尔兹海默症、局部缺血性肾病等[5]。
哺乳动物cofilin基因有2种亚型:cofilin-1和cofilin-2,分别编码不同的蛋白。cofilin-1 (cfl1)在多种非肌肉组织中表达,特别是在脑和肝脏中;而cofilin-2主要在肌肉组织中表达。研究发现,ADF-/-敲除小鼠胚胎可以成活[6],并完成正常的胚胎发育,而cfl1-/-敲除小鼠胚胎不能正常成活,胚胎于9.5 d死亡[7]。cfl1-/-脑特异性敲除小鼠的大脑皮层细胞迁移和细胞周期均受到影响,表明在小鼠胚胎发育过程中大脑皮质神经元的迁移离不开cfl1的调节作用[8]。
研究表明,Cofilin N端第3位丝氨酸磷酸化后,使Cofilin无法与肌动蛋白结合,失去解聚功能[9];相反,p-Cofilin去磷酸化使Cofilin活化[10]。第3位丝氨酸突变为S3A可使Cofilin不被磷酸化,始终处于活化状态;S3E或S3D的突变则使Cofilin类磷酸化,Cofilin始终保持失活状态[11]。
体外试验表明,Cofilin过表达[12-13]或Cofilin Ser 3位点点突变可引起细胞运动障碍[14- 15],但Cofilin-1 (Cfl1)及其Ser 3位点磷酸化在神经元迁移中的作用机制仍不清楚。为了进一步研究Cfl1在神经元迁移中的作用机制,本试验以小鼠的cfl1基因为研究对象,经点突变技术,构建Cfl1的野生型、持续活化型和持续失活型真核表达载体,通过细胞转染和mRNA半定量检测,体外观察其表达情况,并利用活体原位电转的方法在鸡胚脊髓神经元中检测其表达情况,现将结果报道如下。
1 材料与方法
1.1 材 料
昆白系小鼠,购自中国人民解放军第四军医大学实验动物中心;种鸡蛋购自陕西杨凌种鸡厂;大肠杆菌感受态细胞Trans5α、克隆载体pEASY-T1 Simple、Trans2K DNA Marker、Trans5K DNA Marker,购自北京全式金生物技术有限公司;限制性内切酶、T4 DNA连接酶、胶回收试剂盒、质粒小提试剂盒,购自Promega公司;Platinum®TaqDNA Polymerase High Fidelity、M-MLV cDNA合成试剂盒、LipofectamineTM2000、Trizol试剂、Rabbit-anti-GFP、Donkey-anti-rabbit-488、Goat-anti-mouse-568,均购自Invitrogen Life Technologies;胎牛血清,购自Hyclone公司;D-MEM/F-12、Opti-MEM,购自Gibco公司;TRITC-conjugated Phalloidin、DAPI,购自Millipore公司;Anti-Myc Tag Monoclonal Antibody,购自Santa Cruz公司。CHO细胞系、pCAG-MCS-myc和pCAG-EGFP载体为本实验室保存;引物合成(PAGE纯化方式)及测序工作由生工生物(上海)有限公司完成。
1.2 小鼠cfl1基因的克隆与分析
1.2.1 小鼠cfl1基因的克隆 根据小鼠cfl1基因的CDS区序列(GenBank序列号NM_007687),用DNAMan软件设计包括整个基因阅读框的特异性引物F/P1和R/P1(表1)。取成年小鼠大脑组织提取RNA,反转录获得总cDNA,以该cDNA为模板进行PCR扩增,PCR反应体系为:2×TaqPCR StarMix 10 μL,F/P1 0.75 μL,R/P1 0.75 μL,cDNA 5 μg,用ddH2O补足25 μL。反应程序如下:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,68 ℃延伸30 s,共32个循环;68 ℃后延伸5 min。将扩增产物经10 g/L琼脂糖凝胶电泳后回收目的条带,与pEASY-T1 Simple载体于室温下连接后,转化大肠杆菌感受态细胞Trans5α,经菌液PCR、酶切及测序鉴定后保留阳性克隆,将其命名为pEASY-T1-cfl1。
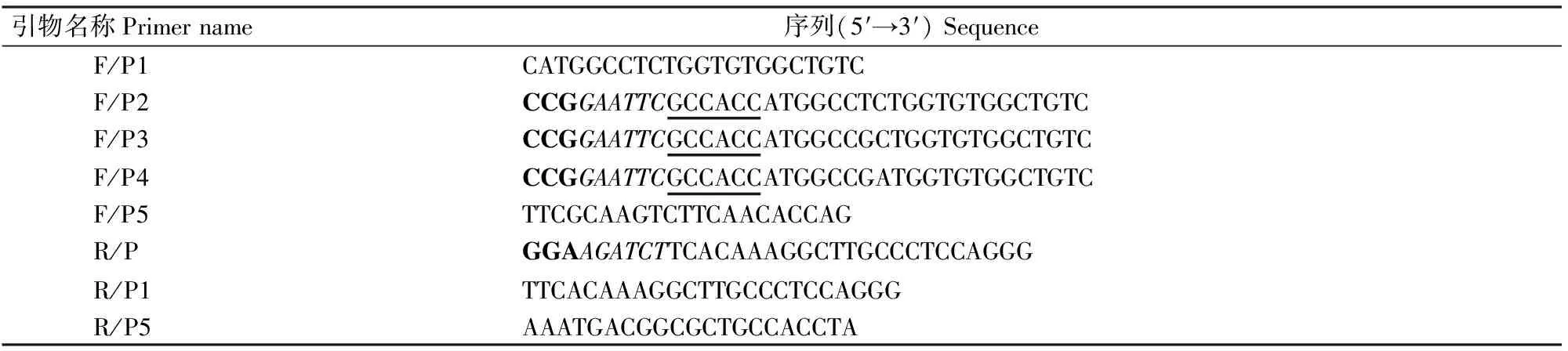
表 1 试验用所引物及其序列
1.2.2 不同物种cfl1基因编码蛋白的生物信息学分析 通过NCBI(Bethesda,MD,USA,http://www.ncbi.nlm.nih.gov/)公共数据库查找不同物种Cofilin蛋白的氨基酸序列,并利用UniPro (http://www.uniprot.org/)获得氨基酸序列的主要结构域和关键位点信息,通过DNAman version 5.2.2 (Lynnon Biosoft Company,USA)进行多序列比对分析。
1.3 cfl1基因真核表达载体的构建
采用经引物引入点突变的方法,参考靶基因cfl1的阅读框,用DNAMan软件设计3条上游引物,依次为F/P2、F/P3、F/P4(表1),分别用于野生型、活化型和失活型Cfl1 3种真核表达载体的构建。F/P2、F/P3、F/P4 3条上游引物的5′端引入EcoRⅠ酶切位点,同时加保护性碱基(Kozak序列)以增强目的片段的转录;下游引物为公用的R/P,其5′端引入BglⅡ酶切位点,同时补加碱基以防止移码突变。以1.2.1节构建的质粒pEASY-T1-cfl1为模板,利用高保真聚合酶进行PCR扩增。用EcoRⅠ和BglⅡ对回收的目的片段和真核表达载体pCAG-MCS-myc双酶切,回收的目的条带经T4 DNA连接酶连接,构建pCAG-cfl1(wt)-myc(pCAG-cfl1-wt)、pCAG-cfl1(S3A)-myc(pCAG-cfl1-S3A)和pCAG-cfl1(S3D)-myc(pCAG-cfl1-S3D)3种真核表达载体(图1)。转化大肠杆菌感受态细胞Trans5α,经菌液PCR、EcoRⅠ/BglⅡ双酶切及测序鉴定后保留相应阳性克隆。
1.4 小鼠cfl1在细胞中表达的半定量分析
1.4.1 细胞培养及转染 将CHO细胞接种到含体积分数10%胎牛血清和青链霉素 (100 U/mL 青霉素、100 U/mL 链霉素)的DMEM/F12((DMEM与F12体积比为1∶1)培养基中,将培养皿置于37 ℃、体积分数5%的CO2培养箱中培养,当细胞融合度达到70%~90%时,参照LipofectamineTM2000的使用说明,用pCAG-MCS-myc、pCAG-cfl1-wt、pCAG-cfl1-S3A和pCAG-cfl1-S3D转染细胞,以未转染质粒的正常CHO细胞作为对照(Control)。
1.4.2 Cfl1 mRNA表达量的半定量RT-PRC分析 将真核重组质粒转染的CHO细胞培养24 h后提取总RNA,备用。设计半定量引物F/P5和R/P5(表1),以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,检测重组质粒的表达能力。以总RNA为模板,反转录获得cDNA,反应体系为:总RNA 2.5 μg,5×Reaction Buffer 4 μL,OligodT 2 μL,10 mmol/L dNTPs 1 μL,RNase Inhibitor 1 μL,RT-Enzmye 1 μL,用DEPC水补足20 μL体系。以反转录产物为模板,进行目的片段的扩增,反应体系为:2×TaqPCR StarMix 10 μL,F/P5 0.75 μL,R/P5 0.75 μL,cDNA 5 μg,用ddH2O补足25 μL体系。反应程序如下:94 ℃预变性2 min;94 ℃变性30 s,58 ℃退火30 s,68 ℃延伸30 s,共30个循环;68 ℃后延伸5 min。取PCR产物20 μL进行10 g/L琼脂糖凝胶电泳。

图 1 pCAG-cfl1-myc真核表达载体的构建原理
1.4.3 细胞爬片的免疫荧光染色 制备CHO细胞爬片,待细胞融合度达到25%~40%时,根据LipofectamineTM2000使用说明用pCAG-cfl1的3种真核表达载体转染CHO细胞,24 h后,爬片经40 g/L多聚甲醛固定、体积分数0.1% Triton X-100透化、体积分数1% BSA封闭,各步间漂洗用0.1 mol/L PBS。F-actin经TRITC-conjugated Phalloidin (体积比1∶4 000)室温染色2 h,经PBS漂洗后,用DAPI (体积比1∶500)标记细胞核。用抗荧光淬灭剂(Dako)将漂洗后的爬片固定在载玻片上,晾干后置于结构照明显微镜Axio Observer Z1(蔡司)下,观察重组质粒在细胞中的表达情况。
1.5 小鼠cfl1基因在鸡胚脊髓中的表达
1.5.1 pCAG-cfl1的鸡胚活体原位电转 在37 ℃、相对湿度65%条件下对种蛋进行孵化,在胚胎发育第3天(E3)取出鸡胚,侧面开直径2~3 cm大小的孔,在体视显微镜下,使用毛细管注射针将pCAG-cfl1的3种质粒分别与pCAG-EGFP按4∶1体积比配制的工作液0.1~0.5 μL准确注射到脊髓腔,将针状电极置脊椎两侧,确保电极与组织之间有一定空隙,使用BTX ECM830电转仪进行电转,电转电压18 V,每次电击60 ms,间隔100 ms,电脉冲6次,整个过程在无菌操作工作台内完成,以pCAG-EGFP转染脊髓作为对照(Control)。转染后3 d取出,在显微镜下观察结果,电转部位呈现绿色荧光者(绿色荧光蛋白GFP的颜色)视为阳性。
1.5.2 鸡胚切片的制备 在倒置体视显微镜下观察阳性表达的胚胎。在倒置体视显微镜下,用尖头镊子划破卵黄膜,取出整个胚胎,转移至4 ℃多聚甲醛中,在摇床上固定3 d,取出组织,吸干液体,用40 g/L琼脂糖包埋, 注意方向,头朝上,确定好位置,在Leica全自动振荡切片机上连续切片,切片厚度为80 μm,置于含体积分数0.1% NaN3的0.1 mol/L 磷酸缓冲液(PB)中于4 ℃下保存。
1.5.3 组织切片的免疫荧光染色 将组织切片从4 ℃冰箱中取出,用0.1 mol/L PB漂洗3次,用Anti-Myc Tag Monoclonal Antibody、Rabbit-anti-GFP 4 ℃过夜孵育组织切片,PB漂洗后,分别用Donkey-anti-rabbit-488、Goat-anti-mouse-568 4 ℃过夜孵育。经PB漂洗后,用DAPI(体积比1∶500)标记细胞核。用抗荧光淬灭剂(Dako)将漂洗后的组织切片固定在载玻片上,晾干后置于结构照明显微镜Axio Observer Z1下,观察重组质粒在神经元中的表达情况。
1.6 统计分析
将转染后的组织切片经免疫荧光染色后,在结构照明显微镜Axio Observer Z1下拍照。在照片中荧光较强的部位选取200 μm×200 μm大小的面积,通过ImgeJ对转染神经元进行计数。利用GraphPad Prism 5.0软件对转染神经元的统计数据进行t检验。
2 结果与分析
2.1 不同物种Cfl1蛋白的氨基酸序列比对
小鼠Cfl1蛋白是由166个氨基酸编码的蛋白质。氨基酸多序列比对结果见图2。
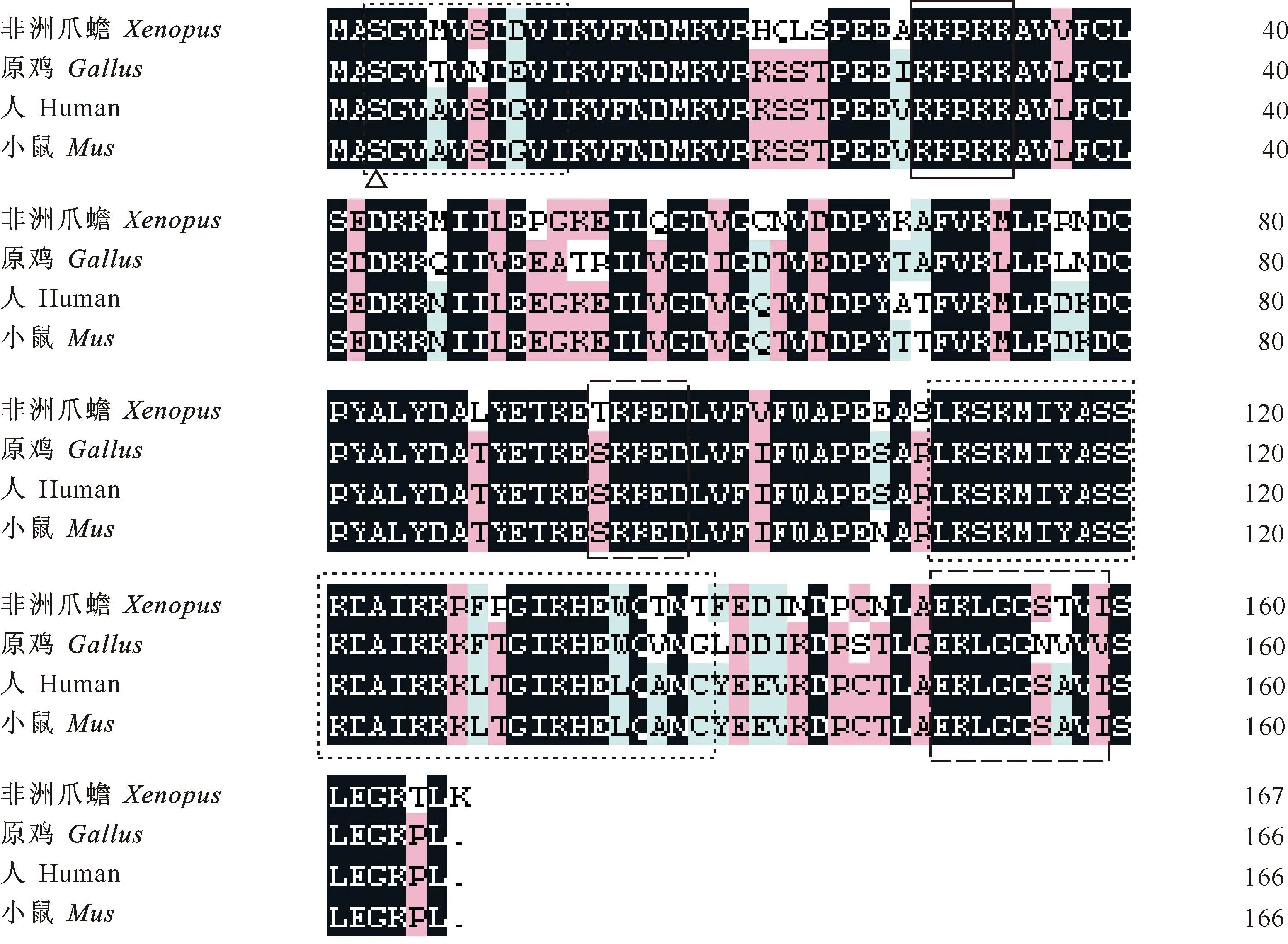
图 2 不同物种Cofilin-1 (Cfl1)蛋白的氨基酸序列比对结果
图2显示,小鼠与人类Cfl1蛋白的氨基酸序列同源性为98.8%,与原鸡的Cfl1蛋白的氨基酸序列同源性为81.3%,与非洲爪蟾Cfl1蛋白的氨基酸序列同源性为77.3%。不同物种的Cfl1蛋白肌动蛋白和肌球蛋白的结合区域相似度较高,关键区域的保守性较高,如与Cfl1磷酸化状态相关的S3位点以及核定位信号 K30-K34等。
2.2 cfl1基因重组真核表达载体的鉴定
经PCR扩增,获得cfl1的CDS序列,构建出pEASY-T1-cfl1重组克隆质粒。以构建的pEASY-T1-cfl1重组克隆质粒为模板,利用加有酶切位点和特定位点点突变的引物进行PCR扩增,获得cfl1的不同突变体(Cfl1-wt、Cfl1-S3A、Cfl1-S3D),其经10 g/L琼脂糖凝胶电泳,出现大约520 bp的片段(图3-A),与预期条带大小相符。用EcoRⅠ和BglⅡ双酶切回收产物和pCAG-MCS-myc,依次构建真核重组表达载体pCAG-cfl1-wt、pCAG-cfl1-S3A和pCAG-cfl1-S3D,限制性酶切产物中均出现了5 200 bp左右的载体骨架和500 bp左右的插入片段(图3-B),与预期结果一致。真核重组表达载体的测序结果显示,本试验成功构建了Cfl1野生型的表达载体pCAG-cfl1-wt及Cfl1的磷酸化及去磷酸化突变载体pCAG-cfl1-S3D和pCAG-cfl1-S3A。野生型Cfl1的第3个氨基酸是丝氨酸(S),密码子是UCU;Cfl1的类磷酸化突变体第3位是天冬氨酸(D),密码子是GAU;Cfl1的去磷酸化突变体第3位是丙氨酸(A),密码子是GCU(图3-C)。
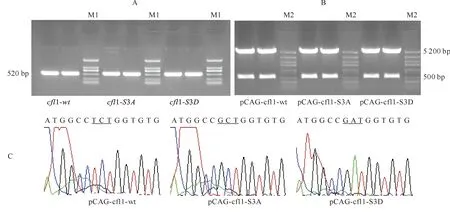
图 3 cfl1基因重组真核表达载体的构建与区分
2.3 cfl1基因重组质粒在CHO细胞中的表达检测
重组质粒转染CHO细胞24 h后,提取总RNA,利用半定量RT-PCR检测构建质粒表达的强弱。由图4-A可以看出,对照组细胞与转染空载体pCAG-MCS-myc的Cfl1 mRNA表达无明显差异;处理组pCAG-cfl1-wt、pCAG-cfl1-S3A和pCAG-cfl1-S3D的Cfl1 mRNA表达均比转染pCAG-MCS-myc的细胞强。采用GraphPad Prism 5.0软件对采集到的灰度值进行分析,其结果与半定量RT-PCR结果一致。由图4-B可知,转染重组质粒的CHO细胞中,Cfl1 mRNA表达量较对照明显升高,说明转染的能够表达Cfl1的质粒正确表达了Cfl1蛋白;同时,转染pCAG-cfl1-wt与pCAG-cfl1-S3A的CHO细胞对Cfl1 mRNA表达无显著差异,而转染pCAG-cfl1-S3D的CHO细胞对Cfl1 mRNA的表达较pCAG-cfl1-wt和pCAG-cfl1-S3A明显增强。
将转染重组质粒的CHO细胞爬片进行免疫荧光染色,用Anti-Myc Tag Monoclonal Antibody对重组质粒表达的融合蛋白进行标记,观察到重组质粒在CHO细胞中可正常表达,且融合蛋白的表达量较高(图4-C)。
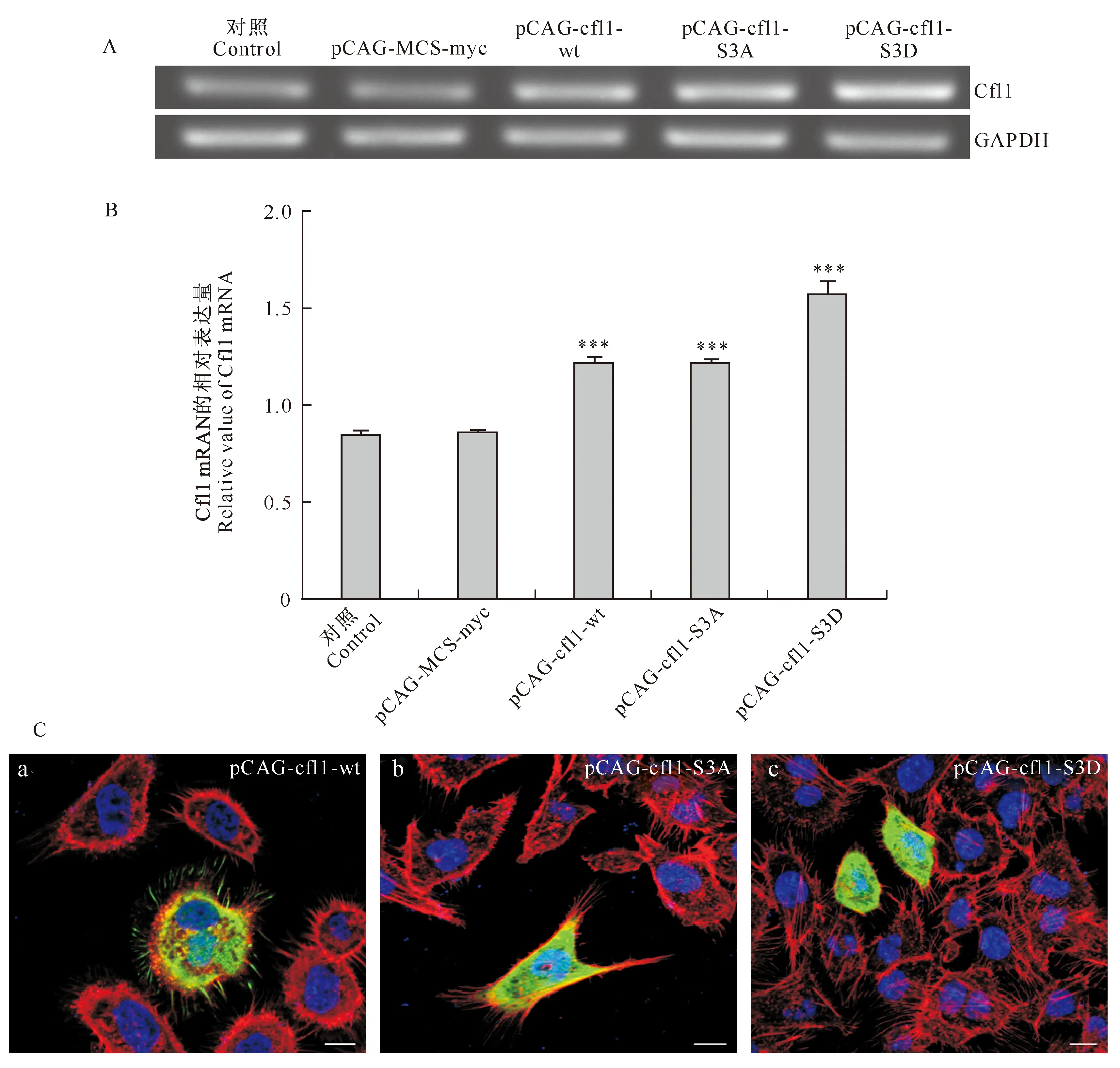
图 4 cfl1基因重组质粒在CHO细胞中的表达
用TRITC-conjugated Phalloidin对F-actin进行标记,正常CHO细胞呈不规则形,胞体较大,胞浆丰富,轮廓清楚,细胞核卵圆形,位于胞质中央,细胞密集时呈长梭形,无伪足或伪足较少,细胞稀疏时伸出伪足,标记的F-actin位于细胞质及伪足中(图5-a,b)。在转染pCAG-cfl1-wt的CHO细胞中,伪足均匀分布在细胞周围,且F-actin较长(图5-c);在标记myc后,可观察到重组质粒所表达的融合蛋白分散在细胞核周围,且存在点状分布,在细胞周围的伪足中均有分布,大部分与F-actin重合[16](图5-d)。在转染pCAG-cfl1-S3A的细胞中,可观察到细胞周围的微丝呈簇状分布(图5-e),且分布位置集中在融合蛋白表达较强的部位(图5-f);而在转染pCAG-cfl1-S3D的细胞中,转染细胞的微丝分布无明显变化(图5-g,h),其对肌动蛋白的影响有待进一步研究。

图 5 Cfl1超表达对CHO细胞肌动蛋白(F-actin)的影响
2.4 cfl1基因重组质粒在鸡胚脊髓中的表达检测
对采集的GFP阳性材料进行切片,在体视显微镜下挑出绿色荧光表达较强的切片进行免疫荧光染色,在倒置荧光显微镜下观察,结果均检测到了构建质粒的表达(图6-A),其中对照组荧光染色图为转染等浓度pCAG-EGFP的鸡胚脊髓图。为了验证构建质粒在神经元中表达的高效性,利用ImgeJ对所选区域目的质粒表达阳性的神经元进行计数,采用GraphPad Prism 5.0软件对采集到的数据进行统计,t检验结果表明,在所选取的相同面积内,pCAG-cfl1-wt、pCAG-cfl1-S3A和pCAG-cfl1-S3D与等浓度GFP转染神经元的个数无明显差异 (图6-B),证明了重组质粒在神经元中表达的高效性。
3 讨 论
Cofilin是肌动蛋白结合蛋白,是中枢神经系统中主要的肌动蛋白解聚因子。在小鼠胚胎发育第10天(E10),cfl1开始在神经管中表达,从胚胎发育第13天(E13)开始,cfl1在中枢神经系统中的表达明显增强,一直维持到小鼠出生,然后有所下降[7-8],而胚胎发育第13天至小鼠出生正是大脑神经元产生和迁移的时期,这表明cfl1与神经元迁移有着密切的关系。cfl1基因敲除会导致胚胎发育严重异常,所有胚胎都在胚胎发育中后期死亡(E10~E19),胚胎发育障碍的主要表现之一是神经管未闭合,神经系统不能发育[17],表明cfl1对中枢神经系统的发育至关重要。

图 6 cfl1基因重组质粒在鸡胚脊髓神经元中的表达
然而,cfl1在体内神经系统中的研究相对困难,导致了cfl1在神经元迁移中的作用机制尚不明确。为此,笔者在试验中采用了活体原位电转基因技术。它能够将重组质粒转入神经元中,是体内研究功能基因的有效方法之一。在电转过程中,由于质粒带负电荷使其向正极方向移动,可瞬时进入细胞,利用表达载体自身的系统进行蛋白质的合成,能够很直观地检测目的蛋白的表达情况以及对转染细胞的影响。该方法为进一步研究Cofilin-1在神经系统发育过程中对神经元迁移的影响提供了技术保障。
此外,Cofilin是普遍存在于真核细胞的一种肌动蛋白结合蛋白,当外源转染能够表达Cofilin的重组质粒时,必须保证能够有效地区分内、外源Cofilin。因此,本试验中使用了带有常规抗原标签c-Myc的真核表达载体pCAG-MCS-myc作为载体骨架。c-Myc是一种常用的短肽标签,不仅有利于对重组蛋白检测,而且不会影响目的蛋白的理化性质[18]。根据这一点,经免疫荧光染色即可区分外源表达的Cofilin蛋白。
经过CHO细胞转染和鸡胚脊髓电击转染的检测,证明本研究所构建的pCAG-cfl1-wt、pCAG-cfl1-S3A和pCAG-cfl1-S3D 3种真核表达载体在体外和体内都能够高效表达,为进一步探讨Cofilin-1对神经元的调控机制奠定了基础。
[参考文献]
[1] Nishida E,Maekawa S,Sakai H.Cofilin,a protein in porcine brain that binds to actin filaments and inhibits their interactions with myosin and tropomyosin [J].Biochemistry,1984,23(22):5307-5313.
[2] Endo M,Ohashi K,Sasaki Y,et al.Control of growth cone motility and morphology by LIM kinase and slingshot via phosphorylation and dephosphorylation of cofilin [J].Neurosci,2003,23:2527-2537.
[3] Kiuchi T,Ohashi K,Kurita S,et al.Cofilin promotes stimulusinduced lamellipodium formation by generating an abundant supply of actin monomers [J].Cell Biol,2007,177:465-476.
[4] Bernstein B W,Bamburg J R.ADF/cofilin:A functional node in cell biology [J].Trends Cell Biol,2010,20(4):187-195.
[5] Wang W,Mouneimne G,Sidani M,et al.The activity status of cofilin is directly related to invasion,intravasation,and metastasis of mammary tumors [J].Cell Biol,2006,173:395-404.
[6] Ikeda S,Cunningham L A,Boggess D,et al.Aberrant actin cytoskeleton leads to accelerated proliferation of corneal epithelial cellsin mice deficient for destrin (actin depolymerizing factor) [J].Hum Mol Genet,2003,12:1029-1037.
[7] Gurniak C B,Perlas E,Witke W.The actin depolymerizing factor n-cofilin is essential for neural tube morphogenesis and neural crest cell migration [J].Dev Biol,2005,278(1):231-241.
[8] Bellenchi G C,Gurniak C B,Perlas E,et al.N-cofilin is associated with neuronal migration disorders and cell cycle control in the cerebral cortex [J].Genes Dev,2007,21(18):2347-2357.
[9] Bamburg J R,Wiggan O P.ADF/cofilin and actin dynamics in disease [J].Trends Cell Biol,2002,12:598-605.
[10] Ohta Y,Kousaka K,Nagata-Ohaslli K,et al.Differential activities,subcellular distribution and tissue expression patterns of three members of the slingshot family phosphatases that dephosphorylate cofilin [J].Genes Cell,2003,8:811-824.
[11] Huang T Y,Der Mardirossian C,Bokoch G M.Cofilin phosphatases and regulation of actin dynamics [J].Curr Opin Cell Biol,2006,18:26-31.
[12] Meber P J,Bamburg J R.Increase in neurite outgrowth mediated by overexpression of actin depolymerizing factor [J].Neurosci,2000,20:2459-2469.
[13] Nishita M,Tomizawa C,Yamamoto M,et al.Spatial and temporal regulation of cofilin activity by LIM kinase and slingshot is critical for directional cell migration [J].Cell Biol,2005,171:349-359.
[14] Gunsalus K C,Bonaccorsi S,Williams E,et al.Mutations in twinstar,a drosophila gene encoding a cofilin/ADF homologue, result in defects in centrosome migration and cytokinesis [J].Cell Biol,1995,131:1243-1259.
[15] Hotulainen P,Paunolla E,Vartiainen M K,et al.Actin depolymerizing factor and cofilin-1 play overlapping roles in promoting rapid F-actin depolymerization in mammalian non-muscle cells [J].Mol Biol Cell,2005,16:649-664.
[16] Nagaoka R,Kusano K,Abe H,et al.Effects of cofilin on actin filamentous structures in cultured muscle cells:Intracellular regulation of cofilin action [J].Cell Sci,1995,108:581-593.
[17] Saito T.Invivoelectroporation in the embryonic mouse central nervous system [J].Nature Protocols,2006,1:1552-1558.
[18] 陈爱春,彭 伟,汪生鹏.亲和标签在重组蛋白表达与纯化中的应用 [J].中国生物工程杂志,2012,32(12):93-103.
Chen A C,Peng W,Wang S P.Progress in the application of affinity tags for the expression and purification of recombinant proteins [J].China Biotechnology,2012,32(12):93-103.(in Chinese)

